低温胁迫下外源SOD对矮牵牛生理特性的影响
2021-11-05王晓晓
王晓晓
(重庆大学城市科技学院, 重庆 402167)
矮牵牛(Petuniahybrida)生存于南美洲地区,作为一种易存活的园林观赏植物,矮牵牛如今在多个国家广泛种植。矮牵牛属于多年生草本植物,株高一般在15~80 cm之间,叶子为椭圆形或者卵圆形,花冠酷似喇叭状,当年播种即可开花数月。矮牵牛更容易在阳光充足、温暖的环境中生存,其缺点是惧怕雨水、不耐低温霜冻。如果冬季生存温度达不到4 ℃,矮牵牛植株则停止生长。对于冬季温度在4 ℃左右、甚至达不到4 ℃的种植环境而言,矮牵牛在低温胁迫下越冬生存面临困境。因此,充分了解低温冷害对矮牵牛生长过程的影响引起了园林植物研究领域的重视[1]。
超氧化物歧化酶(SOD)是植物抗性系统酶,当植物遭受低温胁迫时,SOD等多种抗氧化酶活性产生变化以避免植物膜组织受损伤,赋予了植物抵抗逆境胁迫的能力[2]。在提供植物生长所需外源SOD、生长能量方面发挥重要作用,有效辅助低温下植物快速生长[3]。因此,为改善植物的低温抗逆性,可对低温胁迫下生长的植物施加外源SOD。超氧化物歧化酶模型化合物是外源SOD的重要形式,一方面可提高植物抗旱、抗寒、抗病等能力,兼具农药与微肥作用;另一方面,在稳定性与高效性方面表现显著,汲取了天然酶与人工合成化合物的优势。
聚天冬氨酸锰(MSOD)作为一种人工合成化合物,对植物生长促进作用十分显著[4]。根据现有研究成果可知,MSOD在提高植物抗寒、抗旱、抗病、吸收肥料养分能力等方面发挥着重要作用,MSOD不仅能够改善植物抗逆性,还能促进植物生长发育,起到施加微肥与药物的作用[5-6]。因此本研究选定MSOD作为外源模拟物,以园林植物矮牵牛作为研究对象,记录正常温度处理、普通低温处理、低温胁迫施加MSOD处理3种方式下矮牵牛生理特性变化,以获取低温胁迫下外源SOD对矮牵牛生理特性的影响规律。此研究对于改善园林植物矮牵牛低温冷害环境下的生长状态、帮助矮牵牛适应低温环境具有指导意义,令低温逆境中生存的矮牵牛安全越冬。此外,MSOD分子量适宜、没有毒性、水溶性优,应用与推广前景广阔,是当前植物生长抗逆领域的研究热点。
1 材料与方法
1.1 样品培育
本研究矮牵牛试验品种来自四川农业大学,随机选取优质矮牵牛种子对其进行种植前处理。首先,采用0.1%浓度的升汞对矮牵牛种子表皮进行消毒,持续3 min,消毒完毕使用蒸馏水多次冲洗种子;其次,种子浸泡10 h,于培养皿中进行种子培育,直至种子发芽;培育环境温度设置在25 ℃左右,每天给矮牵牛交替施加12 h 25 ℃光照处理、12 h 18 ℃黑暗处理。试验所需外源SOD人工合成模拟物MSOD购自德赛化工有限公司,其外观呈现黄色至红棕色,状态粘稠;MSOD基本属性如下:pH值8.5~10.5,固体成分超过30%,当环境温度低于20 ℃时其密度不小于1.15。当矮牵牛生长成幼苗时移栽至大型种植容器中进行低温胁迫测试,试验前定制占地面积为0.16 m2(长宽各为40 cm)、高度0.15 m的栽种容器,挑选长势一致的矮牵牛幼苗分别种植在容器中,栽种15盆待用。
1.2 样品处理
矮牵牛植株样品类型划分如下:1) ck1:将一盆矮牵牛植株置于正常温度环境下生长;2) 低温胁迫施加MSOD处理:矮牵牛生长处于“三叶一心”状态时将3盆矮牵牛植株置于低温环境下生长,并施加不同含量的MSOD,X1为施加2.5 mg·L-1浓度的植株,X2为施加5.5 mg·L-1浓度的植株,X3为施加8.5 mg·L-1浓度的植株。3) ck2将一盆矮牵牛置于低温环境下生长,施加清水代替MSOD。每个处理3次重复,各处理的管理措施相同。
矮牵牛低温环境处理的具体方法如下:1) 第一阶段是冷驯化期:每天给矮牵牛交替施加12 h 11 ℃的光照处理、12 h 5 ℃黑暗处理,光照强度上限设置为2 000 lx。2) 第二阶段是低温胁迫处理期:在冷驯化期一个月之后执行,由于矮牵牛外界环境达到0 ℃时基本停止生长,所以低温胁迫环境温度不能低于0 ℃,因此每天给矮牵牛交替施加12 h 2 ℃的光照处理、12 h 0 ℃黑暗处理,光照强度上限仍为2 000 lx。MSOD、清水要每隔7 d喷施1次,喷施3次后进行样品采集并进行生理指标测定。
1.3 生理指标测定
当矮牵牛植株生长至花蕾期,在同一天内进行矮牵牛叶片采样,所有采样过程中均尽量挑选植株相同部位叶片,降低外部因素导致的叶片生理指标差异;样品采摘后清洗存放在4 ℃环境中保存待用。
1) 生长指标测定:矮牵牛试验处理全部结束后,使用高精度仪器测量茎基部和顶叶叶尖间距,即茎叶长度;将最长根系作为根长测量对象,测量根基部至根尖间距,即根部长度;每种MSOD浓度下各采集6份样品取其均值,保障矮牵牛生长指标测定的精准度,最后统计不同处理下矮牵牛的侧根数量[7]。
2) POD活性测定:基于愈创木酚法测定POD酶活性[8]。
3) 全氮含量测定:分别使用半微量凯氏定氮法、钒钼黄比色法、火焰光度法测定矮牵牛植物体内氮磷钾含量[9]。以上指标测定与测量需要重复执行3次,取平均值作为最终测定结果。
1.4 数据处理
采用Excel 2017与SPSS 20.0统计分析软件完成数据处理与分析,采用visio软件绘制结果趋势图。
2 结果与分析
2.1 低温胁迫下外源SOD对矮牵牛生长指标的影响
本研究使用根系长度、茎叶的长度、根部须数描述矮牵牛生长情况,分析不同浓度MSOD在低温环境下对矮牵牛生长的促进作用(图1)。总体而言,低温胁迫环境下矮牵牛施加MSOD能够促进其多项生长指标的发展。正常温度环境下生长的矮牵牛(ck1)侧根数量最多,茎叶长度、根部长度最大;低温环境下生长仅施加清水的矮牵牛(ck2)侧根数量最少、茎叶长度、根部长度最小,由此可见,低温阻碍了矮牵牛的正常生长。同样低温环境下施加MSOD的样本呈现优于ck2的生长趋势,在本研究范围内,MSOD浓度越高、样本长势越好。低温环境下施加8.5 mg·L-1浓度的MSOD矮牵牛样本,侧根数量达到9,与正常温度环境生长的样本持平,茎叶长度与根部长度分别达到3.63 cm、5.01 cm,接近正常温度环境生长情况。因此,低温环境下适量添加MSOD有助于矮牵牛生长指标的提升,对其生长具有促进作用。此外,当MSOD施加浓度为8.5 mg·L-1时,和ck2相比,矮牵牛的茎叶长度、侧根数量、根部长度均表现出显著相关性(p<0.05)。
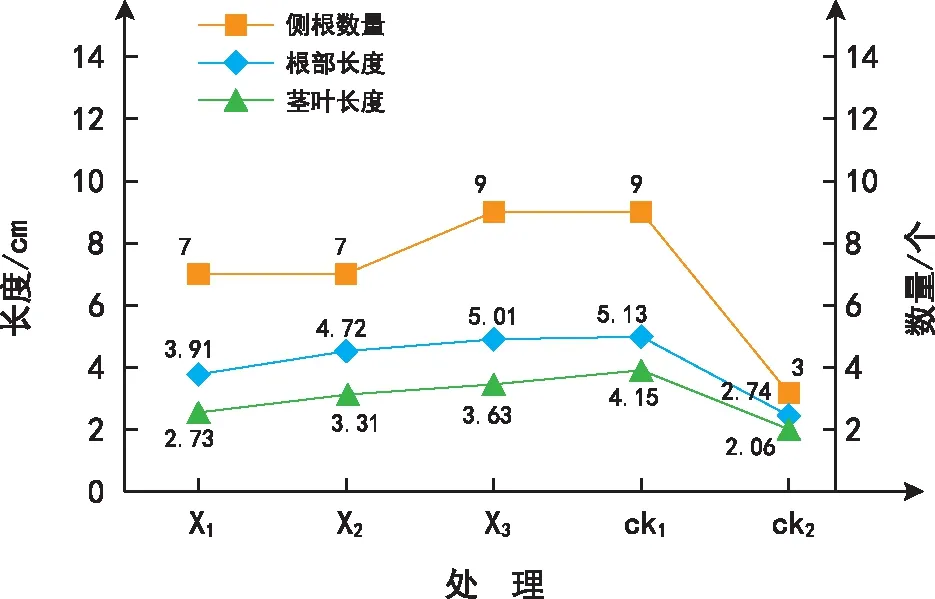
图1 矮牵牛生长指标趋势
2.2 低温胁迫下外源SOD对矮牵牛POD指标的影响
作为清除活性氧的关键酶,POD在避免膜质氧化、促进植物生长发育、抗病、抗寒方面贡献突出。在一个氧化还原反应中,如果采用的氧化剂为过氧化氢,那么过氧化物POD能够对这段氧化还原反应产生加速催化作用,将过氧化氢还原成水。POD将过氧化氢还原成水的过程有利于平衡植物体内活性氧的分布,因此判断矮牵牛抗寒能力的研究可引入POD酶活性指标作为参考。由图2可知,ck2处理下的POD酶活性最低,ck1处理下的POD酶活性最高,这是因为随着矮牵牛温度的降低其植物体内的POD酶活性能力被弱化。低温环境胁迫下,采用2.5 mg·L-1浓度MSOD、5.5 mg·L-1浓度MSOD、8.5 mg·L-1浓度MSOD处理下的矮牵牛植株POD酶活性分别提高了4.1%、7.8%、17.9%,和ck2相比差异显著(p<0.05)。其中,8.5 mg·L-1浓度MSOD处理下矮牵牛POD酶活性最接近正常温度生长下的活性值。由此可见,8.5 mg·L-1浓度MSOD提高植物POD酶活性的效果最为明显,增强了矮牵牛安全越冬的能力。综上所述,低温弱化了矮牵牛的POD酶活性,而MSOD可提高矮牵牛的POD酶活性。
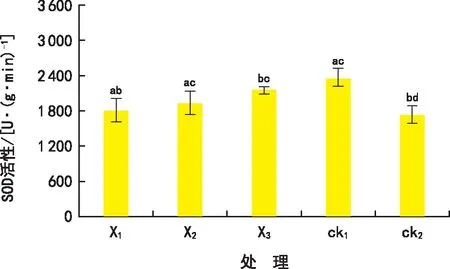
图2 低温胁迫下矮牵牛POD酶活性指标测定
2.3 低温胁迫下外源SOD对矮牵牛生长适应度的影响
氮磷钾是调节矮牵牛生长的关键元素,能够准确表征矮牵牛营养水平。由表1可知:正常温度环境下生长的矮牵牛氮磷钾元素含量最高,吸收营养元素的能力最强,表现出良好的生长适应性;而低温胁迫环境下没有施加MSOD的植物样本氮磷钾元素含量最低。和ck2相比,施加MSOD处理下的样本营养元素含量较高,例如X1、X2、X3处理下的矮牵牛氮元素含量增加了7.6%、29.3%、42.4%。由此可见,低温胁迫环境下矮牵牛施加MSOD能够提高植物吸收营养元素的能力,以更好的适应生长环境。施加不同浓度MSOD的矮牵牛表现出不同的氮磷钾元素含量,在氮元素和钾元素方面:X3>X2>X1,在磷元素方面:X2>X3>X1。在本研究范围内,MSOD浓度越高、矮牵牛氮钾营养元素吸收越好;而5.5 mg·L-1浓度MSOD就可以满足植物体内磷吸收需要,即使增加MSOD浓度,促进矮牵牛磷元素吸收的作用不大。

表1 不同处理方式下矮牵牛氮磷钾含量情况
3 讨论与结论
全球极端天气频发会对草本植物自然生长产生一定威胁,一些植物很难在严酷的低温环境中生存[10]。低温胁迫下MSOD对矮牵牛生长指标的研究显示,不同浓度MSOD均能优化草本植物矮牵牛的生长指标,加快茎叶、根部的生长速度,生长效果接近于正常温度培育的植株水平,因此外源SOD能够帮助矮牵牛在寒冷的冬季正常生长[11]。2.5 mg·L-1、5.5 mg·L-1、8.5 mg·L-13个浓度MSOD处理下的植株相比清水处理均表现出良好的生长特征,且浓度越高效果越显著。
3.1 低温胁迫下外源SOD对矮牵牛生长指标的影响
低温胁迫下外源SOD对矮牵牛POD酶活性生理指标影响显著,对植物施加低温胁迫作用时,植物体内容易大量积累自由基,打破了植物细胞活性氧生产与清除系统平衡规律,不仅致使植物细胞脂质过氧化而且损坏了植物细胞原有结构,这一系列的非正常规律导致植物细胞膜非正常代谢[12]。本研究结果表明,低温胁迫环境下,8.5 mg·L-1浓度MSOD处理下矮牵牛POD酶活性提高了68.2%,外源SOD能够有效提高草本植物体内的POD酶活性,提高植物的抗寒能力,这是因为低温环境下生存的草本植物对上述现象产生适应性,植物细胞内的过氧化物酶(POD)保护系统共同努力、相互协作消除了植物积累的自由基[13,14],保障了植物自身的正常代谢功能。
3.2 低温胁迫下外源SOD对矮牵牛POD指标的影响
SOD酶、POD酶提高植物抗寒能力的作用机理为:植物由于低温胁迫积攒大量自由基存储在体内,SOD是处理植物体内活性氧的关键抗氧化酶,在多种抗氧化酶系统中SOD占据活性氧清除反应核心位置,因为SOD具有促进超氧阴离子发生歧化反应功能,解决了高毒性活性氧的催化问题[15]。SOD开启了清除植物自由基的第一道门槛,随后POD酶以及过氧化氢酶(CAT)等其他酶系统将剩余H2O2分解,多种酶协调分工使植物生理水平回归平衡。此外,已有研究显示[16],矮牵牛在低温环境胁迫下容易改变植物体内SOD酶、POD酶、CAT酶含量,甚至干扰其膜质过氧化水平,本研究结果与其一致。
3.3 低温胁迫下外源SOD对矮牵牛生长适应度的影响
根据矮牵牛植物体内氮磷钾含量测定结果可知,MSOD能够在低温环境下增加矮牵牛体内氮磷钾含量,帮助矮牵牛更好的适应寒冷的生长环境,此时MSOD发挥着增效剂的作用。这是因为MSOD本身兼有农药和微肥作用,不仅展现了超强的抗寒性能,还能起到促进草本植物生长的作用。但是MSOD的增效作用在磷元素方面出现波动,这可能是MSOD自身携带负电荷基团,吸附HPO42-的效果不理想,而吸附NH4+、K+能力强的结果造成的。
通过本研究可知:在低温胁迫环境下草本植物矮牵牛的生长指标、SOD酶活性、POD酶活性、营养吸收能力下降,合理设置外源SOD施加量能够优化矮牵牛生长指标、提高POD酶活性、增加氮磷钾元素的吸收能力。在本研究条件下,施加8.5 mg·L-1浓度MSOD的矮牵牛各项指标优化明显。所以,本研究使用的外源SOD模拟物MSOD有助于提高矮牵牛的抗寒性、改善生长指标、优化营养吸收能力。抗寒性作为草本植物的重要生理指标之一,在植物研究领域得到广泛关注。目前,外源SOD模拟物在植物抗寒领域的研究取得了阶段性成果,但是仅依靠POD等酶活性指标定义草本植物的抗寒程度还不够全面,今后的研究中需要继续扩大植物抗寒指标的研究范围,丰富园林观赏植物抗寒性机理的相关研究成果。
