Notch家族成员遗传学变异预示乳头状 甲状腺癌高复发风险
2018-09-07施秉银
强 薇,袁 佳,2,陈 谱,施秉银
(1. 西安交通大学第一附属医院内分泌科,陕西西安 710061;2. 民航西安医院,陕西西安 710082)
作为最常见的内分泌系统肿瘤,甲状腺癌近年来全球发病率迅速升高[1],不仅加重医保负担,而且危害人民生命健康。其发病率女性高于男性,2012年全球女性约有229 900例新发病例[2],在我国,甲状腺癌已跃居为30岁以下女性发病率最高的肿瘤[3]。甲状腺癌中以乳头状甲状腺癌(papillary thyroid carcinoma, PTC)最为常见,占75%~80%[4]。尽管绝大多数PTC患者预后较好,仍有部分患者因肿瘤复发导致不良结局。因此,筛查具有潜在复发风险的PTC可使诊治更加有的放矢,达到医疗资源优化配置,意义重大。
Notch信号通路参与造血、心脏发育等重要进程[5-7],其活性异常与肿瘤、自身免疫性疾病、先天性疾病等密切相关[8-10]。研究发现,Notch信号通路在不同组织类型的肿瘤甚至同一肿瘤的不同阶段功能迥异。其在乳腺癌、胃癌、结肠癌等肿瘤中具有促癌作用[11],而在肝癌、前列腺癌等肿瘤中具有抑癌作用[12]。与上述肿瘤中单向表达趋势不同,在宫颈癌中随肿瘤进展NOTCH1表达水平先降后升,提示其可能在早期具有抑癌作用,晚期则促进肿瘤进展[13]。
本研究对The Cancer Genome Atlas(TCGA)数据库中508位PTC患者的芯片数据结合临床资料进行分析,明确Notch家族成员NOTCH1、NOTCH2、NOTCH3及NOTCH4在PTC中的表达情况,研究其异常与临床病理特征及肿瘤复发的相关性。
1 材料与方法
1.1数据来源对TCGA数据库中甲状腺癌(THCA)数据进行分析,其中包括508位患者的516例PTC标本,以及59例正常甲状腺组织 (http://www.cbioportal. org/study?id=thca_tcga#summary),下载相应临床病理及RNA Seq芯片数据。
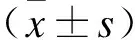
1.3基因差异表达及信号通路富集分析差异基因功能及信号通路富集分析应用cBioPortal及KEGG进行。
2 结 果
2.1Notch信号通路在PTC中的表达对516例PTC数据分析结果显示,PTC组织NOTCH1、NOTCH3、NOTCH4 mRNA水平相较于正常甲状腺组织上调(9.627±0.028vs. 9.354±0.082,P=0.017;11.23±0.032vs. 10.150±0.080,P<0.001;9.964±0.039vs. 9.001±0.067,P<0.001),而NOTCH2 mRNA水平无显著变化(11.960±0.037vs. 11.990±0.071,P=0.777,图1)。508位PTC患者中,95位(19%)癌组织中NOTCH1(8%)、NOTCH2(5%)、NOTCH3(6%)、NOTCH4(5%)发生遗传学异常改变[包括基因扩增、删失、错义突变,以及mRNA表达z-Scores(RNA Seq V2 RSEM)、蛋白表达Z-scores(PRRA)上调或下调2.0以上,图2A],每位患者上述分子mRNA表达见图2B。其中NOTCH1和NOTCH3、NOTCH1和NOTCH4、NOTCH3和NOTCH4遗传变异有共存倾向(OR=74.131,P<0.001;OR=366.438,P<0.001;OR=34.594,P=0.011,表1)。
2.2不同TNM分期PTC中Notch分子表达情况将508例患者据不同临床病理特征分组,比较其NOTCH1、NOTCH2、NOTCH3、NOTCH4 mRNA水平,我们发现不同年龄(<30、30~65、≥65岁)、性别、甲状腺放射线暴露史及一级亲属甲状腺癌病史的患者上述分子表达无统计学差异,而不同癌灶起源、瘤体大小、甲状腺包膜浸润及淋巴结转移的患者上述分子表达亦未见统计学差异。将肿瘤根据TNM分期进行分组,比较上述分子mRNA表达水平(图3),NOTCH1、NOTCH3、NOTCH4呈现出先升后降的趋势 (9.571±0.642、9.808±0.565、9.721±0.585、9.487±0.600,P=0.014;11.156±0.706、11.340±0.680、11.367±0.717、1.167±0.775,P=0.013;9.552±0.895、10.015±0.811、9.865±0.811、9.530±0.817,P<0.001)。而NOTCH2则呈现相反的趋势,在Ⅱ期达到谷底后回升(12.012±0.808、11.652±0.883、11.961±0.856、12.117±0.761,P=0.011)。

图1PTC及正常甲状腺组织中Notch家族成员NOTCH1、NOTCH2、NOTCH3和NOTCH4的mRNA表达情况
Fig.1 The mRNA expressions of NOTCH1, NOTCH2, NOTCH3 and NOTCH4 in PTC and normal thyroid tissues
T:肿瘤;N:正常。

图2Notch家族成员在PTC中的遗传变异
Fig.2 Genetic alterations of Notch family members in PTC
A:Notch家族成员在PTC中的遗传变异频率及类型;B:PTC患者Notch家族成员mRNA表达热图。
表1NOTCH1、NOTCH2、NOTCH3和NOTCH4基因异常互斥性分析
Tab.1 Analysis of mutual exclusivity among NOTCH1, NOTCH2, NOTCH3 and NOTCH4 in PTC

Gene AGene BPORAssociationNOTCH1NOTCH4<0.001366.438Tendency towards co-occurrenceNOTCH1NOTCH3<0.00174.131Tendency towards co-occurrenceNOTCH3NOTCH40.01134.594Tendency towards co-occurrenceNOTCH2NOTCH40.295<0.001Tendency towards mutual exclusivityNOTCH1NOTCH20.4444.519Tendency towards mutual exclusivityNOTCH2NOTCH30.5872.317Tendency towards mutual exclusivity

图3Notch家族成员在不同TNM分期PTC中的mRNA表达
Fig.3 The mRNA expressions of NOTCH1, NOTCH2, NOTCH3 and NOTCH4 in PTC of different TNM stages
2.3Notch基因异常与甲状腺癌患者无病生存期比较根据是否存在Notch信号通路遗传学异常[包括基因扩增、删失、错义突变,以及mRNA表达z-Scores(RNA Seq V2 RSEM)上调或下调2.0以上]分组,分别对508例PTC患者绘制K-M曲线(图4)。经Log-rank检验发现,存在上述Notch遗传学异常的患者,其无病生存期显著短于未携带上述异常的患者(P=0.030)。

图4PTC患者无病生存期K-M曲线
Fig.4 K-M curve of disease-free survival between groups with and without Notch alterations. Red line represents cases with and blue line represents cases without alterations
红色:携带Notch成员遗传学变异(包括基因扩增、删失、错义突变,以及mRNA表达z-Scores改变± 2.0以上)的患者;蓝色:未携带上述异常的患者。
2.4Notch异常参与PTC进展的可能机制根据是否存在Notch家族成员遗传学异常(包括基因扩增、删失、错义突变,以及mRNA表达z-Scores改变±2.0以上)将PTC分组,对差异表达基因并行功能及信号通路聚类分析(表2),结果显示Notch成员异常与细胞代谢关系最为密切,而与包括PI3K/Akt及MAPK信号通路在内的多条肿瘤信号通路均存在交互作用(表中所示为列于前40位的功能或信号通路,其中部分因与肿瘤无关被删除)。其中Notch成员异常情况下,PI3K/Akt及MAPK信号通路发生表达改变的分子如图5、图6所示(红色标注部分)。
3 讨 论
近年来,甲状腺癌发病率逐年增高,加重医疗负担,损害人类健康,针对高复发风险患者施治是医疗资源合理配置的关键。
本研究通过分析TCGA数据库中PTC数据,发现Notch家族成员NOTCH1、NOTCH3、NOTCH4 mRNA在PTC中表达上调,与GEERS等[16]结论一致。而上述分子表达随肿瘤TNM分期进展先升后降,可能与肿瘤微环境、Notch配体浓度等有关。先前NOTCH1被报道作为抑癌因子在未分化甲状腺癌(anaplastic thyroid carcinoma, ATC)中表达受抑[17],而白芦藜醇、橙皮素等通过恢复NOTCH1活性在ATC中发挥抑癌作用[18-19],提示在PTC经由低分化甲状腺癌(poorly differentiated thyroid carcinoma, PDTC)向ATC发展的进程中,NOTCH1可能发生促癌到抑癌的功能转换。NOTCH2在PTC中表达趋势与其他Notch成员相反,与CHU等[20]在结肠癌中的观察结果一致,其原因还有待探索。
表2携带Notch成员遗传变异的PTC差异表达基因信号通路富集分析
Tab.2 Signaling pathway enrichment analysis of differentially expressed genes in PTC in Notch members with genetic alterations

TermCountPMetabolic pathways1634.18E-13PI3K-Akt signaling pathway571.99E-08Ribosome566.63E-22Focal adhesion514.60E-13Regulation ofactin cytoskeleton487.56E-11Endocytosis481.66E-08Spliceosome421.23E-13MAPK signaling pathway413.99E-06Phagosome392.36E-10MicroRNAs in cancer370.001233Protein processing in endoplasmic reticulum358.89E-08RNA transport351.87E-07Rap1 signaling pathway351.09E-05Ras signaling pathway349.59E-05Ubiquitin mediated proteolysis311.24E-07Insulin signaling pathway311.63E-07Cell adhesion molecules (CAMs)314.14E-07Antigen processing and presentation306.02E-12mTOR signaling pathway302.94E-06Axon guidance302.86E-05TermCountPProteoglycans in cancer280.00127Cell cycle271.48E-06Purine metabolism270.000321Chemokine signaling pathway270.000738Proteasome267.95E-14Sphingolipid signaling pathway262.84E-06Phospholipase D signaling pathway264.08E-05Thyroid hormone signaling pathway255.41E-06FoxO signaling pathway253.55E-05cGMP-PKG signaling pathway250.000718cAMP signaling pathway250.005895Lysosome242.69E-05Wnt signaling pathway240.000211Choline metabolism in cancer234.56E-06Natural killer cell mediatedcytotoxicity230.000234Transcriptionalmisregulation in cancer230.006717Fc gamma R-mediated phagocytosis224.32E-06Tight junction220.000762Hippo signaling pathway220.00244

图5PTC中Notch成员异常与PI3K/Akt信号通路的交互作用
Fig.5 PI3K/Akt signaling pathway in PTC with Notch alteration altered genes are labeled red
红色为差异表达的因子。

图6PTC中Notch成员异常对MAPK信号通路的交互作用
Fig.6 MAPK signaling pathway in PTC with Notch alteration altered genes are labeled red
红色为差异表达的因子。
而本研究结果显示,存在Notch遗传学异常的PTC患者无病生存期较短,可作为复发预测指标。研究发现,Notch信号通路对肿瘤干细胞、间质细胞及免疫细胞等进行调控[8]。其最终效应不仅取决于肿瘤类型,还受到旁系同源分子、配体、其它信号通路及肿瘤微环境影响[21]。本研究发现,Notch家族成员遗传学异常与细胞代谢密切相关,并与甲状腺癌发生、进展核心信号通路PI3K/Akt及MAPK信号通路异常共存。既往研究提出,Notch信号通路通过PI3K/Akt及MAPK通路促进肿瘤细胞生长[8],也受其反向调控[22]。三者在PTC中的交互作用有望为靶向治疗提供方向。
遗憾的是由于数据有限,本研究未能对PDTC及ATC中Notch家族成员异常进行分析,从而对其在甲状腺癌发生、进展中的角色进行更全面的解读。
综上所述,本研究发现Notch家族成员NOTCH1、NOTCH3、NOTCH4在PTC中表达增高。Notch家族成员遗传学变异可作为PTC患者复发风险预测因子。Notch家族成员遗传学异常与PTC细胞代谢密切相关,并同PI3K/Akt及MAPK等肿瘤相关信号通路交互作用,为靶向药物研发提供方向。
