TGN-020对大鼠脊髓损伤后继发性水肿和 星形胶质细胞增生的影响
2018-09-07郭卫东戴国宇刘吉松范仲凯
李 坚,李 刚,郭卫东,3,戴国宇,刘吉松,徐 雯,范仲凯
(1. 锦州医科大学附属第一医院骨科,辽宁锦州 121001;2. 同济大学附属上海第十 人民医院骨科,上海 200072;3. 空军军医大学附属第二医院骨科,陕西西安 710000)
近年来,脊髓损伤(spinal cord injury, SCI)发病率呈逐年上升趋势[1],如何有效预防及治疗继发性脊髓损伤,越来越成为人们临床和基础研究的焦点。降低脊髓水肿和抑制胶质瘢痕的形成能够促进脊髓损伤后神经功能的恢复,改善患者预后[2-3]。许多研究表明,继发性水肿的程度与水通道蛋白(aquaporins, AQPs)的表达水平相关,水通道蛋白4(aquaporin 4, AQP4)作为AQPs家族的一员,直接参与水肿的形成和消除,脊髓损伤后,星形胶质细胞增生活化,最后参与胶质瘢痕的形成,其中最典型的变化是神经胶质纤维酸性蛋白(glial fibrillary acid protein, GFAP)表达增强[4]。TGN-020作为AQP4特异性的抑制剂,腹腔注射后能够下调AQP4的表达,增加正常小鼠局部脑血流量[5]、减轻小鼠缺血后及METH诱导的脑组织水肿和血脑屏障(BBB)损害[6-7],缩小缺血中心损伤大小。既往研究显示,褪黑素、姜黄素、没食子酸酯(ECCG)等降低大鼠脊髓损伤后AQP4表达的同时伴随GFAP表达下降,最终减轻继发性水肿及抑制星形胶质细胞的增生。为此,我们推测,大鼠脊髓损伤后水肿与星形胶质细胞增生之间可能存在某种关联,但是具体存在何种联系至今尚不明确。因此,本实验首次采用AQP4特异性抑制剂TGN-020作用于大鼠脊髓损伤,通过检测TGN-020对大鼠脊髓损伤后水肿和星形胶质细胞增生相关蛋白表达的影响,为进一步探讨大鼠SCI后继发性水肿与星形胶质细胞增生之间的关系提供理论依据。
1 材料与方法
1.1实验动物成年雌性SD大鼠72只,清洁级,2月龄,体质量180~220 g,锦州医科大学SPF实验动物中心提供,动物许可证号:SCXK(辽)2008-000。
1.2主要试剂和仪器主要试剂:TGN-020(SML0136,Sigma-Aldrich),使用二甲基亚砜(DMSO)溶解并使其终浓度为0.05 mol/L。兔多克隆抗体GFAP(ab7260)、小鼠单克隆抗体增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)(ab29,Abcam);小鼠单克隆抗体β-actin(sc-47778,Santa Cruz Biotechnology);兔多克隆抗体AQP4(SAB5200112,Sigma-Aldrich);山羊抗兔HRP二抗(7074P2)、山羊抗小鼠HRP(7074P6,Cell Signaling Technology);荧光二抗兔(A-11034),荧光二抗鼠(A-11005,Thermofisher Scientific);50 mL/L山羊血清工作液(ZLI-9022,北京中杉金桥生物技术有限公司);RIPA裂解液,BCA蛋白浓度测定试剂盒,Western blot制胶试剂盒均购自碧云天;增强型ECL化学发光检测试剂盒(WBKLS0L00,Millipore)。
仪器:动脉夹(河南振华教学仪器厂ZH-DMJ-2型),电泳仪、全自动酶标仪、凝胶成像仪(Bio-Rad),721分光光度计(上海精密科学仪器有限公司),Dounce匀浆器(Wheaten),高速冷冻离心机(Eppendof),冰冻切片机和荧光显微镜DMI4000B(Leica公司),-80 ℃超低温冰箱(Thermo公司)。
1.3方法
1.3.1实验分组和给药 72只SD大鼠随机分为假手术组(Sham组)、单纯脊髓损伤组(SCI组)、TGN-020干预组(TGN-020组),每组24只,每组再随机均分为3个亚组。术后TGN-020组使用无菌洁净的1 mL注射器抽取5 mg/kg TGN-020腹腔注射,Sham组和SCI组注射等体积的DMSO。术后3 d,3个亚组分别采用干湿重法检测各组含水量变化,采用蛋白印记、免疫荧光技术分别检测AQP4、GFAP、PCNA蛋白表达。
1.3.2脊髓损伤模型的建立 SD大鼠术前禁食、禁水4~6 h,100 mL/L水合氯醛(300 mg/kg)腹腔注射麻醉,待呼吸自然通畅,取俯卧位四肢外展将大鼠固定于手术台,术区常规备皮,750 mL/L乙醇常规消毒,以T10棘突为中心,纵行切口约2.5 cm逐层切开皮肤、皮下组织及筋膜,分离椎旁肌肉并暴露棘突与椎板,使用咬除剪缓慢小心咬除T10及上下椎板,暴露T9~L1脊髓和硬脊膜区域2 cm×2 cm,采用改良后无菌中号动脉夹挤压脊髓,时间约1 min,Sham组大鼠仅剥离相应椎板,暴露T9~L1脊髓,并不损伤硬脊膜以及脊髓,随后切口依次进行缝合。术后皮下注射青霉素连续使用3 d,人工协助大鼠排尿,每天早晚各1次,持续3 d,直至大鼠排尿反射恢复。所有动物饲养温度为(24±2)℃,湿度40%~50%,12 h/12 h光暗照明,食物、水分提供充足。实验动物大鼠的模型操作和术后护理遵循中国实验动物保护和伦理委员会的规定。
1.3.3脊髓组织含水量的检测 术后3 d,从3组中各随机选择1个亚组(n=8),100 mL/L水合氯醛腹腔注射麻醉处死,于原手术切口逐层暴露脊髓,切取损伤中心上下各0.5 cm的损伤组织,立即放置灵敏度极高分析天平(METFLERAE 26)上称重(湿重),随后放入80 ℃的烤温箱中烘干,48 h后进行称重(干重)至恒重,连续称重三次取平均值(三次称量值波动<0.02 mg),按埃利奥特(Ellicot)公式计算组织含水量:含水量=(湿重-干重)/湿重×100%[8]。
1.3.4Western blot检测AQP4、GFAP、PCNA蛋白的表达 术后3 d,从3组中各随机选择1个亚组(n=8),100 mL/L水合氯醛麻醉,于原手术切口冰上快速取下损伤点上下0.5 cm长度脊髓,0.9% NaCl注射液冲洗干净,放入洁净EP管,加入适量RIPA裂解液后剪碎、静置,经过超声粉碎、4 ℃高速离心后抽取上清,按BCA蛋白浓度测定试剂盒说明书的步骤测定各样品的蛋白浓度,每组蛋白上样量为30 μg,室温下SDS-PAGE凝胶电泳,并将胶上的蛋白转至PVDF膜上,50 g/L脱脂奶粉常规封闭2 h,洗膜后加相应蛋白的一抗于4 ℃冰箱中孵育过夜,次日洗膜后,与相应的二抗于室温孵育2 h,随后ECL显色仪获取照片。用Image J 2x软件求出各蛋白与β-actin灰度值,并求出比值反映各组蛋白的相对表达水平。
1.3.5免疫荧光检测AQP4、GFAP、PCNA蛋白的表达 术后3 d,从3组中各随机选择1个亚组(n=8),100 mL/L水合氯醛麻醉,打开胸腔,暴露心脏,将灌流针经过心尖插入升主动脉,右心耳剪一小口,先用冰冷0.9%生理盐水灌注200 mL左右冲洗血管,后采用预冷的40 mL/L多聚甲醛灌注固定组织,待大鼠颈项强直,肝脏变白,四肢及尾巴僵硬时灌流结束,约30 min后取出距损伤中心上下各0.5 cm、长约1 cm的脊髓组织并将其依次置于40 mL/L多聚甲醛中固定24 h,300 mL/L蔗糖溶液浸泡脱水48 h(中途更换蔗糖溶液1次),常规OCT包埋,使用-20 ℃冰冻切片机在距离损伤中心点头侧和尾侧各2 mm处连续横断面切片,厚度10 μm。将切片经过PBS清洗、血清封闭后加入适量比例稀释的一抗4 ℃过夜孵育,次日再次清洗后加上合适浓度的荧光二抗于室温避光条件下孵育1 h后,最后加DAPI封片,于荧光显微镜下观察。每个组织切片均随机读取8个不重叠的高倍(×400)视野。用Image-Pro Plus 6.0软件分析计算免疫荧光图片中目的蛋白荧光强度与总荧光强度的比值,或者目的蛋白的阳性细胞个数与总细胞个数比值[3]。
1.4统计学分析采用SPSS 17.0软件进行统计学分析,符合正态分布的计量资料以均数±标准差表示,多组间样本均数的比较采用单因素方差分析,组间多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结 果
2.1大鼠术后3d脊髓组织含水量的变化与Sham组相比,SCI组和TGN-020组脊髓损伤区含水量明显升高(P<0.001,P=0.001);与SCI组相比,TGN-020组脊髓损伤区含水量减少(P=0.043,图1)。
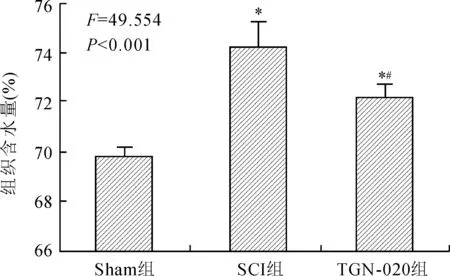
图1干湿重法检测各组脊髓组织的含水量变化
Fig.1 Determination of water content in different groups by wet-dry weighing method (n=8)
与Sham组比较,*P<0.01;与SCI组比较,#P<0.05。
2.2Westernblot检测大鼠术后3d的脊髓组织的AQP4、GFAP、PCNA蛋白表达与Sham组相比,SCI组和TGN-020组AQP4、GFAP的表达明显升高(P<0.001,P=0.003;P=0.007,P=0.005);与SCI组相比,TGN-020组AQP4、GFAP的表达降低(P=0.019;P=0.023)。Sham组PCNA低表达,低于SCI组和TGN-020组(P<0.001;P=0.005),TGN-020组PCNA的表达低于SCI组(P=0.031),差异均有统计学意义(图2、图3)。
2.3免疫荧光染色检测大鼠术后3d脊髓组织的AQP4、GFAP、PCNA蛋白表达大鼠术后3 d免疫荧光染色结果显示如下:图4A红色视野提示AQP4蛋白表达;图5A蓝色颗粒代表DAPI染的细胞核,绿色颗粒代表GFAP标志的星形胶质细胞,红色颗粒提示增殖细胞核抗原PCNA蛋白,GFAP/PCNA/DAPI共定位表示阳性增生的星形胶质细胞。蛋白表达定量分析:SCI组AQP4、GFAP、PCNA蛋白表达明显高于Sham组(P=0.002,P=0.004,P<0.001);TGN-020组AQP4、GFAP、PCNA的表达低于SCI组(P=0.049,P=0.021,P=0.028),差异均有统计学意义(图4B、图5B、C)。

图2Westernblot检测各组大鼠脊髓组织AQP4的表达
Fig.2 Expression of AQP4 in different groups by Western blot analysis (n=8)
与Sham组比较,*P<0.01;与SCI组比较,#P<0.05。
3 讨 论
目前,SCI仍然是一种常见的临床疾病,多数由创伤引起[9]。据报道,全世界每100万人中几乎就有10.4~83人患有此病[10]。SCI后严重影响患者的自主神经功能、运动功能、感觉功能,伴有高致残率,需要长期的治疗,给社会和家庭带来了沉重的负担[11]。SCI主要由原发性损伤和继发性损伤两方面组成[12],继发性脊髓损伤为一系列损伤激活的自身破坏和阻碍自我修复的过程,在伤后几小时至几天发生,包括水肿、炎症反应、缺氧缺血、生长因子和细胞因子诱导星形胶质细胞增生活化、脂质过氧化异常变化等[13]。其中水肿所导致的危害极大,可迅速引起受损局部组织缺血坏死,诱导加重神经元的死亡,降低水肿程度可以促进SCI后运动、感觉功能的康复[14]。
AQP4广泛分布于脑脊髓神经细胞中,主要表达于大脑和脊髓星形胶质细胞的足突,还有室管膜细胞膜和胶质界膜上。已经证明,AQP4的变化与血脊髓屏障和脊髓水肿的渗透性密切相关。根据水肿类型的不同,AQP4发挥着不同作用[15]。在细胞毒性水肿及一些以细胞毒性水肿为主的小鼠脑损伤模型中,如脑缺血再灌注、细菌性脑膜炎,AQP4基因敲除能够明显减轻水肿、促进功能恢复[16-17],相反,基因改良后AQP4过表达能够明显增加水肿[18]。然而,在血管源性脑水肿及一些以血管性脑水肿为主的动物损伤模型中,如脑肿瘤、脑脓肿、皮质冷冻损伤、梗阻性脑积水等,AQP4基因敲除能够增加水含量,加重脑组织的肿胀,阻碍损伤后神经功能恢复[19-20]。既往研究显示,大鼠脊髓损伤后,水肿由损伤中心部位开始向外周蔓延,术后3 d脊髓损伤区域含水量达到高峰,水肿最明显[21]。ECCG能够通过下调AQP4蛋白的表达,缓解损伤组织的肿胀,减轻水肿[22]。本研究得出相同结果,大鼠脊髓损伤术后3 d,AQP4表达显著上升,水肿明显,腹腔注射TGN-020后AQP4表达降低,损伤区域含水量明显减少。可见TGN-020可以有效抑制AQP4的表达减轻水肿,同时本研究表明,大鼠损伤后3 d,水肿类型主要是细胞毒性水肿为主,这可能与脊髓损伤后早期组织缺血缺氧导致细胞坏死,而血脊髓屏障未受到破坏有关。

图3Westernblot检测各组大鼠脊髓组织GFAP和PCNA蛋白的表达
Fig.3 Expressions of GFAP and PCNA in different groups by Western blot analysis (n=8)
与Sham组比较,*P<0.01;与SCI组比较,#P<0.05。
SCI术后3 d,星形胶质细胞迅速被激活,在形态和功能上发生一系列变化,最终形成反应性星形胶质细胞[23]。活化型的星形胶质细胞增生、肥大朝着SCI中心处迁移,同时星形胶质细胞释放许多相关的细胞内外纤维蛋白和蛋白多糖,共同参与胶质瘢痕的形成,密封伤口[24]。而胶质瘢痕形成一直被认为是SCI修复过程当中的不利因素,形成的胶质瘢痕可引起神经元退行性疾病和癫痫反复发作[25],抑制轴突的生长和髓鞘的形成[26],进一步影响SCI后神经元的再生,从而导致SCI修复受阻。因此,抑制胶质瘢痕组织的形成对SCI的恢复具有重要意义[27]。本研究显示,大鼠脊髓损伤后3 d GFAP和PCNA表达上调,抑制星形胶质细胞增生,可以有效阻碍胶质瘢痕的形成[3]。大鼠脊髓挤压术后3 d检测GFAP和PCNA蛋白表达明显升高,而腹腔注射TGN-020后二者表达显著减少,可见TGN-020可以抑制星形胶质细胞的增生活化。


图4 免疫荧光单标染色检测各组大鼠脊髓组织AQP4蛋白的表达Fig.4 Expression of AQP4 in different groups by im-munofluoresent single-labeling assay (n=8)A:各组AQP4蛋白表达荧光图(荧光显微镜,×400;比例尺:100μm);B:AQP4蛋白表达定量分析。与Sham组比较,*P<0.01;与SCI组比较,#P<0.05。

图5免疫荧光双标染色检测各组大鼠脊髓组织GFAP和PCNA蛋白表达
Fig.5 Expressions of GFAP and PCNA in different groups by immunofluoresent double-labeling assay (n=8)
A:各组GFAP和PCNA蛋白表达荧光图(荧光显微镜,×400;比例尺:100 μm;箭头指示GFAP/PCNA/DAPI阳性增生星形胶质细胞);B、C:GFAP和PCNA蛋白表达定量分析。与Sham组比较,*P<0.01;与SCI组比较,#P<0.05。
先前许多研究报道大鼠SCI后,AQP4与星形胶质细胞的迁移有关,AQP4可以促进反应性星形胶质细胞朝着损伤处迁移,抑制AQP4蛋白表达可以导致星形胶质细胞的迁移明显减弱,从而导致胶质瘢痕的形成受阻[28],但是,目前关于 AQP4与星形胶质细胞增生相关的研究很少。尽管有许多体外实验已经证明,AQP4基因敲除可以抑制小鼠神经干细胞的增生[29],抑制AQP4的表达可以抑制乳腺癌细胞的增殖[30]。但是目前为止,在动物脊髓损伤模型中还没有相关报道,本研究首次证明大鼠脊髓损伤后TGN-020能够下调AQP4的表达,同时伴随星形胶质细胞增生相关蛋白GFAP、PCNA表达减少,可见TGN-020可以通过下调AQP4的表达来抑制星形胶质细胞的增生,这也再次验证了我们起初的猜测,但是大鼠脊髓损伤后水肿与星形胶质细胞增生之间是通过什么机制来影响还有待进一步研究。这对于进一步探讨脊髓继发性损伤机制有着重要意义,同时也为临床治疗脊髓损伤提供了一个新的方向。
