β2肾上腺素受体通过HIF-1α调控NNK诱导的 胰腺癌细胞进展
2018-09-07沙焕臣雷建军段万星徐勤鸿马清涌
沙焕臣,雷建军,王 铮,段万星,徐勤鸿,黎 韡,韩 亮,马清涌,张 东
(西安交通大学第一附属医院肝胆外科,陕西西安 710061)
4-甲基亚硝氨基-3-吡啶-1-丁酮(NNK)是一种较强的致癌物质,能够诱导K-Ras突变及P53的失活,而这两种基因的突变在肺癌及胰腺癌中非常普遍[1-2]。有研究显示,NNK调控肿瘤微环境中的多种过程,与β肾上腺素受体相关[3-5],NNK可高效并特异地结合β2肾上腺素能受体(β2受体),并激活其下游信号通路,促进胰腺癌的进展;其下游通路可能通过缺氧诱导因子1α(HIF-1α)来诱导胰腺癌细胞的增殖及侵袭。在本研究中,我们以胰腺癌细胞株MIA PaCa-2和BxPC-3作为受试细胞,研究NNK诱导胰腺癌细胞的具体机制,并揭示β2肾上腺素受体可能通过HIF-1α来介导NNK诱导的胰腺癌细胞增殖及侵袭。
1 材料与方法
1.1材料MIA PaCa-2和BxPC-3人胰腺癌细胞株购自中国科学院上海生命研究所。DMEM细胞培养基、胰蛋白酶购自Hyclone公司,胎牛血清购自杭州四季青公司。HIF-1α、VEGF和Cyclin D1抗体均购自Bioworld公司。β-actin抗体、HRP标记山羊抗鼠IgG、山羊抗兔IgG二抗均购自北京中杉金桥公司。聚偏二氟乙烯膜(PVDF膜)、Transwell小室均购自Milliproe公司。HIF-1α shRNA和对照shRNA Control质粒购自上海吉玛公司,HIF-1α shRNA的有效序列是5′-CCACCACUGAUGAAUUAAATT-3′。转染试剂Lipofectamine 2000购自Invitrogen公司。Real-time PCR试剂盒购自大连TaKaRa公司。实验分组:正常对照组(Control),对照shRNA干扰组(sh-control),HIF-1α shRNA干扰组(sh-HIF-1α),NNK干预组(NNK),NNK+对照shRNA干扰组(NNK+sh-control),NNK+HIF-1α shRNA干扰组(NNK+sh-HIF-1α),NNK+ICI 118551干预组(NNK+ICI 118551),CoCl2+NNK+ ICI 118551干预组(CoCl2+NNK+ ICI 118551)。
1.2细胞培养与转染人胰腺癌细胞株MIA PaCa-2和BxPC-3于含100 mL/L胎牛血清的DMEM培养液中,37 ℃ 50 mL/L CO2培养箱中培养。取对数生长期的细胞进行实验。参照Lipofectamine2000转染试剂盒,瞬时转染48 h后消化细胞,按1∶6接种于6孔板后加600 μg/mL G418进行转染筛选,每2~3 d换液1次。14 d后,出现多个G418抗性的克隆,在荧光显微镜下可看到带有绿色荧光蛋白GFP的阳性克隆。显微镜下取带GFP的单个克隆移入24孔培养板,继续G418维持培养,经过4周可以获得稳定转染的细胞克隆。
1.3Transwell小室侵袭实验将细胞在各组处理条件下培养24 h。取100 μL预冷的DMEM与Matrigel 1∶1稀释胶加到Transwell上层小室中,于37 ℃孵育6 h。收集各分组细胞按5×104/mL的密度100 μL接种于Transwell上层小室。含100 mL/L胎牛血清的DMEM培养基500 μL加入Transwell下层小室,置于37 ℃ 50 mL/L CO2的培养箱中培养24 h。将膜取出固定10 min,1 g/L的结晶紫染色30 min后小心洗去。200倍放大倍数下随机观察并计10个视野内穿过聚碳酸酯膜的细胞数,照相记录。重复3次。
1.4蛋白印记法(Westernblot)检测蛋白表达选择生长较好的细胞1×107个,经蛋白裂解液裂解细胞,提取总蛋白。BCA法测定蛋白浓度。SDS-PAGE凝胶电泳,半干转膜法转至PVDF膜。50 g/L脱脂牛奶室温封闭1 h。加一抗稀释液4 ℃孵育过夜。TBST缓冲液洗膜后加入二抗稀释液室温孵育1 h。ECL化学发光,暗室显影。
1.5PCR检测mRNA转录提取各分组细胞总RNA。取5μg按反转录试剂盒说明反转录为cDNA。以cDNA为模板PCR扩增HIF-1α。各基因引物序列:HIF-1α,上游5′-AAGTCTAGGGATGCAGCA-3′,下游5′-CAAGATCACCAGCATCATG-3′; GAPDH,上游5′-GTAAAGACCTCTATGCCATCA-3′,下游5′-GGACTCATCGTACTCCTGCT3-3′。PCR反应条件:预变性94 ℃ 5 s;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s共40个循环;溶解曲线条件:95 ℃15 s,60 ℃ 30 s,95 ℃ 15 s。基因相对表达水平通过ΔΔCt法计算。
1.6流式细胞仪检测细胞周期选择生长良好的细胞1×106个,PBS清洗两遍,4 ℃条件下运用700 mL/L的乙醇固定24 h。在37 ℃条件下运用碘化丙啶孵育30 min。上机进行流式细胞检测,分析细胞周期。
2 结 果
2.1β2肾上腺素受体调控NNK诱导的HIF-1α表达运用sh-RNA干扰HIF-1α,Real-time PCR及Western blot检测HIF-1α的mRNA及蛋白表达量,发现sh-HIF-1α No.2干扰效率更高(图1A、B),随后运用sh-HIF-1α No.2用于下一步实验。
NNK干预能够显著促进MIA PaCa-2和BxPC-3胰腺癌细胞HIF-1α的表达(P<0.05),同时运用sh-HIF-1α No.2和β2肾上腺素受体抑制剂ICI 118551均能够显著降低NNK所诱导的HIF-1α表达(P<0.05,图1C、D)。说明β2肾上腺素受体可调控NNK诱导的HIF-1α表达。

图1HIF-1α干扰RNA以及ICI118551处理后对胰腺癌细胞株HIF-1α的影响
Fig.1 The effect of HIF-1α interference and ICI 118551 on the expression of HIF-1α in pancreatic cancer cells
A、B:检测HIF-1α干扰效率;C、D:检测NNK及sh-HIF-1α、ICI 118551对胰腺癌细胞株HIF-1α的影响。与对照组比较,*P<0.05;与NNK组比较,#P<0.05。
2.2β2肾上腺素受体通过HIF-1α调控NNK诱导的胰腺癌侵袭及增殖为明确β2肾上腺素受体是否能够调控NNK所诱导的胰腺癌侵袭及增殖,我们运用NNK干预促进MIA PaCa-2和BxPC-3胰腺癌细胞。观察到NNK能够显著增加MIA PaCa-2和BxPC-3两株胰腺癌细胞的侵袭及增殖(P<0.05,表1、图2)。
运用sh-HIF-1α No.2干扰HIF-1α后,NNK所诱导的胰腺癌侵袭及增殖显著被抑制(P<0.05)。说明HIF-1α介导NNK所诱导的胰腺癌侵袭及增殖(图2)。运用β2肾上腺素受体抑制剂ICI 118551也能够显著抑制NNK诱导的胰腺癌侵袭及增殖(P<0.05,表1,图2)。结合ICI 118551能够显著抑制HIF-1α的表达,我们推测β2肾上腺素受体能够通过HIF-1α调控NNK诱导的胰腺癌侵袭及增殖。
表1HIF-1α干扰RNA以及ICI118551处理后对胰腺癌细胞株侵袭及增殖的影响
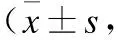

与对照组比较,*P<0.05;与NNK组比较,#P<0.05。

图2HIF-1α干扰RNA以及ICI118551处理后对胰腺癌细胞株侵袭及增殖的影响
Fig.2 The effect of HIF-1α interference and ICI 118551 on the invasion and proliferation of pancreatic cancer cells
A:Transwell检测胰腺癌细胞的侵袭能力;B:流式细胞仪检测细胞增殖。与对照组比较,*P<0.05;与NNK组比较,#P<0.05。
2.3β2肾上腺素受体通过HIF-1α调控NNK诱导的CyclinD1及VEGF的表达NNK能够促进细胞周期蛋白(Cyclin D1)及血管生成因子(VEGF)的表达(P<0.05),同时运用sh-HIF-1α No.2干扰HIF-1α后,NNK所诱导的Cyclin D1及VEGF显著被抑制,揭示了HIF-1α介导NNK所诱导的胰腺癌Cyclin D1及VEGF表达(P<0.05,图3)。运用β2肾上腺素受体抑制剂ICI 118551也能够显著抑制NNK诱导的胰腺癌Cyclin D1及VEGF表达(P<0.05,图3)。结合ICI 118551能够显著抑制HIF-1α的表达,我们推测β2肾上腺素受体能够通过HIF-1α调控NNK诱导的Cyclin D1及VEGF的表达。
为进一步验证结论,运用CoCl2提升MIA PaCa-2和BxPC-3的HIF-1α水平。结果发现,CoCl2+NNK+ICI 118551组的侵袭能力显著高于NNK+ICI 118551组(P<0.05),说明HIF-1α水平的升高能够逆转ICI 118551对NNK的抑制作用(图4A)。同样,CoCl2+NNK+ICI 118551组的Cyclin D1及VEGF表达量显著高于NNK+ICI 118551组(P<0.05,图4B、C)。更进一步验证β2肾上腺素受体能够通过HIF-1α调控NNK诱导的胰腺癌侵袭、增殖,以及Cyclin D1、VEGF的表达。

图3HIF-1α干扰RNA以及ICI118551处理后对胰腺癌细胞株CyclinD1及VEGF的影响
Fig.3 The effect of HIF-1α interference and ICI 118551 on the expressions of Cyclin D1 and VEGF in pancreatic cancer cells
与对照组比较,*P<0.05;与NNK组比较,#P<0.05。

图4CoCl2处理对胰腺癌细胞株侵袭能力及CyclinD1、VEGF表达的影响
Fig.4 The effect of CoCl2on the invasion and expressions of Cyclin D1 and VEGF in pancreatic cancer cells
A:Transwell检测胰腺癌细胞的侵袭能力;B:Western blot检测HIF-1α、Cyclin D1及VEGF的表达;C:统计分析HIF-1α、Cyclin D1及VEGF的表达。*P<0.05。
3 讨 论
NNK是一种烟草当中特异的亚硝胺,具有较高的致癌特性。但NNK在胰腺癌发生发展中的作用报道较少。本研究中,我们发现β2肾上腺素受体抑制剂能够抑制NNK所诱导的胰腺癌细胞的增殖与侵袭。NNK能够增加MIA PaCa-2和BxPC-3胰腺癌细胞内的HIF-1α水平。既往的体外研究显示,NNK能够作为β2肾上腺素受体激动剂促进胰腺癌的进展[6-7]。本研究显示,β2肾上腺素受体能够通过上调HIF-1α调控NNK诱导的胰腺癌细胞的侵袭及增殖,这揭示了β2肾上腺素受体调控NNK的一条新机制,这与既往HIF-1α能够促进胰腺癌、卵巢癌及胃癌的侵袭转移结论相一致[4-5,8]。同理,NNK所诱导的HIF-1α水平的增加可能能够解释吸烟促进相关肿瘤进展的机制。
以上这些发现均表明β2肾上腺素受体在吸烟相关的胰腺癌进展机制中扮演重要角色。本研究结论显示,β2肾上腺素受体在促进胰腺癌细胞侵袭、增殖的过程中伴随着HIF-1α水平的上调。我们近期研究显示,HIF-1α依赖的β2肾上腺素受体信号通路介导慢性应激诱导的胰腺癌细胞增殖[9]。这些发现可能能够解释抗氧化物所存在的一些抗肿瘤作用,因为众多文献报道一些促癌信号均为HIF-1α的下游基因[10]。值得注意的是,运用β2肾上腺素受体抑制剂能够下调NNK诱导的HIF-1α的表达,同时抑制细胞的增殖和侵袭。而上调HIF-1α表达能够逆转β2肾上腺素受体抑制剂在胰腺癌中的作用。我们的研究提示,β2肾上腺素受体通过HIF-1α来介导NNK诱导的胰腺癌细胞的增殖及侵袭。
β肾上腺素受体信号通路的激活与肺癌、结直肠癌及胰腺癌细胞增殖及侵袭相关。到目前为止,至少有3篇文献报道提示运用β肾上腺素受体信号通路抑制剂能够降低癌症的发生[11-14]。在这些研究中显示,运用心血管相关药物β肾上腺素受体抑制剂,而不是利尿剂或钙离子拮抗剂,能够减少癌症的发生。β肾上腺素受体高表达与胰腺癌低分化及高TNM分期相关,更加能够确定β肾上腺素受体信号通路在胰腺癌中的重要作用。这些研究结果与我们的实验结果一起揭示了吸烟相关胰腺癌发展的新机制,并为胰腺癌的预防及治疗提供了新的靶点。
