糖基化卵白蛋白肽的制备工艺优化及特性与结构分析
2018-09-06刘丽莉李玉杨陈柳梁严予代晓凝孟园园陈珂
刘丽莉,李玉,杨陈柳,梁严予,代晓凝,孟园园,陈珂
(河南科技大学 食品与生物工程学院,河南 洛阳,471023)
卵白蛋白(ovalbumin,OVA)是蛋清蛋白的主要蛋白组分,其含量占蛋清蛋白总量的54%,是一种优质蛋白质[1]。OVA的分子质量为44.5 kDa,是典型的含磷球形的糖蛋白,其等电点为4.5,由385个氨基酸组成[2]。每1个OVA分子含有1个二硫键和4个巯基,是蛋清蛋白中唯一1个含有游离巯基的蛋白质[3]。
蛋清粉具有便于运输、易于贮藏等优点,然而却因其腥味重、黏度大、溶解性差等缺点严重限制了其在食品加工中的应用。因此,采用适当的方法对蛋清粉进行改性是亟待解决的问题。目前,国内外学者采用各种方法对OVA进行改性以期改善其功能性质[5-8]。目前,对于OVA的改性只研究了单一方法对其性质的影响,而采用协同改性的方法对OVA进行改性却未见报道。
酶法改性条件温和,一般不会造成营养成分的损失,糖基化反应可以提高产品风味及功能性质[9-10]。因此本文采用协同改性——酶法和糖基化相结合的方法对OVA进行改性,对OVA酶解物进行糖基化反应,优化糖基化反应的工艺条件,并对协同改性前后产物的功能和结构性质进行研究,旨在为加工改性OVA在食品产业中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜鸡蛋购买于河南省洛阳市大商新玛特超市。
葡聚糖T6 (5400-6600),上海蓝季科技发展有限公司;甲醛,洛阳昊华化学试剂有限公司;邻苯二甲醛,甘肃双赢化工有限公司;硼砂、十二烷基磺酸钠,天津市德恩化学试剂有限公司;β-巯基乙醇,上海伟进生物科技有限公司;溴酚蓝,天津市光复精细化工研究所;木瓜蛋白酶(酶活1 000 U/g),如吉生物科技有限公司;中性蛋白酶(酶活50 U/mg),风味蛋白酶(酶活20 000 U/g),上海蓝季生物有限公司;溴化钾(光谱纯),郑州市米莱化工产品有限公司;其余试剂为分析纯。
1.2 仪器与设备
DYCZ-24DN垂直电泳槽、DYY-6C型稳压稳流型电泳仪,上海博通化学科技有限公司;Alpha凝胶成像系统,美国Protein Simple公司;高速冷冻离心机,美国Finnigan公司;真空冷冻干燥机,美国惠普公司;傅里叶变换红外光谱仪,德国Bruck VERTEX70;日本电子扫描电镜IT100,上海百贺仪器科技有限公司。
1.3 方法
1.3.1 OVA肽及其糖基化产物制备
参照课题组以前的方法[11]制备OVA肽并作适当修改,称取一定量OVA溶解于蒸馏水中,配制6%的蛋白溶液,采用m(木瓜蛋白酶)∶m(中性蛋白酶)∶m(风味蛋白酶)=1∶1∶2的复合酶进行酶解,其酶解条件为加酶量7 500 U/g,pH 7.2,酶解温度57.5 ℃,时间7.2 h。酶解结束后灭酶、离心,取上清液冷冻干燥,得到OVA酶解物即OVA肽。
称取一定量的OVA肽,溶于一定量的去离子水中,按一定比例加入葡聚糖T6,充分搅拌溶解。调节溶液pH值,在适当温度下反应一定时间,反应结束后立即置于冰浴冷却至室温。冷冻干燥后得到OVA肽糖基化产物。
1.3.2 接枝度的测定
根据JIANG[12]方法测定糖基化产物接枝度,取200 μL蛋白浓度为4 mg/mL的样品液,加入4 mL OPA试剂,混匀后于35℃水浴锅中反应2 min,然后在340 nm处测吸光值。空白对照为:4 mL OPA试剂和200 μL水。接枝度(DG)按下式计算。

(1)
式中:At为t时刻样品的吸光度;A0为未反应的吸光度。
1.3.3 褐变程度的测定
根据张蓓[13]方法测定褐变程度,取样品液1 mL加入5 mL 0.1% SDS稀释,0.1% SDS作为空白,在420 nm波长处测定其吸光值,即为褐变指数。
1.3.4 OVA肽糖基化反应工艺条件优化
1.3.4.1 单因素试验设计
分别以反应温度(30、40、50、60、70、80 ℃)、pH值(6、7、8、9、10、11)、蛋白与糖的质量比(4∶1、3∶1、2∶1、1∶1、1∶2、1∶3、1∶4)、蛋白质量浓度(2、4、6、8、10、12 g/100 mL)及反应时间(1、2、3、4、5、6 h)为单因素,考察各因素对接枝度及褐变程度的影响。
1.3.4.2 二次正交旋转组合设计
在单因素试验的基础上,以pH值、蛋白质量浓度、OVA肽∶糖(质量比)、反应时间、反应温度5个因素为自变量,以接枝度(Y)为响应值,设计共36个试验点的五元二次正交旋转组合试验,因素水平见表1。
1.3.5 协同改性前后卵白蛋白功能特性的测定
1.3.5.1 乳化性能的测定
参照AGYARE等[15]的方法并作适当修改,将一定量的样品蛋白溶解在pH 7.4 Tris-HCl缓冲液中,制成蛋白浓度为1 mg/ml的溶液。取20 mL蛋白溶液加入5 mL大豆油,10 000 r/min 均质1 min,分别取均质后0、10 min的最底层乳化液100 μL加入到100 mL 0.1%的SDS溶液中,用紫外分光光度计在500 nm波长处测定其吸光值,空白为0.1% SDS溶液。乳化活性指数(EAI)和乳化稳定性(ESI)分别由式(2)、式(3)来计算:
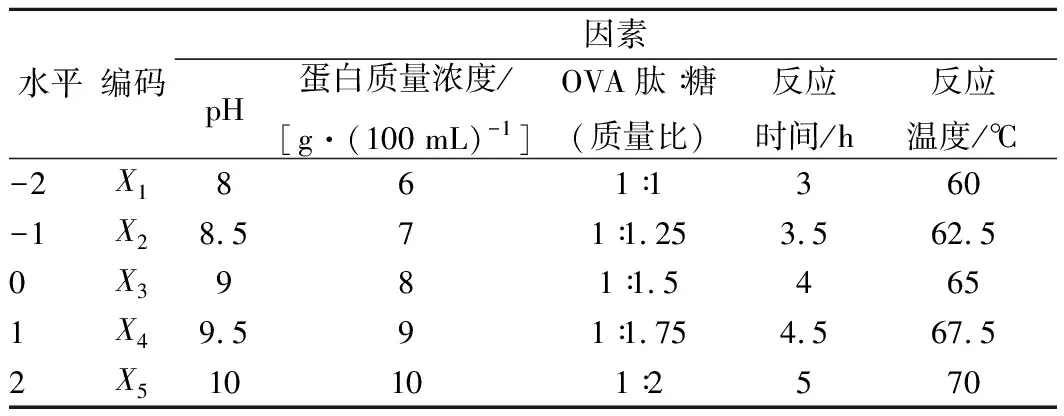
表1 五元二次正交旋转组合设计试验因素与水平Table 1 Factors and levels used in second-ordel rotation combination experimental design
(2)
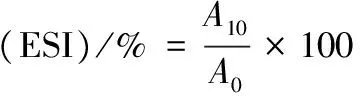
(3)
式中:A0、A10,乳浊液在0、10 min的吸光值;φ,油相体积分数(油的体积/乳浊液的体积);ρ,蛋白质质量浓度,g/mL;F,稀释倍数。
1.3.5.2 起泡性能的测定
参照JING等[16]的方法测定蛋白质的起泡性,将一定量的蛋白溶于pH 7.4 Tris-HCl缓冲液中,配制成蛋白质量浓度为1 mg/mL的溶液,取50 mL蛋白溶液,记录起始高度H0,10 000 r/min均质2 min后记录高度H1,静置10 min后再次记录高度H2。蛋白溶液起泡性(FAI)和泡沫稳定性(FSI)的计算公式如下:
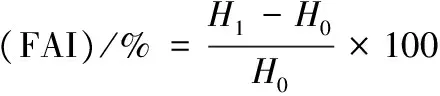
(4)

(5)
1.3.6 协同改性前后卵白蛋白的结构分析
1.3.6.1 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)测定
以分子质量为6.5~200 kDa标准蛋白为对照,采用SDS-PAGE分析OVA、OVA肽、糖基化OVA肽的分子质量变化,其中分离胶10%,浓缩胶5%。
1.3.6.2 傅里叶转换红外(FT-IR)分析
将冷冻干燥后的待测样品与KBr按1∶100的质量比混合,置于玛瑙研钵中研磨至粉末状,将样品置于样品槽中,在压力10~15 MPa下压片,1 min后将样品取出,放入样品室,采用红外光谱仪在400~4 000 cm-1波长区间对样品进行扫描。
1.3.6.3 扫描电镜(SEM)分析
将待测样品用导电胶带固定于样品台上,采用离子溅射仪进行喷金,抽真空1 h左右,在扫描电子显微镜下观察样品的微观结构。
1.4 数据分析
每个试验重复3次,取其平均值。通过Origin Pro 8.5软件对数据进行统计分析,采用DPS V 7.0专业版进行显著性分析,设计专家Design-Expert. 8.0.5程序,作响应曲面图和等高线图。
2 结果与分析
2.1 单因素实验结果
单因素试验结果如图1所示。

a-pH值对接枝度和褐变程度的影响;b-底物配比对接枝度和褐变程度的影响;c-蛋白质量浓度对接枝度和褐变程度的影响;d-反应时间对接枝度和褐变程度的影响;e-反应温度对接枝度和褐变程度的影响图1 单因素试验结果Fig.1 Results of single-factor experiments
接枝度表示糖基化反应进行的程度,褐变程度则表示反应混合物的颜色变化,糖基化反应中希望减少有色物质的生成,同时增加初级阶段和中级阶段产生的功能特性较好的无色物质[17]。由图1可知,随着pH值的增大,接枝度增大;当pH值达到8时,接枝度达到最大,此后随着pH值的增大,接枝度逐渐减小,而褐变程度随着pH值的增大,逐渐增大,故选取最佳pH值为8(图1-a);随着葡聚糖T6添加量的增加,接枝度先升高后下降,当OVA肽与葡聚糖T6的质量比为1∶1时,接枝度最大,且褐变程度较适宜。所以选择底物配比为1∶1(图1-b);随着蛋白质量浓度的升高,接枝度先上升后下降,褐变程度逐渐增大。因此,OVA肽的质量浓度为8 g/100 mL较为适宜(图1-c);随着反应的进行,接枝度逐渐上升,当反应4 h时接枝度达到最大,随后开始下降;褐变程度呈现逐渐上升的趋势,因此,反应时间选择4 h(图1-d);随着糖基化反应温度的上升,接枝度逐渐增加,当温度到达60 ℃时接枝度开始出现下降趋势,褐变程度逐渐增加。所以选取60 ℃为最佳反应温度(图1-e)。
2.2 响应面优化试验结果分析
在单因素试验的基础上,进行五元二次正交旋转组合试验,结果见表2。

表2 五元二次正交旋转组合试验设计方案及结果Table 2 Quadratic orthogonal rotary composite experimental design (in coded level of five variables) and experimental result (n=3)
续表2

试验号X1X2X3X4X5接枝度/% 71-1-11125.7481-1-1-1-123.199-1111-132.5310-111-1133.2311-11-11125.7512-11-1-1-123.1013-1-111127.0414-1-11-1-120.4215-1-1-11-124.2316-1-1-1-1119.6717-2000024.68 182000027.87 190-200021.37 200200027.37 2100-20020.15220020026.81 23000-2026.21 240002030.70 250000-229.08 260000226.50 270000037.10280000036.94290000034.19300000038.14310000032.21320000032.81330000033.81340000038.27350000036.58360000035.40
2.2.1 回归模型方差分析和显著性检验
采用Design-Expert. 8.0.5统计分析软件对试验结果进行多元回归拟合,回归方程的方差分析结果见表3。

表3 试验结果方差分析表Table 3 Analysis of variance of regression model equation
续表3

变异来源平方和自由度均方F值p值显著性X3X58.2118.211.560.230 5不显著X4X53.5213.520.670.426 2不显著X12123.851123.8523.570.000 2极显著X22191.071191.0736.36<0.000 1极显著X32227.451227.4543.28<0.000 1极显著X4264.73164.7312.320.003 2极显著X5280.75180.7515.370.001 4极显著回归1 059.712052.9910.08<0.000 1极显著剩余78.83155.26失拟35.7765.961.250.367 9不显著误差43.0694.78总和1 138.5435
注:p<0.01影响极显著;p<0.05影响显著。
本试验构建的模型在α=0.05显著水平下剔除不显著水平后的回归方程为:
Y=-2 846.281+52.730X2+123.730X3+61.895X4-9.850X1X3-1.134X1X5-7.869X12-2.444X22-42.657X32-5.689X42-0.254X52
2.2.2 构建模型的等高线和响应面分析
各因素交互作用对接枝度的影响如图2所示。

a-pH与OVA肽∶糖(质量比);b-pH与反应温度图2 各因素交互作用对接枝度的影响Fig.2 Response surface and corresponding contour plots showing the effect of interaction of various factors on the grafting degree
由图2-a可知,pH与OVA肽∶糖对接枝度的交互影响呈抛物线形,等高线呈椭球状,说明pH与OVA肽∶糖对接枝度的交互作用对接枝度影响显著。当pH在8.9~9.3,OVA肽∶糖(质量比)为1∶1.45~1∶1.65时,两者的交互作用最明显,此时接枝度达到30%以上。低于此范围时,接枝度随pH与OVA肽∶糖水平的增加而增大;高于此范围时,接枝度随pH与OVA肽∶糖水平的增加而减小。
由图2-b可知,pH与反应温度对接枝度的交互影响呈抛物线形,等高线呈椭球状,说明pH与反应温度对接枝度的交互作用对接枝度影响显著。当pH为8.7~9.5,反应温度为63~67 ℃时,两者的交互作用最明显,此时接枝度达到30%以上。
采用Design-Expert. 8.0.5分析,确定最佳糖基化改性条件为pH 9、蛋白质量浓度8 g/100mL、OVA肽∶糖(质量比)为1∶1.5、反应时间4.5 h、反应温度65 ℃,此时最高接枝度为36.78%,通过验证实验接枝度的平均值为(35.67±0.74)%,与理论预测值误差绝对值为3.02%,表明优化的糖基化条件可信。
2.3 协同改性前后功能特性的变化
由表4可知,OVA肽较OVA乳化活性指数和乳化稳定性分别提高了28.88 m2/g,25.20%。这是因为酶解使得OVA的疏水基团增加,结合油滴的能力增强[18],亲水基团伸展到水相中,提高了OVA的乳化性和乳化稳定性。协同改性后的OVA的乳化活性指数比OVA提高了51.20 m2/g,乳化稳定性提高了38.14%。原因可能是糖基化反应后使蛋白形成多聚物后,产生了许多支链基团,从而使蛋白质的空间位阻增大[19],同时糖基化反应后生成的蛋白聚合物的黏弹性比未处理的OVA高。

表4 协同改性前后OVA的功能性质Table 4 The functional properties of OVA before and after the synergistic modification
注:结果以平均值±标准差表示,同列字母不同表示差异显著(p<0.05)。
OVA肽和协同改性OVA的起泡性和泡沫稳定性较未改性OVA都有明显提高。原因可能是蛋白质的溶解度与起泡性能呈正相关,酶解和协同改性均使OVA的溶解度得到提高,从而使得协同改性后OVA的起泡性提高。同时,OVA肽与葡聚糖进行糖基化反应后,引入了多羟基,使得分子间的作用力增强,蛋白质膜的厚度和硬度增加[20],从而使协同改性OVA的泡沫稳定性增强。
2.4 协同改性前后结构性质的分析
2.4.1 SDS-PAGE分析
OVA、OVA肽及糖基化OVA肽的SDS-PAGE电泳图如图3所示。
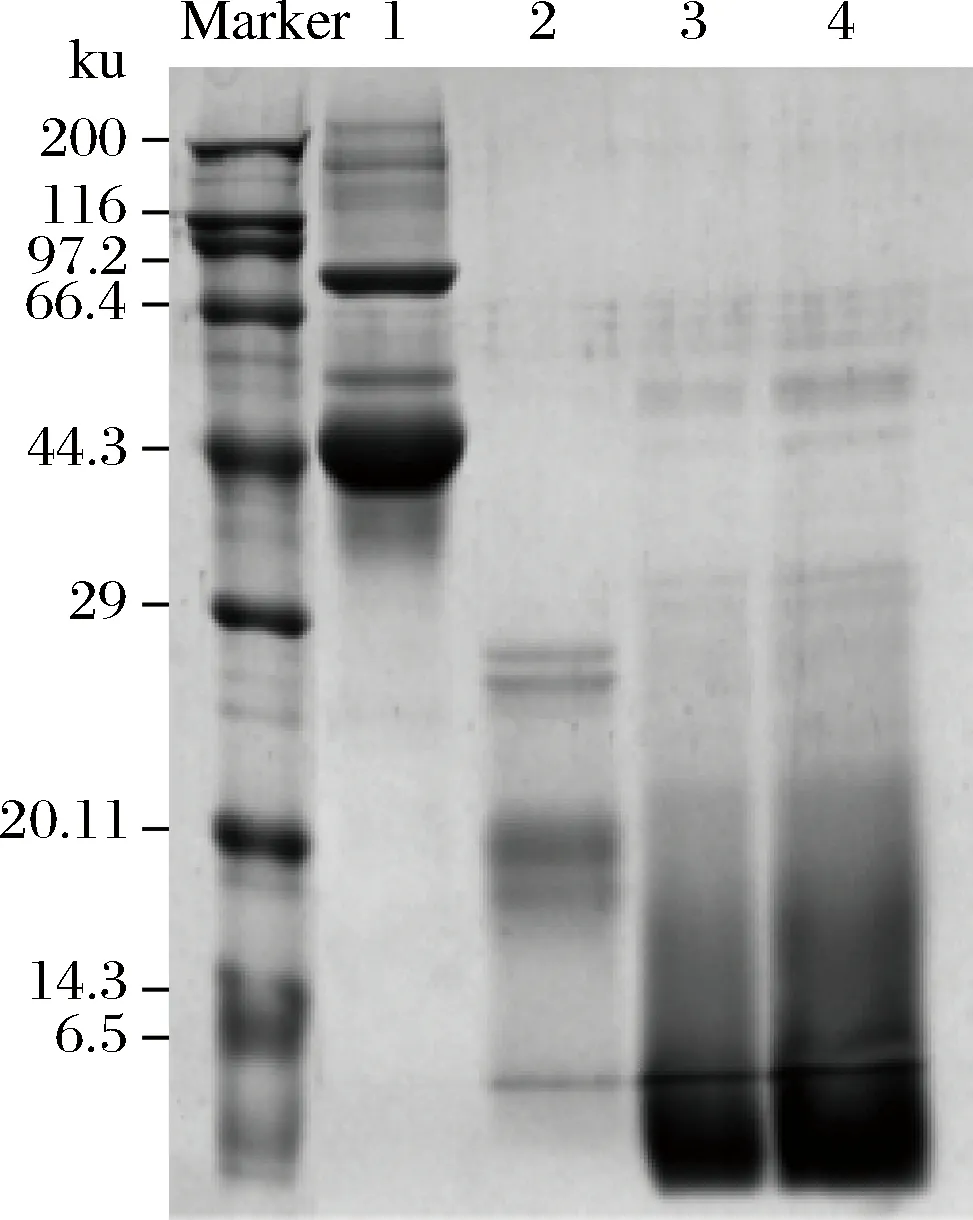
Marker-标准蛋白;1-OVA;2-OVA肽;3、4-糖基化OVA肽平行样图3 改性前后OVA SDS-PAGE电泳图Fig.3 SDS-PAGE of OVA before and after the modification
由图3可知,1号泳道大部分条带出现在45.0 kDa处,即为OVA。在66.4~97.2 kDa处出现了一条蛋白条带,可能是未除去的卵转铁蛋白[21]。2号泳道的电泳条带相对于OVA来说,出现明显下移,且条带分散,说明蛋白分子在酶解作用下被降解为小分子肽,其分子质量分布在14.3~29 kDa。3、4号泳道均为糖基化OVA肽,其条带相对于OVA肽明显上移至45.0~97.2 kDa,这表明葡聚糖连接到OVA肽上使其分子质量增大[22]。
2.4.2 傅里叶红外光谱分析
OVA、OVA肽及糖基化OVA肽的红外光图谱如图4所示。
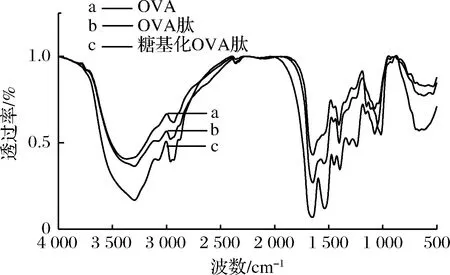
图4 红外光谱图分析Fig.4 Analysis of fourier transform infrared spectrometer

2.4.3 扫描电镜分析

a-OVA;b-OVA肽;c-糖基化OVA肽图5 改性前后OVA的SEM图Fig.5 Scanning electron micrographs of before and after Ovalbumin
分别将OVA、OVA肽及糖基化OVA肽置于扫描电镜下,放大同样倍数,结果如图5所示。由图中可以看出OVA为典型的球蛋白[25],表面光滑,成颗粒状,排列紧密,表面有明显的孔洞和不规则的凹陷。酶解之后,表面不规则的凹陷消失,相对于OVA颗粒变小,分子间的聚集程度加深,成簇状,排列更紧密。经过酶解和糖基化处理后,体系的微观结构发生明显变化,球状完全变成片状结构,排列紧密,表面有不规则的凸起或凹陷,分子间的交联程度较好。这说明酶解和糖基化协同改性使其微观结构发生明显变化。
3 结论
通过响应面法对OVA肽糖基化改性的工艺条件进行优化,确定最佳工艺条件为pH 9、蛋白质量浓度8 g/100mL、OVA肽∶糖(质量比)为1∶1.5、反应时间4.5 h、反应温度65 ℃,在此条件下,糖基化接枝度为(35.67±0.74)%。对改性前后OVA的乳化性、起泡性进行了分析。结果表明,协同改性较单独酶解明显改善了OVA的功能特性,为改善OVA的功能性质提供了一种有效的新方法。
对协同改性前后OVA进行了SDS-PAGE、红外、扫描电镜分析,结果表明协同改性使其分子质量发生明显变化,由原来的44.3 kDa变为45.0~97.2 kDa;蛋白的二级结构被破坏,葡聚糖连接到OVA肽上,部分吸收峰变强;协同改性使其微观结构发生明显变化,由原来球状变成片状结构,排列更加紧密。
