多聚赖氨酸诱导的负电性磷脂巨囊泡形变∗
2018-09-06盛洁1王开宇1马贝贝2朱涛1蒋中英2
盛洁1)2) 王开宇1) 马贝贝2) 朱涛1)† 蒋中英2)1)‡
1)(南京大学物理学院,固体微结构物理国家重点实验室,人工微结构科学与技术协同创新中心,南京 210093)2)(伊犁师范学院电子与信息工程学院,微纳电传感技术与仿生器械重点实验室,伊宁 835000)(2018年3月16日收到;2018年4月15日收到修改稿)
1 引 言
微纳米尺寸的囊泡比表面积大,可携带大量的膜结合物.其中粒径在5—200µm的巨囊泡(giant unilamellar vesicles,GUVs)易于观测和操作,被广泛用于生物模拟[1,2]、药物包封和递送[3]、纳米颗粒合成及微反应器[4]等方面的研究.聚合物大分子修饰相反电性脂质膜[5],可改变其电学性质[6]、改进其药物输运能力、增强其稳定性和生物兼容性[7].
多聚赖氨酸(poly-Llysine hydrobromide,PLL)是一类生物降解高分子聚合物,对生物体无毒、无副作用和无免疫源性,具有良好的生物相容性,可通过体内的水解或酶解反应最终降解为小分子的氨基酸,被人体吸收.PLL侧链的—NH2功能基团易与细胞膜上的阴离子静电吸附,有很强的黏附力,从而被用于修饰材料,具有较高的科研价值与应用前景[8,9].
PLL可以与相反电性脂质双层高度结合[10].在很多应用中,正电性的PLL被用于将携带负电荷的受试物(例如细胞或蛋白质)黏附到负电性的衬底上[11].如PLL绑定到带负电荷的固体支撑膜(SLBs)表面,以逆转膜表面电性,并允许第二个双层通过囊泡融合形成,附加层以简单的逐层方法构建[12].研究者已基于SLB开展了大量生物膜与聚合物作用的研究[13−15],但聚合物与GUVs相互作用的研究相对匮乏.Luan和Ramos[12]通过激光扫描共聚焦荧光显微镜观察了带反向电荷的聚电解质(PE)分子诱导多电荷多层囊泡的形态转变.由高PE浓度梯度诱导带电双层的离散和绑定,最终导致中空胶囊的自发形成,其厚壁由与PE分子结合的脂质多层组成.Menger等[16]利用光学显微镜观察到PLL可诱导负电性GUVs上出现黑点,并在一段时间后生长出“绳”,但未阐明其响应的机理.Kim和Sung[17]基于聚合物与生物膜作用的标度理论解释了生物膜内凹与外突的产生机制.弱吸附导致生物膜向外弯曲,产生的正曲率结构有利于增加聚合物的构象熵.而强吸附导致生物膜向内弯曲,形成的内陷囊泡有利于增大聚合物-生物膜的作用面积与黏附能.Lee和Larson[18]基于分子动力学模拟,发现PE吸附会诱导生物膜发生形变,但刚性聚酰胺-胺(PAMAM)枝状分子诱导形变的能力显著强于线性分子PLL.关于聚合物诱导GUVs响应的研究,仍然需要开展大量直观显微表征以对其内在过程及调控因素进行深入的理解和诠释.
利用倒置荧光显微镜实时观察PLL诱导含负电性磷脂的GUVs,出现相邻GUVs粘连、GUVs壁向内增长生出“绳”状结构以及GUVs破裂等现象,并对实验现象进行机理分析.为基于聚合物-GUV体系的药物输运和控释、细胞形变、微观可控反应和基因治疗等方面的研究提供有价值的参考数据和技术支持.
2 实 验
2.1 材 料
二油酰磷脂酰胆碱(1,2-dioleoyl-sn-glycero-3-phosphocholine,DOPC)、二油酰磷脂酸(1,2-dioleoyl-sn-glycero-3-phosphate,DOPA)、染色剂NB D-PE[1,2-dipalmitoyl-sn-glycero-3-pho-sphoethanolamine-N-(7-nitro-2-1,3-benzoxadiazol-4-yl)(ammonium salt)]和PLL[分子量(mass fraction,MW):4000—15000和15000—30000]均购于美国Sigma公司;氯化钠(NaCl)、磷酸氢二钠(Na2HPO4·12H2O)、磷酸二氢钾(KH2PO4)、氯仿、无水乙醇和甲醇均为国产分析纯试剂.
2.2 溶液配置
以氯仿/甲醇(体积比为19:1)为溶剂,分别配置DOPC,DOPC/DOPA(1:0.1)和DOPC/DOPA(1:0.4)磷脂溶液,浓度均为4 mg/mL.掺杂电中性的NBD-PE染色磷脂分子,染色剂占总磷脂的比例为2%(摩尔分数).PLL配制成浓度为1 mg/mL水溶液,塑料离心管封装成若干份,−20◦C储存;使用时取出解冻,4◦C冷藏,一周内用完.10 mmol·L−1,pH=6.98的磷酸缓冲盐溶液(phosphate buf f er saline,PBS)缓冲液,4◦C冷藏,一周内用完.实验用水是经Milli-Q离子交换净化系统处理所得的超纯水.
2.3 制备GUVs
氧化铟锡(ITO)导电玻璃搭建流动舱用于电制备GUVs[19,20].使用涂抹法将2µL的磷脂溶液均匀涂抹在清洗好的ITO电极上,置于真空干燥箱至少2 h,确保膜内有机溶剂完全挥发.电制备GUVs时,先向反应舱室注入PBS缓冲液,后施加电场,利用显微镜实时观察GUVs的生成过程,控制生成合适粒径的GUVs.PLL与GUVs相互作用实验仍然在电制备GUVs的流动舱进行.舱室容积为0.235 mL,直径10 mm、高3 mm的圆柱区域.单通道微量注射泵(KD scientif i c,美国)注液速率取0.1 mL/h.
3 结果与讨论
舱室内注入PLL(MW:15000—30000)的最终浓度达到约为49µg/mL时,相邻DOPC/DOPA(1:0.1)GUVs粘连,囊泡内壁生长出“绳”结构,以及粘连处面积逐渐增大,如图1所示.GUVs中负电磷脂DOPA含量越高,所需PLL的浓度越低.换而言之,GUVs负电性越强,其对PLL的响应越剧烈.注入PLL(MW:15000—30000)的最终浓度达到700µg/mL时,对DOPC GUVs不产生响应.
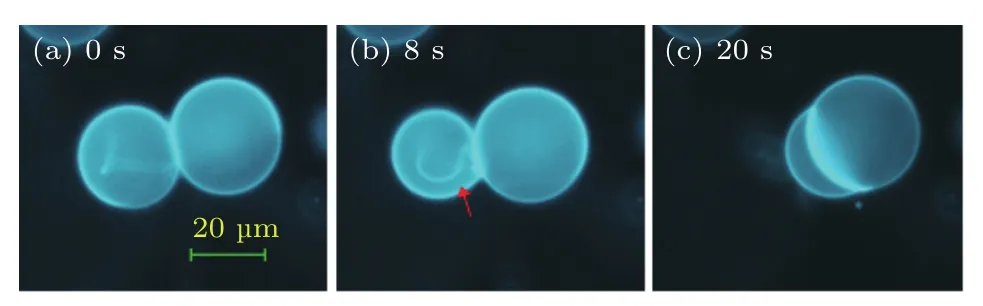
图1 PLL(MW:15000—30000)诱导DOPC/DOPA(1:0.1)GUVs响应的荧光显微镜图 (a),(b)相邻GUVs粘连和出“绳”;(c)20 s后,粘连处面积增大Fig.1.Fluorescence imaging of DOPC/DOPA(1:0.1)GUVs induced after the addition of PLL(MW 15000–30000):(a),(b)Attachment of adjacent GUVs and formation of ropes;(c)GUV attachment area increased after 20 s.
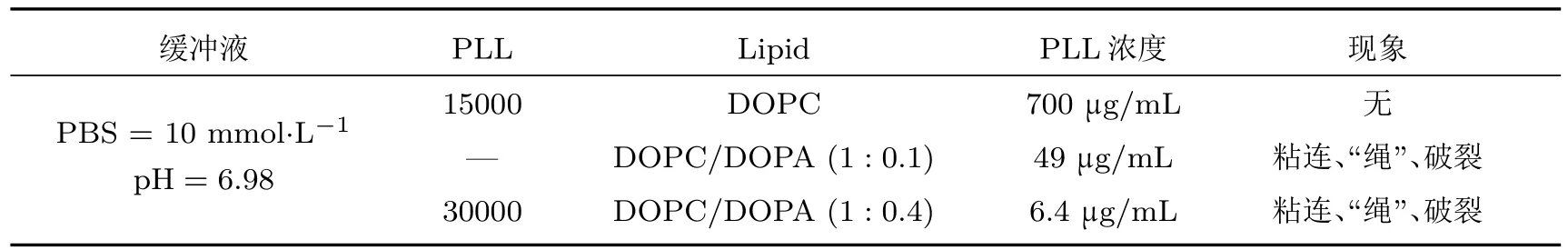
表1 相同条件下,PLL诱导不同GUVs产生响应所需的量Table 1.PLL induced the amount of response required for dif f erent GUVs under the same conditions.
以一个粒径为40µm的DOPC/DOPA GUVs计算,其中DOPC:DOPA=1:0.1,内含约0.7×1010个DOPA,则有1.4×1010阴离子.当舱室中PLL(MW:4000—15000)的最终浓度为10µg/mL时,其中约有1014个PLL,对应阳离子总数约为1015.因此,PLL具有足够的电荷与DOPA结合.对照表1数据,分析认为PLL可诱导负电性GUVs响应,但对电中性的GUVs无影响.
3.1 相邻GUVs粘连
注入PLL后相邻GUVs的粘连有两种情况:1)相靠的GUVs粘连,且粘连面积增大,如图2中红箭头所指之处;2)临近的GUVs,逐渐靠近并粘连,如图2中粉箭头所指之处,测量该处两个GUVs初始间距约为0.6µm.Pantazatos和Mac-Donald[21]曾研究发现相反电性的囊泡会粘连,粘连处面积增大,两个囊泡中的磷脂分子相互交换,说明粘连处磷脂双层融合.
PLL分子是含有若干个赖氨酸残基的阳离子聚合多肽,具有很高的正电荷密度[10],可与负电性物质结合[22].已知分子量为15000—30000的单个PLL链长33—66 nm、内含190—380个阳离子.生理条件下,DOPC显电中性,DOPA带两个负电荷.PA上的电荷对单价电解质浓度的变化非常敏感,当单价盐浓度低于75 mmol·L−1时,PC和PA将快速分离[23].因此,分析认为在实验溶液环境中,DOPC/DOPA GUVs出现不混溶的PC和PA富集区.我们认为,溶液中的PLL将分别吸引两侧GUVs中的DOPA富集区,诱导GUVs粘连.
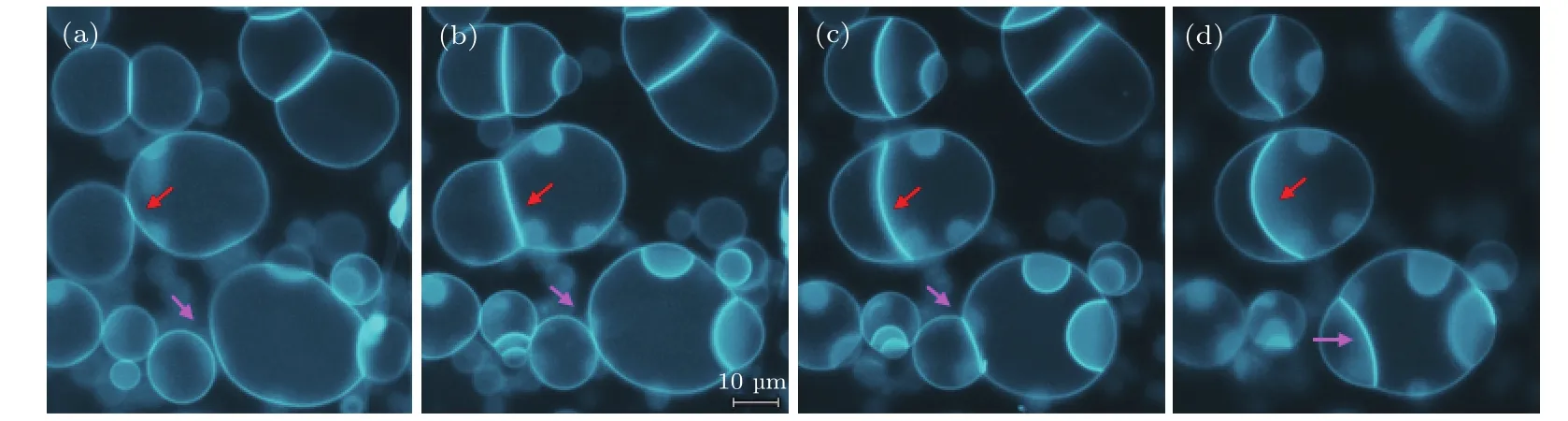
图2 PLL(MW:15000—30000)诱导DOPC/DOPA(1:0.4)GUVs粘连过程的荧光显微镜图(相靠GUVs的粘连如红箭头所指,临近GUVs的粘连如粉箭头所指) (a)0 min;(b)1 min;(c)3 min;(d)5 minFig.2.Fluorescence imaging of the attachment between DOPC/DOPA(1:0.4)GUVs induced by the addition of PLL(MW 15000–30000):(a)0 min;(b)1 min;(c)3 min;(d)5 min(the red and pink arrows indicate the attachments between the adjacent vesicles and the nearby vesicles,respectively).
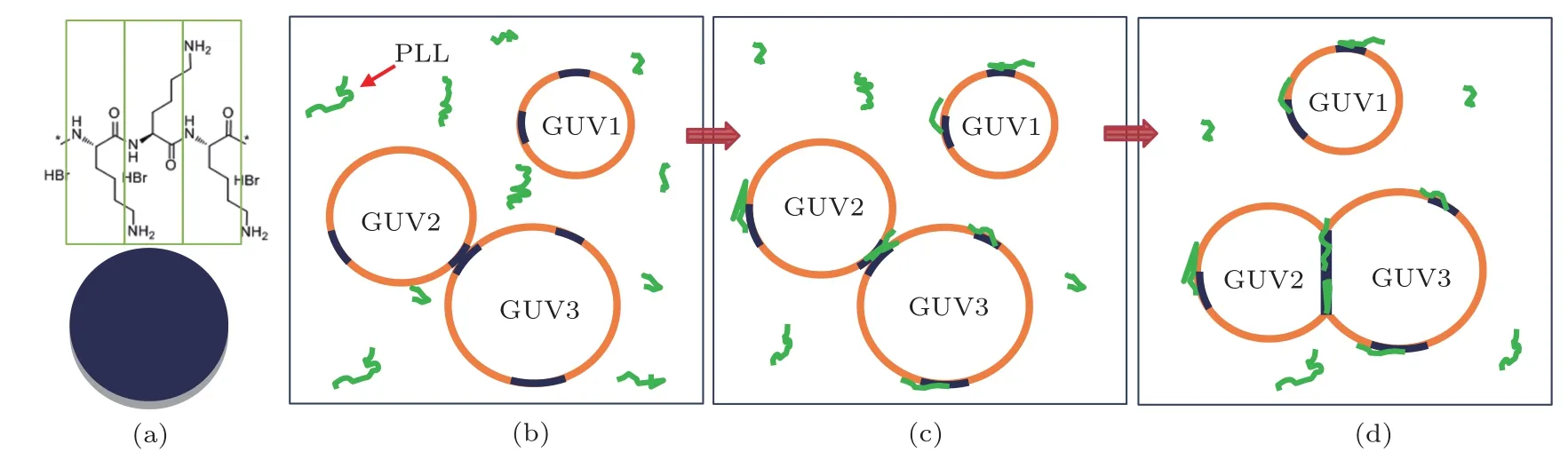
图3 PLL诱导DOPC/DOPA GUVs粘连的示意图(注:示意图与实际尺寸无关联) (a)一个DOPA头基占据3个PLL残基单体的空间位置;(b)溶液中PLL均匀扩散;(c)PLL与DOPA富集区结合,形成正电性微区域,相邻GUVs粘连;(d)粘连处面积扩大;绿色无规则线型结构代表PLL分子,圆圈橘部分为GUVs中DOPC富集区,深蓝色部分代表DOPA富集区Fig.3.Schematic diagram of PLL-induced DOPC/DOPA GUV attachment:(a)Surface area of one DOPA headgroup is equal to that of three PLL residues;(b)uniform dif f usion of PLL in solution;(c)adsorption of PLL to DOPA-enriched membrane area,formation of positively charged domains,and attachment of adjacent vesicles;(d)increase of the attachment membrane area.The green coils represents PLL,while the orange and blue colors represent the membrane area enriched in DOPC and DOPA,respectively(Note:This diagram is not drawn to scale).
生理条件下,PLL阳离子残基单体长度约0.35 nm,磷脂分子头基半径约0.47 nm.则从几何限制考虑,一个DOPA头基和PLL静电吸附时,将占据3个残基单体的位置,则富余4个阳离子,如示意图3(a)所示.该处电性反转,且增加为原来的两倍.图3(b)所示,GUV1,GUV2和GUV3彼此相邻,空间中分散着PLL分子,GUVs上DOPC和DOPA不混溶的富集区随机分布.PLL与GUVs中DOPA富集区静电吸附[12,24,25],形成一个PLL/DOPA的微结构域[7,26,27],且该微区域的电性由负电性反转为正电性,并增加两倍.PLL上充足的胺基阳离子可作为桥梁[27,28],通过静电吸附,将相邻的GUVs紧密粘连在一起,如示意图3(c)所示.这与PLL和负电性磷脂双层形成层层自组装结构现象一致,是否存在粘连融合的情况仍需进一步验证.由于PLL为无规则卷曲构像,其粘连在GUVs上将呈现平面结构.因此,随着粘连处周围吸附的PLL增多,粘连处的面积也逐渐扩大,如图3(d)所示.综上,PLL诱导GUVs彼此粘连的动力是静电吸引力.
3.2 GUVs内生长出“绳”结构
实验观察到,在pH中性环境中,少数粒径较大(>20µm)、空间位置相对独立的DOPC/DOPA GUVs易出现“绳”结构,如图4所示.推断可能是由于流体力学半径较大的GUVs的膜更容易受到溶液环境干扰而触发形变.GUVs会出现的“绳”结构,在GUVs中处于无规则扰动状态,其数量和长度都会逐渐变多、变长;也有GUVs中仅有一条“绳”的情况.图4(a)中GUVs充满了“绳”结构,荧光图不可辨识中空管状结构.图4(b)是30 s后GUVs在不同焦平面上的图像,GUVs中有一条宽1.4µm的微管(红箭头所指),荧光图可辨识为管状结构.图4(c)中,黄箭头所指GUVs中仅存在一条“绳”,绿箭头所指GUVs中有多条“绳”.图4(d)中GUVs生出的微管,荧光图可辨识,截面直径为2µm.
测量PLL溶液不同浓度的渗透压显示,PLL浓度小于 50µg/mL时,在测量精度范围内(1 mOsm/L)未发现渗透压改变;浓度在200µg/mL时,分子量小的PLL溶液透压小幅度降低.注入的PLL溶液使囊泡外部渗透压降低,将阻碍“绳”向囊泡内萌出[29].实验数据统计显示,导致DOPC/DOPA GUVs产生“绳”结构所需的PLL溶液浓度小于50µg/mL.因此,可以排除渗透压对出“绳”过程的贡献.我们认为GUVs壁向内生长出的“绳”结构,属于磷脂膜的侧向再组织行为.
由于PLL含大量正电荷,其几何长度为几纳米到几十纳米.因此,一条或多条PLL可与GUVs上的DOPA富集区静电吸附,形成一个正电性的PLL/DOPA微区域,如图5(a)所示.PLL/DOPA微区域相较于吸附前,物理特性改变,即磷脂膜两侧吸附不对称和电性翻倍反转,这将破坏该处原来的稳定状态.PLL/DOPA微区域内磷脂分子密度和分子间应力受到PLL构像的影响.PLL吸附造成微区域中GUVs外叶磷脂分子横向压缩,该处膜自发曲率向GUVs内部释放膜间应力,萌出“芽”结构,如图5(b)所示.另外,相邻的PLL/DOPA微区域之间、PLL/DOPA微区域和溶液中分散的PLL之间,均存在静电排斥力,如图5(c)所示红箭头所示.且分别增加为原来的4倍和两倍,严重打破了原有磷脂分子间的力学平衡.静电排斥力将“芽”与GUVs连接边缘处的PLL/DOPA微区域逐渐推入GUVs内部,即生长出“绳”结构.
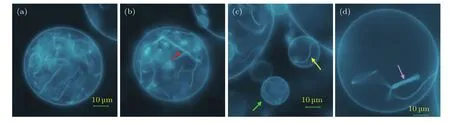
图4 PLL(MW:4000—15000)诱导DOPC/DOPA(1:0.4)GUVs产生“绳”结构的荧光显微镜图 (a)大量“绳”结构,宽度<1µm;(b)30 s后的微管结构,直径1.4µm;(c)GUVs中仅一条“绳”,黄箭头指示;(d)微管结构,直径为2.3µm,粉箭头指示Fig.4.Fluorescence imaging of the formation of ropes from DOPC/DOPA(1:0.4)GUVs induced by the addition of PLL(MW 4000–15000):(a)Large number of ropes with diameter less than 1 µm;(b)after 30 s,the diameter of ropes increases to around 1.4µm;(c)GUV with one rope(yellow arrow)and many ropes(green arrow);(d)tube with a diameter of 2.3µm(pink arrow).
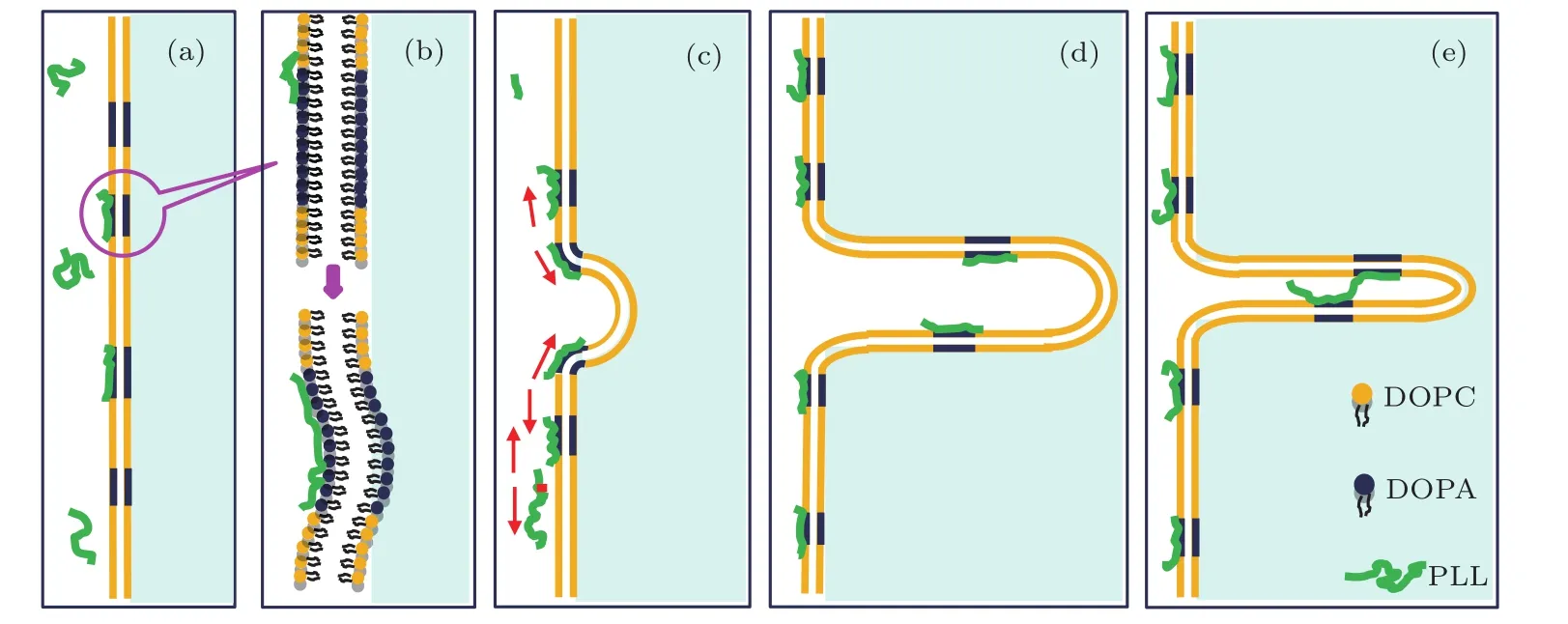
图5 “绳”结构萌出过程示意图(注:示意图与实际尺寸无关联) (a)DOPA富集区吸附PLL形成的正电性的微区域;(b)图(a)中微区域的放大图,磷脂双层外叶面积收缩引起膜向囊泡内部隆起;(c)萌出“芽”结构,红箭头代表微区域间静电排斥,以及微区域和PLL静电排斥;(d)形成微管;(e)形成“绳”Fig.5.Schematic diagram of PLL-induced rope formation:(a)Adsorption of PLL adsorpted to DOPA-enriched membrane area,formation of positively charged domains;(b)enlarged image from panel(a)shows that the contraction asymmetry in the two lipid leaf l ets causes the bending of the lipid membrane inward;(c)budding of the membrane;the red arrows indicates the electrical repulsion between the micro-domains,as well as the electrical repulsion between micro-domain and PLL;(d)formation of the tubes;(e)formation of ropes(Note:This diagram is not drawn to scale).
Khalifa等[30]利用微操实现局部pH梯度,观察到定向诱导50µm的GUVs动态嵴状膜内陷,若撤去该处pH梯度,内陷可以恢复并消失.实验观察到GUVs内陷生出“绳”未自动收缩消失.分析认为,当“芽”萌出,生长成“绳”后,磷脂分子间应力得到了释放.分子间力平衡后,“绳”的长度固定,系统达到相对稳定,如图4(c)中黄箭头所指的GUVs中长度稳定的“绳”.
“绳”在GUVs内无规则的扰动是 “绳”继续生长的一种动力.内含多条“绳”的GUVs,“绳”中PLL/DOPA微区域的电性使“绳”彼此间静电排斥,造成剧烈扰动.扰动的“绳”不断将GUVs接口拖处的分子拖入“绳”内,即出现“绳”不断变长.
分别测图4(a)和图4(b)中GUVs的直径,各15组,取平均值,参见表2.分析认为“绳”的生长消耗GUVs中磷脂分子,导致GUVs直径减小∆D=DA−DB≈2.5µm(A代表0 s,B代表30 s),其表面积减少∆S=SA−SB≈862µm2.已知磷脂双分子层厚4 nm,PLL(MW:4000—15000)对应的无规则卷曲线型构像,长度约为8—30 nm,这对于荧光图中估测的微米级直径的“绳”而言,可以将“绳”看作如示意图5(d)和图5(e)所示直径不同的微管[16].
计算∆S≈862µm2可以新生成以下3种结构:1)约6条直径1.4µm、长度30µm的微管,但实际上调整不同聚焦平面仅观测到一条;2)假设PLL伸展后的线状结构可以横跨粘连微管壁,呈现如示意图5(d)所示,可生成约190条,直径0.03µm,长度50µm的微管,这与实验观察到“绳”的数量有较大差异;3)直径0.5µm、长度40µm的微管,可新生成28条,这与观察到的实际图像符合.综上分析,∆S可新生成的“绳”结构是不同直径的微管,这仍需要进一步用实验证实.

表2 GUVs形变和生成微管的相关几何参数及计算数据Table 2.Geometric parameters and calculation data of GUVs deformation and microtubules generation.
3.3 GUVs破裂
实验观察到,注入PLL可导致GUVs破裂.大多数GUVs粘连后迅速破裂,未观察到“绳”结构的生长.个别生出“绳”结构的GUVs在一段时间后破裂.分析认为,PLL诱导GUVs粘连或向内生出大量的“绳”,使GUVs中某处分子的间距大于范德瓦耳斯截断半径时,造成GUVs破裂.
另外,粘连的GUVs中,一个或几个GUVs破裂后,完整的GUVs表面会出现类似相分离的微畴结构.如图6(a)中红箭头所指GUVs破裂后,出现图6(c)黄箭头所指的高亮区.分析认为,由于PLL上足够的电荷可作为中间桥梁,分别吸附两侧负电性带电体,自组装形成多层膜结构[27].此高亮区是残余双层膜通过PLL静电吸附在完整的GUVs上,显示出高亮荧光区域.由于PLL/DOPA微区域间静电排斥和磷脂分子的流动性,微畴区域出现面积改变和位置移动的响应.这一结果为GUVs与聚合物大分子层层自组装复合系统的研发提供了重要的参考依据.

图6 PLL诱导DOPC/DOPA(1:0.1)GUVs破裂图荧光显微镜 (a)相邻 GUVs粘连;(b)其中一个GUVs破裂;(c)GUVs上出现类似相分离微畴区域Fig.6.Fluorescence imaging of PLL-induced DOPC/DOPA(1:0.1)GUVs rupture:(a)Attachment between adjacent GUVs;(b)rupture of one GUV;(c)formation of the phase separation structure.
4 结 论
利用荧光显微镜原位观测研究了PLL对磷脂GUVs的影响.实验发现,PLL引发含负电磷脂的GUVs向内部长生出“绳”、粘连和破裂.
PLL诱导负电性GUVs形变响应,对中性GUVs无影响.PLL与负电性GUVs相互作用是自发曲率、静电排斥力与膜间张力的竞争过程.在低盐溶液中,DOPC和DOPA混溶性差,形成DOPA富集的微区域.PLL与DOPA富集区静电吸附,使PLL/DOPA微区域电性反转,带电量翻倍.PLL作为桥梁,因静电力分别吸附两侧GUVs粘连.PLL/DOPA微区域之间、PLL/DOPA微区域和PLL之间,存在静电排斥力.GUVs吸附PLL,导致内外叶面积不对称,引起该处膜自发曲率.磷脂分子间张力增加,阻碍“绳”生成.静电排除力、自发曲率促进粘连、出“绳”和破裂.
我们的研究结果对聚合物-GUVs体系为模型的药物输运和控释、细胞形变、微观可控反应和基因治疗等方面的研究提供有利的支持.
