结肠癌患者化疗前后血清白蛋白水平与临床病理特征及预后的关系研究*
2018-09-06杨焕丽贾泽博刘振社
杨焕丽 贾泽博 刘振社△
(咸阳市中心医院 1检验科 2消化内科 陕西咸阳 712000)
结肠癌是常见消化道肿瘤,受膳食结构改变等因素的影响,国内发生率呈逐年上升趋势,广州市调查显示2004年至2013年结直肠癌粗发病率33.77/10万,且结肠癌平均年度变化百分比为2.11%[1],尽管针对结肠癌的综合治理在不断更新与发展,但现阶段患者经常规手术、化疗及放疗等治疗后,5年无病生存率仅约70%,且TNM分期越高,5年无病生存率越低[2-3]。鉴于此,及时发现高预后不良风险患者尤为重要。有研究认为炎症反应、营养不良等与患者疾病进展相关,炎症反应及营养不良症状越严重、结肠癌进展度越高[4-5]。 血清白蛋白(albumin,ALB)是反应机体营养状态的重要指标,有研究称术前该指标的水平对预测结肠癌根治术预后有一定指导价值[6],但针对性探讨化疗诱导ALB变化对预测进展期结肠癌疗效及预后价值的报道尚少,本研究旨在探讨上述问题,现报告如下。
1 资料与方法
1.1 一般资料 纳入2014年1月至2015年6月于本院接受治疗的205例Ⅳ期结肠癌患者为研究对象,进行回顾性分析。其中男性131例、女性74例;年龄37~78岁,≥ 60岁者108例,<60岁者97例,平均年龄(57.18±12.15)岁;美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体能状态评分 (Zubrod-ECOG-WHO,ZPS)[7]0 分者 29 例,1~2分者176例;转移器官数量1个者139例,≥2个者66例;肿瘤高-中分化者147例,低分化者58例;123例患者伴肝转移;大体类型浸润型者28例、隆起型者42例、溃疡型者135例;病理组织学分型腺癌者195例、未分化癌者10例。
1.2 纳入标准 (1)参考美国国立综合癌症网络相关标准[8],符合Ⅳ期结肠癌;(2)结肠癌首诊患者;(3)因肿瘤分期或临床状况无法开展手术,最终接受一线含氟尿嘧啶方案化疗患者;(4)完成至少2个化疗周期,有完整的化疗前后生化指标检测结果,可以评价疗效。
1.3 排除标准 (1)合并免疫系统疾病史、肝脏及肾脏疾病者;(2)既往放化疗史患者;(3)本次治疗前1个月内有急性感染病史者;(4)本次治疗前1个月内经静脉途径补充外源性白蛋白者;(5)随访顺应性低者。

表 1 ALB<35 g/L 患者分布情况[n(%)]
表2 不同近期疗效患者ALB变化情况对比(g/L,)

表2 不同近期疗效患者ALB变化情况对比(g/L,)
与CR组对比,*P<0.05;与PR组对比,#P<0.05;与SD组对比,△P<0.05。
组别 例数 化疗前 化疗后 t P CR 3 47.00±7.58 38.23±2.01 1.971 0.187 PR 104 45.66±4.25 43.14±6.12* 3.391 0.001 SD 72 37.65±2.81*# 37.37±2.63# 5.166 0.000 PD 26 30.30±6.27*#△ 31.52±4.90*#△ -1.420 0.168 F 116.953 45.504 P 0.000 0.000
表3 不同患者ALB变化情况对比(g/L,)
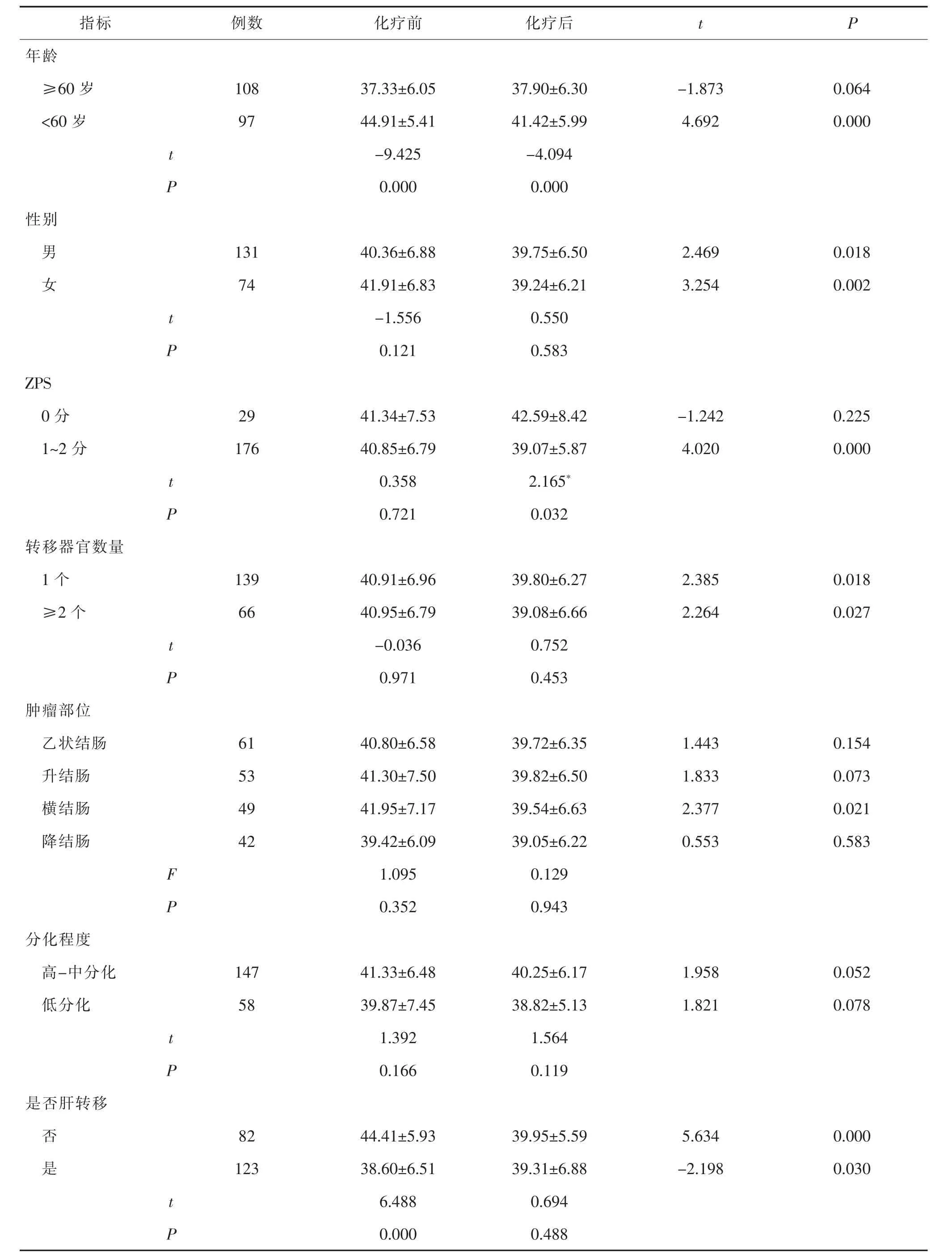
表3 不同患者ALB变化情况对比(g/L,)
指标 例数 化疗前 化疗后 t P年龄≥60 岁 108 37.33±6.05 37.90±6.30 -1.873 0.064<60 岁 97 44.91±5.41 41.42±5.99 4.692 0.000 t-9.425 -4.094 P 0.000 0.000性别男131 40.36±6.88 39.75±6.50 2.469 0.018女74 41.91±6.83 39.24±6.21 3.254 0.002 t-1.556 0.550 P 0.121 0.583 ZPS 0 分 29 41.34±7.53 42.59±8.42 -1.242 0.225 1~2 分 176 40.85±6.79 39.07±5.87 4.020 0.000 t 0.358 2.165*P 0.721 0.032转移器官数量1 个 139 40.91±6.96 39.80±6.27 2.385 0.018≥2 个 66 40.95±6.79 39.08±6.66 2.264 0.027 t-0.036 0.752 P 0.971 0.453肿瘤部位乙状结肠 61 40.80±6.58 39.72±6.35 1.443 0.154升结肠 53 41.30±7.50 39.82±6.50 1.833 0.073横结肠 49 41.95±7.17 39.54±6.63 2.377 0.021降结肠 42 39.42±6.09 39.05±6.22 0.553 0.583 F 1.095 0.129 P 0.352 0.943分化程度高-中分化 147 41.33±6.48 40.25±6.17 1.958 0.052低分化 58 39.87±7.45 38.82±5.13 1.821 0.078 t 1.392 1.564 P 0.166 0.119是否肝转移否82 44.41±5.93 39.95±5.59 5.634 0.000是123 38.60±6.51 39.31±6.88 -2.198 0.030 t 6.488 0.694 P 0.000 0.488

续表3
1.4 化疗方案 所有患者均接受一线含氟尿嘧啶方案化疗,127例应用奥沙利铂+卡培他滨,78例应用奥沙利铂+亚叶酸钙+5-氟尿嘧啶,21 d为1个周期,给予6~9个周期或至疾病进展,化疗期间给予对症支持,第2个周期结束后,测评疗效,根据影像学复查结果,参考实体瘤评价标准[9],将疗效划分为完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、疾病稳定(stable disease,SD)和疾病进展(progression disease,PD)。
1.5 观察指标 (1)患者一般资料及病理资料:患者年龄、性别、转移脏器数量、原发部位、分化程度、疾病分期、病理大体类型、病理组织学分型。(2)生化指标。参考既往研究[10],检测化疗前癌胚抗原(carcinoembryonic antigen,CEA)水平,检测方案为化学发光法,参考实际说明书,CEA按≥4.3 ng/mL和<4.3 ng/mL分级。检测患者化疗前后ALB水平,参考格拉斯哥预后评分系统[10],ALB 按≥35 g/L 和<35 g/L分级。同时,肝脏为患者主要转移器官,因此检测患者肝功能,本研究主要检测化疗前谷丙转氨酶(alanine aminotransferase,ALT)、 总胆红素 (total bilirubin,TB)水平,并参考既往报道[11-12]中分界标准,将ALT按≤40 U/L和>40 U/L分级,TB 按≤17.1 μmol/L 和>17.1 μmol/L 分级。(3)疗效。于化疗第 2 个周期结束后1 w内统计化疗疗效,同时对患者持续随访,观察起点设定为第2周期化疗结束、疗效评估完毕时,截止2018年5月,首3个月内每2 w定期随访1次,第4~12个月内每月定期随访1次,此后每1~3个月随访1次,遇病情变化,随时返院复查。
1.6 统计学方法 采用SPSS 19.0处理数据。计量资料按()表示,多组间对比采用单因素方差分析及SNK-q检验,两两对比采用独立样本t检验,组内前后对比采用配对样本t检验。计数资料计算构成比[n(%)],组内前后对比采用McNemar检验。生存时间的对比采用Kaplan-Meier法及Log-rank检验。生存时间的影响因素采用Cox回归模型分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 患者近期疗效统计 化疗后,205例研究对象 CR、PR、SD、PD 患者分别 3 例 (1.46%)、104 例(50.73%)、72 例(35.12%)、26 例(12.68%)。
2.2 患者总体化疗前后ALB变化情况 化疗前共40例ALB<35 g/L,化疗后增加至52例,化疗后该此类患者增多 (McNemar检验,P=0.008),见表1。化疗前ALB (40.92±6.89)g/L,化疗后下降至(39.57±6.39)g/L,化疗后 ALB 明显下降,与化疗前差异有统计学意义(t=3.306,P=0.001)。
2.3 不同近期疗效患者ALB变化情况对比 化疗前后,PD患者ALB水平均低于其他3组,差异均有统计学意义 (均P<0.05)。化疗后,PR、SD患者ALB水平均下降,与化疗前相比差异有统计学意义(均P<0.05),均值均保持在35 g/L以上。
2.4 不同临床病理特征患者ALB变化情况对比化疗前,年龄<60岁者ALB水平高于年龄≥60岁者,肝转移患者ALB水平低于未发生肝转移患者。化疗后,年龄<60岁者ALB水平高于年龄≥60岁者;ZPS评分0分者ALB水平高于1~2分者;CEA>4.3 ng/mL者ALB水平低于CEA≤4.3 ng/mL者。上述组间差异均有统计学意义(均P<0.05)。年龄≥60岁者,ZPS评分0分者,肿瘤位于乙状结肠、升结肠、降结肠患者,肿瘤分化程度高-中分化及低分化者,化疗前ALT>40 U/L者,化疗前CEA≤4.3 ng/mL者,化疗前 TB>17.1 μmol/L者,组内 ALB水平在化疗前后差异均无统计学意义(均P>0.05)。见表3。2.5 患者总生存情况观察 所有患者随访3~46个月,中位随访20个月。患者1年、2年、3年累积生存率分别88.2%、69.3%、50.9%,中位生存时间40个月。见图1。

图1 患者化疗后总生存情况观察
2.6 化疗前后不同ALB水平患者的总生存情况化疗前后ALB≥35 g/L者总生存时间均长于ALB<35 g/L者,差异有统计学意义 (Log-rank χ2=102.105、127.454,P 均 < 0.001)。化疗前 ALB≥35g/L者 1年、2年、3年生存率分别为 95.7%、93.9%、93.2%,中位生存时间44个月;ALB<35 g/L者上述指标分别为72.5%、43.1%、10.8%、17个月。化疗后ALB≥ 35 g/L者 1年、2年、3年生存率分别为96.6%、95.9%、95.1%,中位生存时间40个月;ALB<35 g/L者上述指标分别为76.9%、63.0%、43.3%、17个月。
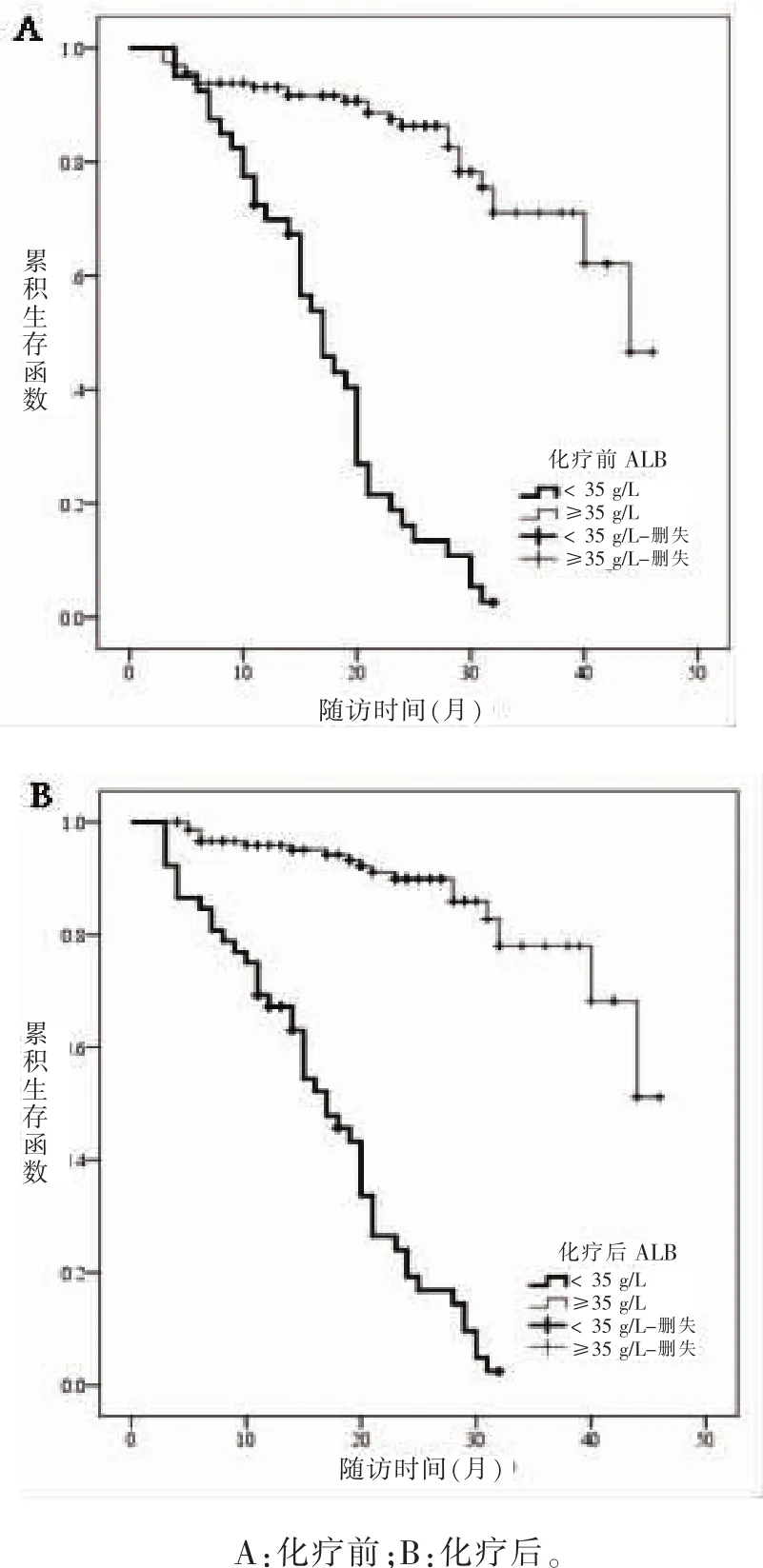
图2 化疗前后ALB水平患者的总生存情况
2.7 患者累积生存时间影响因素的单因素分析单因素分析结果显示,化疗前后ALB水平、是否肝转移、化疗前CEA水平与患者累积生存时间有关(均P<0.05);进一步进行多因素分析模型,显示化疗后ALB水平是患者累积生存时间的独立影响因素(P < 0.05)。 见表 4、表 5。
3 讨 论
ALB是反映机体营养状态的重要指标,结肠癌伴低ALB血症可能与高转移率、摄入减少、肝转移影响ALB合成等因素有关[13],本研究提示化疗前ALB水平与患者化疗近期疗效有关:PD患者化疗前ALB低于CR、PR及SD患者,这与针对中晚期食管癌[14]、晚期非小细胞肺癌化疗[15]的报道结果相符。化疗前患者ALB水平普遍下降,主要因肿瘤所致慢性炎症反应影响ALB合成,而ALB下降又导致患者抵抗力下降,可能会加重机体炎症反应,形成“炎症反应-低ALB 血症”的恶性循环[16]。化疗前年龄 < 60岁者、未发生肝转移者ALB水平分别高于年龄 ≥60岁者及发生肝转移患者,其中高龄患者基础体能状态更差,肝转移可能影响肝脏功能,从而影响ALB水平,上述结果提示此类患者接受化疗后预后可能更差,有研究报道称化疗前CEA、肿瘤分化程度等与结肠癌患者预后有关[17-18],本研究也显示化疗前CEA水平与患者累积生存时间有关,但本研究发现不同化疗前CEA水平及不同肿瘤分化程度患者中其化疗前ALB水平无明显差异,原因尚需进一步探讨。

表4 患者累积生存时间影响因素的单因素分析

表5 患者累积生存时间影响因素的多因素分析
本研究所有患者均完成整个一线化疗周期,化疗后ALB水平总体呈下降趋势,可能与疾病控制不良、化疗毒副反应等有关。由于ALB水平的下降主要与 “炎症反应-低ALB血症”的恶性循环程度有关,因此化疗2个周期后ALB水平可一定程度上反映化疗后患者疾病控制状况。PR、SD患者化疗前后ALB均值均保持在35 g/L以上,提示其“炎症反应-低ALB血症”的恶性循环影响或相对较轻,而PD在化疗2个周期后依旧维持相对较低的ALB水平。此外,本研究患者1~3年的累积生存率较已有研究差[19],但与其他报道[20]中的晚期结肠癌患者生存率接近。经Cox回归分析,结果提示化疗后ALB水平是累积生存时间的独立影响因素,表明了监测ALB水平在评估患者近期疗效及预后有一定的指导意义。
综上所述,经化疗治疗,患者ALB平均水平较化疗前下降且ALB<35 g/L占比较前增加,不同近期疗效及临床病理特征的患者其化疗前后ALB水平不同,化疗后ALB水平是累积生存时间的独立影响因素。
