内源性γ-干扰素对斑马鱼血管发育的影响
2018-09-05蒋伟青王永刚
蒋伟青,袁 欣,刘 晨,任 潇,王永刚
一个成熟的血管网络结构的形成需要经过复杂的过程,包括血管发生、血管生成和其后伴随的血管形成、血管稳定、血管分支、血管修剪和血管分化[1]。已经有许多研究报道了免疫系统在血管生成中的重要作用。而关于γ-干扰素(interferon-γ,IFN-γ)对血管生成的作用,国内外报道有着不同的结果。该研究拟以斑马鱼为模式生物,在体研究内源性IFN-γ对血管发育的影响。
1 材料与方法
1.1实验动物该实验所用的斑马鱼品系为Tg(Flk1:eGFP),用于标记斑马鱼内皮细胞。每个实验组使用6条斑马鱼幼鱼。斑马鱼胚胎养殖于10% Hanks溶液,放置于14 h/10 h明暗交替的28 ℃恒温培养箱。
1.2胚胎显微注射显微注射是指在显微镜下,利用玻璃微电极将外源物质注射入胚胎细胞的技术。玻璃微电极由外径为1.0 mm、内径为0.58 mm的玻璃毛细管经微电极拉制仪拉制而成。在注射前,将房间温度调至20 ℃,以延缓受精卵分裂。在电极内灌入要注射的反义吗啉环寡聚核苷酸(morpholino oligomer,MO)后,将电极安装在电极夹持器上并45°倾斜固定于显微操作器上,镜下将电极尖端修剪至适合口径,使每次注射约1 nl。将待注射的物质注射入一细胞期受精卵的动物极中。MO购自美国Gene Tools公司。该实验所用MO序列如下,对照MO:5’-CCTCTTACCTCAGTTACAATTTATA-3’;crfb17 MO:5’-CGATGAGACACAGATCAATATCCGCAT-3’。利用电极将MO(2 ng)注入1-细胞期胚胎动物极,另注入等浓度的对照MO作为对照。
1.3斑马鱼活体共聚焦成像用于共聚焦成像的斑马鱼于胚胎受精后天数(day post fertilization,dpf)为1 dpf时去卵膜,并在Hanks溶液中加入0.003%的 N-苯基硫脲(1-phenyl-2-thiourea)防止其色素形成。成像前,将斑马鱼包埋于浓度为0.013 mg/ml的低熔点胶中。斑马鱼活体共聚焦成像使用Olympus Fluoview 1000激光共聚焦显微镜。成像中使用XLumplfl 20×(W/IR NA:0.95) 物镜。光路、光电倍增管接收光谱范围、pinhole大小及分光镜等参数,采用Fluoview 1000软件染料列表中给出的最优参数。Z轴成像间距取3 μm。
1.4斑马鱼中脑血管三维结构定量分析利用共聚焦显微镜对Tg(Flk1:eGFP)的斑马鱼胚胎进行XYZ轴成像后,利用该实验室编写的脑部血管三维结构定量分析软件对其中脑网络血管特征进行分析,包括中脑血管密度、中脑血管节段数和中脑血管密度。具体步骤如下:① 原始图像处理:利用Image J软件对原始图片进行区域选择,范围区域需包含所有中脑血管,范围大小需与模板脑图像的大小一致,选定区域后将图像剪裁,随后将原始图像处理为从Z轴由深至浅排列的8位tiff图;② 图片等方向性插值:利用实验室自主编写的软件,在菜单栏property setting输入原始图片的XYZ轴分辨率,通过 equal insert将处理过得8位tiff图进行等方向性插值处理,并保存;③ 提取中脑血管:通过3D V/B match功能,将血管图与模板脑图片进行Z轴方向重合,根据模板脑大小去除中脑以外的血管;④ 图像分割和去燥:通过segment batch功能对灰度图片进行批量血管分割,分割阈值根据图像的灰度值进行人工设定,通过remove noise功能去除部分噪声点;⑤ 图像三维填充:通过fill 3D功能对分割后血管中的空隙进行填充;⑥ 图像三维重建和中脑血管精细提取:通过3D viewer binary images的points功能对填充处理过的图像进行三维重建显示;在三维显示界面下,将未去除干净的中脑以外的血管去除,并以原始图像为参照,将因信号过弱而导致断裂的血管进行小球填充,使其恢复连续性及原来的网络拓扑结构;⑦ 血管网络骨架中心线:将所有血管端点进行标记并保存,通过centerline generation功能对血管网络骨架中心线进行提取,并根据原始图像对存在错误的骨架中心线进行删除;⑧ 网络特征提取:分别通过feature analysis下的brain和vessel功能提取脑体积和血管体积参数,通过Feature Analysis下Centerline中length的功能提取血管长度和血管节段数参数。

2 结果
2.1IFN-γ活动对斑马鱼脑血管发育的影响利用反义核苷酸技术,于斑马鱼胚胎1-细胞期分别将crfb17 MO和对照MO显微注射入胚胎动物极,下调斑马鱼IFN-γ受体crfb17的表达,从而抑制内源性IFN-γ的作用。由于斑马鱼脑血管发育时间窗为1.5~7 dpf,并在3 dpf时达到发育高峰[2],将3 dpf设为观察起始点。又由于crfb17 MO组的胚胎在6~7 dpf时状态普遍不佳,出现心包严重水肿、脊柱弯曲等症状,将5 dpf设为观察结束点。分别在3 dpf和5 dpf这两个时间点对幼鱼脑血管进行活体三维荧光共聚焦成像(图1),结果显示crfb17 MO组相较对照MO组,脑血管发育受到了明显的抑制。
2.2中脑血管三维结构定量分析利用软件,对3 dpf时不同组别幼鱼的中脑血管三维结构进行定量分析,crfb17 MO组中脑血管总长度(5.7±0.8) mm、血管节段数(36.5±6.3)、血管密度(1.65%±0.22%)都较对照MO组[(9.2±1.3) mm、(62.5±5.1)、(2.75%±0.18%)]显著降低(t=5.606、7.804、9.409,P<0.001,进一步证实了下调内源性IFN-γ活动后,斑马鱼脑血管生成受到了抑制。见图2。
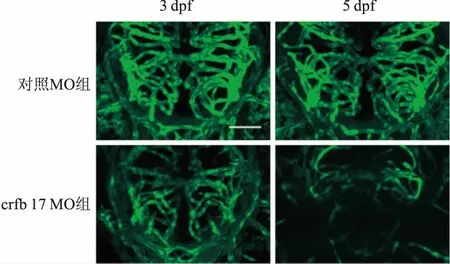
图1 crfb17 MO对斑马鱼脑血管发育的影响 ×26
2.3crfb17MO对斑马鱼躯干血管发育的影响由于中枢血管与外周血管发育的调控因素存在较大差异,为了探索IFN-γ对外周血管发育的影响,我们对斑马鱼胚胎进行相同的操作,并对躯干血管发育进行观察。斑马鱼躯干血管发育时间窗大致为胚胎受精后24~30 h(hours post fertilization,hpf)[2],选取介于24~30 hpf的时间点,即28 hpf(此时斑马鱼幼鱼的自发抖动较24 hpf时明显减少,利于成像)作为观察躯干血管发育的起始点,并于躯干血管发育结束后,即在31 hpf,再次进行成像,作为观察躯干血管发育的结束点。在正常斑马鱼躯干血管发育过程中,节间血管向背侧生长,并通过背侧纵向吻合血管(dorsal longitudinal anastomotic vessel,DLAV)相连接。图3显示,在28 hpf时,对照MO组已有少量DLAV连接相邻血管,至31 hpf时,所有DLAV已经长成并连接成管。而在crfb17 MO组中,从28 hpf至31 hpf,DLAV都没有发育完全,说明下调crfb17后,斑马鱼躯干血管的发育受到了明显抑制。
3 讨论
本研究显示,下调斑马鱼IFN-γ受体crfb17后,斑马鱼脑血管和躯干血管的发育受到明显抑制;对脑血管进一步的定量分析表明,3 dpf时crfb17 MO组中脑血管总长度、血管节段数、血管密度都较对照MO组显著降低。
已经有许多研究报道了免疫系统在血管生成中的重要作用。促炎性细胞因子如白介素6、白介素8和白介素1β等已被报道具有促进血管生成的作用[3]。然而,IFN-γ一直被认为是抑制血管生成的细胞因子[4-5]。IFN-γ对血管内皮作用的研究主要基于肿瘤背景,IFN-γ不仅通过作用于肿瘤基质细胞[6-7],而且直接作用于血管内皮细胞[8-9],达到抑制血管生长从而抑制肿瘤生长的效果。然而,也有相当一部分研究显示,IFN-γ具有促血管生成的作用。Trompezinski et al[10]和Liu et al[11]分别发现IFN-γ能促进人角质细胞和视网膜色素上皮细胞释放血管内皮生长因子从而促进血管生成。IFN-γ由免疫细胞产生,可以诱导巨噬细胞的活化,而Jetten et al[12]通过在小鼠腹腔血管生长基膜实验发现,M2型巨噬细胞能够增加内皮细胞的数量和管状结构的形成。该研究显示,抑制内源性IFN-γ活动,斑马鱼的血管发育受到了明显抑制,提示IFN-γ对斑马鱼血管发育的促进作用。

图2 3 dpf斑马鱼中脑血管三维结构定量分析A:斑马鱼中脑血管三维骨架图;B-D:斑马鱼中脑血管总长度、血管节段数、血管密度比较;与对照MO组相比:***P<0.001

图3 crfb17 MO对斑马鱼躯干血管发育的影响 ×20红色箭头:指示对照MO组中已发育成形的DLAV
斑马鱼的基因组中含有十个编码Ⅱ型细胞因子多肽的基因,其中两个与哺乳动物IFN-γ最相关的基因为IFN-γ1和IFN-γ2。其中IFN-γ1自斑马鱼胚胎0.5 hpf后就有持续的表达[13]。而ifng1-1和ifng1-2基因所表达蛋白的相应受体皆为crfb17。IFN-γ在斑马鱼的早期发育中也起重要作用,IFN-γ已被报道参与斑马鱼胚胎早期胆道发育[14]和造血干细胞的形成[7]。
本研究显示,通过抑制斑马鱼胚胎期内源性IFN-γ的作用,斑马鱼的脑血管和躯干血管发育都受到了严重影响。此外,下调crfb17后,3 dpf斑马鱼脑血管发育受到抑制,而5 dpf时脑血管发育受抑制的现象更为明显。由于3 dpf是斑马鱼脑血管发育的关键时期,胚胎脑血管发育在此时已受到抑制,另外,IFN-γ已被报道与斑马鱼胚胎早期胚胎发育中的重要作用[7,14],加上crfb17 MO的持续作用,导致5 dpf时脑血管发育受抑制的现象比3 dpf时更明显,进一步反映了内源性IFN-γ在长时程的脑血管发育过程中持续的重要作用。虽然大部分体外实验表明,外源性给予IFN-γ能抑制内皮细胞的增殖,也有报道证明,低剂量IFN-γ能诱导细胞增殖而高剂量则反之[15]。结合前述研究背景,提出假说,生理性IFN-γ对血管发育具有促进作用,而在病理状态下,炎性IFN-γ可通过抑制血管的生长而达到控制病灶发展的作用。
IFN-γ作为促炎细胞因子,具有抗病毒、免疫调节及抗肿瘤等特性。在肿瘤研究中IFN-γ起抑制血管生长的作用,而也有其他研究报道IFN-γ促血管生成的作用。本研究显示,下调斑马鱼IFN-γ受体crfb17后,斑马鱼脑血管和躯干血管的发育受到明显抑制,提示内源性IFN-γ对斑马鱼血管发育中的促进作用。该研究首次通过在体实验表明内源性IFN-γ在血管发育阶段对血管生成的促进作用,期待后续进一步的在体实验来证明内源性IFN-γ对血管生长的调节作用。
