乳源六肽增加人卵巢癌细胞对顺铂的敏感性
2018-09-05汪慎燚韦文美秦宜德
徐 恰,阮 昕,汪慎燚,席 浩,韦文美,2,秦宜德
卵巢癌致死率高,早期症状不典型,组织类型和良恶性难以诊断,因此女性卵巢癌患者的治愈率较低[1-3]。以铂类和紫杉醇为主的临床化疗治疗药物耐药性的产生[4],抑制了患者对化疗药物的敏感性,治疗效果达不到理想效果。所以,提高卵巢癌细胞对化疗药物的敏感性,防止耐药性的发生,增强疗效对卵巢癌治疗具有重要意义。文献[5-6]表明,除修复交叉互补基因1(excision repair cross complementing1,ERCC1)表达量多少与卵巢癌耐药性有关联,其过表达可降低铂类化疗药物的治疗效果,ERCC1在人卵巢癌耐药细胞株COC1/DDP中的表达量较高。乳源六肽是一组来源于牛乳β-酪蛋白的短肽,其氨基酸序列为Pro-Gly-Pro-Ile-Pro-Asn。前期研究[7-11]表明,PGPIPN可以抑制人卵巢癌细胞SKOV3和SKOV3/DDP的生长和增殖,但效果不及目前正在使用的抗癌药DDP和紫杉醇等。该研究通过不同浓度的PGPIPN联合DDP,研究对人卵巢癌敏感细胞株COC1和耐药细胞株COC1/DDP增殖和凋亡的影响,并讨论其可能的机制,为开发治疗卵巢癌的新方案和治疗新药提供基础。
1 材料与方法
1.1材料人卵巢癌敏感细胞株COC1和耐药细胞株COC1/DDP购自中科院细胞所的细胞库;RPMI-1640(美国Gibico公司);PGPIPN(上海楚肽生物科技有限公司);胎牛血清(浙江天杭生物技术公司);顺铂注射液(山东齐鲁制药有限公司);流式凋亡试剂盒(上海贝博公司);CCK8(江苏碧云天生物技术有限公司);β-actin鼠抗人抗体(北京中衫金桥生物技术有限公司);ERCC1兔抗人抗体(美国Abcam公司);Reverse Trsnscription System(日本TaKaRa公司);DMSO(北京Solarbio科技有限公司);TRIzol(美国Thermo Fisher公司)。
1.2方法
1.2.1卵巢癌细胞株的培养 细胞的培养均用RPMI-1640培养基(含双抗),10%胎牛血清,培养在37 ℃、5% CO2的培养箱中。在维持COC1/DDP细胞良好生长的前提下,逐步用0.1~0.6 μg/ml的DDP进行刺激。
1.2.2CCK8法测定DDP的半数抑制浓度(IC50) 取对数生长期细胞, 制成细胞悬液, 接种至96孔板, 37 ℃、5% CO2条件下培养过夜, 每孔加入不同浓度的DDP继续培养24、48、72 h。每孔加入10 μl CCK8溶液继续在培养箱内孵育1 h。用酶联免疫检测仪在450 nm处测定各孔吸光度 (optical density, OD) 值。实验重复3次。根据各组中各孔OD平均值, 计算细胞增殖抑制率和IC50值。
1.2.3细胞生长增殖的测定 CCK8法测定细胞的成活,检查药物对卵巢癌细胞增殖的抑制。细胞培养实验分为阴性对照组、DDP组、PGPIPN组、DDP和低剂量肽联合组、DDP和中剂量肽联合组、DDP和高剂量肽联合组等6组,分别给与生理盐水、1×10-4g/L PGPIPN、DDP(IC50)、DDP(IC50)+1×10-6g/L PGPIPN、DDP (IC50)+1×10-4g/L PGPIPN、DDP(IC50)+1×10-2g/L PGPIPN干预。将COC1、COC1/DDP以适宜的细胞密度种于96孔板中,每孔100 μl,细胞培养箱中培育过夜。次日,细胞生长良好,弃培养基,每孔加入事先配好浓度的药物100 μl, 以等量完全培养基和相同浓度DDP组作为空白对照组和阳性对照组,每组各设置6个复孔,于培养箱中分别培育24、48、72 h。待到作用时间,每孔10 μl CCK8加入到每孔中,培养箱中孵育4 h,将酶标仪波长调整为450 nm,测定96孔板的OD值。细胞存活率(%)=(OD实验组/OD空白对照组)×100%。
1.2.4流式细胞术检测细胞凋亡 将COC1、COC1/DDP分别种于两个6孔板中,加不同浓度药物,培养48 h。收集细胞,1 000 r/min离心5 min, PBS润洗3次。每管加入300 μl Binding Buffer和4 μl Annexin V-FITC悬浮细胞, 4 ℃避光孵育15 min后加入7.5 μl PI, 2~8 ℃避光孵育5 min后立即在流式细胞仪上进行检测, 结果用Flowjo 7.6.1软件进行分析。
1.2.5RT-PCR检测ERCC1基因mRNA的表达 用Primer-Bank检索引物的序列,利用Primer 5.0软件设计β-actin,ERCC1的引物序列,送至上海生工生物公司合成。使用TRIzol试剂提取细胞RNA,用Reverse Trsnscription System试剂盒逆转录为cDNA,加入引物PCR扩增。使用TRIzol试剂提取细胞RNA,用Reverse Trsnscription System试剂盒逆转录为cDNA,加入引物PCR扩增。扩增产物用1.5%琼脂糖凝胶电泳检测,采集图像进行光密度扫描。引物序列见表1。
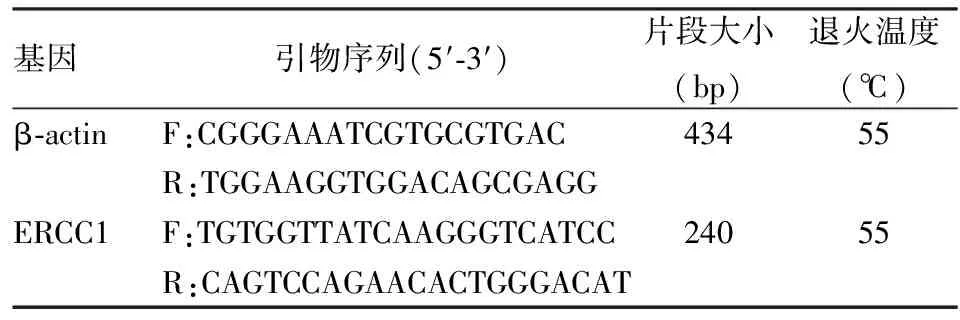
表1 β-actin、ERCC1引物序列、片段大小和退火温度
1.2.6Western blot检测 将COC1、COC1/DDP分别用不同浓度的药物(每个浓度药物设置3个复孔)刺激48 h后,BCA法对各组细胞蛋白进行定量10% SDS-PAGE凝胶电泳,250 mA、75 min转至PVDF膜上,5%脱脂奶粉室温封闭2 h,加入ERCC1、β-actin一抗4 ℃摇床过夜,加入二抗,室温孵育2 h,ECL发光显影。

2 结果
2.1联合用药对卵巢癌细胞增殖能力的影响根据从CCK8实验和GraphyPad Prism 5.0软件分析,经DDP作用后,COC1细胞的IC50值在24、48、72 h分别是(6.79×10-3±2.632)、(7.73×10-3±3.148)、(6.87×10-3±3.244 )g/L,而COC1/DDP细胞的IC50值在24、48、72 h分别是(15.37×10-3±4.873)、(17.82×10-3±5.019)、(16.51×10-3±4.639)g/L。
从联合用药的结果看,PGPIPN能显著促进DDP对COC1、COC1/DDP的增殖抑制,见图1。联合用药能显著提高卵巢癌细胞对DDP的敏感性,而且对PGPIPN具有计量依赖性。卵巢癌耐药细胞株COC1/DDP的增敏效果明显高于卵巢癌敏感细胞株COC1,与DDP组比较,差异有统计学意义,见图1。
2.2联合用药对卵巢癌细胞细胞凋亡的影响由CCK8结果可知,药物作用48 h对细胞抑制效果最佳,实验均选取48 h作为作用时间,用流式细胞仪进行凋亡检测,COC1组其DDP抑制细胞增殖的平均IC50值在48 h为(7.73×10-3±3.148) g/L,COC1/DDP组其DDP抑制细胞增殖的平均IC50值在48 h为(17.82×10-3±5.019) g/L。
结果可见,PGPIPN能显著促进DDP诱导COC1、COC1/DDP细胞凋亡,见图2。联合用药能显著提高卵巢癌细胞对DDP的敏感性, PGPIPN具有计量依赖性。卵巢癌耐药细胞株COC1/DDP的增敏效果明显高于卵巢癌DDP敏感细胞株COC1,与DDP组比较,差异有统计学意义 (FCOC1=104.491,P<0.05;FCOC1/DDP=375.810,P<0.05),见图2。

图1 DDP联合不同浓度PGPIPN对卵巢癌细胞株COC1、COC1/DDP增殖的影响
A:COC1;B:COC1/DDP;1:阴性对照组;2:DDP组;3:PGPIPN组;4:DDP和低剂量肽联合组;5:DDP和中剂量肽联合组;6:DDP和高剂量肽联合组;与DDP组比较:*P<0.05,**P<0.01
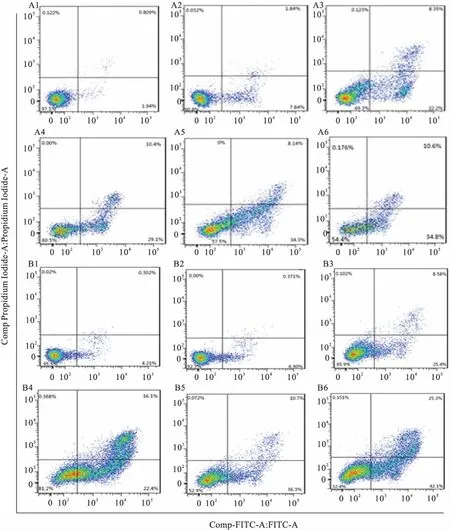
图2 DDP联合不同浓度PGPIPN对COC1、COC1/DDP凋亡的影响
A:COC1凋亡图;B:COC1/DDP凋亡图;1:阴性对照组;2:DDP组;3:PGPIPN组;4:DDP和低剂量肽联合组;5:DDP和中剂量肽联合组;6:DDP和高剂量肽联合组
2.3RT-PCR检测相关基因mRNA表达的变化由实验结果(图3)可知,耐药株COC1/DDP细胞ERCC1表达量比敏感株COC1细胞的高。同DDP组比较,联合用药组ERCC1的mRNA水平降低,作用效果随着PGPIPN用药浓度的增加而增强(FCOC1=279.601、FCOC1/DDP=136.033,P<0.05,P<0.01)。PGPIPN对ERCC1的mRNA抑制效果,卵巢癌耐药细胞株COC1/DDP明显高于卵巢癌DDP敏感细胞株COC1(只在高浓度的PGPIPN才显著降低mRNA水平)。

图3 RT-PCR检测COC1、COC1/DDP相关基因mRNA表达的变化
A:COC1的ERCC1基因RT-PCR的电泳图; B:COC1/DDP的ERCC1基因RT-PCR的电泳图; C: 基因ERCC1表达的mRNA相对定量统计图;M: Marker;1:阴性对照组; 2:DDP组;3:PGPIPN组;4:DDP和低剂量肽联合组;5:DDP和中剂量肽联合组;6:DDP和高剂量肽联合组;与DDP组比较:*P<0.05,**P<0.01
2.4Westernblot检测相关蛋白表达的变化DDP联合不同浓度PGPIPN作用于COC1/DDP和COC1细胞后,ERCC1蛋白明显降低,见图4。同DDP组比较,联合用药下,耐药细胞株COC1/DDP的ERCC1水平显著降低,作用效果随着PGPIPN用药浓度的增加而增强(FCOC1=73.269,P<0.05,P<0.01);而对敏感细胞株COC1,在高浓度的PGPIPN下也能显著降低ERCC1的水平(FCOC1/DDP=97.431,P<0.05)。从结果看,PGPIPN对ERCC1的抑制,卵巢癌耐药细胞株COC1/DDP明显高于敏感细胞株COC1。PGPIPN对ERCC1蛋白的抑制规律与抑制该基因mRNA相一致。

图4 Western blot检测COC1和COC1/DDP相关蛋白表达的变化
A:COC1的ERCC1蛋白的Western blot的电泳图; B:COC1/DDP的ERCC1蛋白的Western blot的电泳图; C: ERCC1蛋白相对定量统计图,1:阴性对照组;2:DDP组;3:PGPIPN组;4:DDP和低剂量肽联合组;5:DDP和中剂量肽联合组;6:DDP和高剂量肽联合组;与DDP组比较:*P<0.05,**P<0.01
3 讨论
卵巢恶性肿瘤在临床上的主要医治措施是早发现和早期切除。目前的治疗难题是卵巢癌较易转移至机体的其他部位,患者手术后容易再次病发,因而,如何控制复发和转移是卵巢癌治疗的热点。加上患者化疗耐药的影响,进一步降低了卵巢癌治愈率。铂类如顺铂是治疗卵巢癌常用的化疗药物,但是很多患者出现了耐药的现象。因此,如若能摸索出卵巢癌化疗耐药的分子机制,提高化疗敏感性和逆转耐药性,对其治疗非常有意义。
近年来有很多关于ERCC1与卵巢癌耐药直接关系的研究。研究[12-14]已表明,接受过顺铂化疗药物的患者中,ERCC1呈高剂量表达。所以,若能干扰ERCC1基因的表达,便能实现增加卵巢癌对化疗药物的敏感性,达到治疗卵巢癌治愈的目的。ERCC1的高表达可以修复癌细胞中受损伤的DNA分子,增加存活的癌细胞,从而产生耐药。PGPIPN能显著促进腹腔巨噬细胞吞噬活性和红细胞免疫,前期研究显示PGPIPN能通过某些信号传导途径诱导肿瘤细胞凋亡,提高卵巢癌细胞对DDP的敏感性。可能的机制是抑制抑制由顺铂等引起的卵巢癌细胞抗凋亡蛋白过表达,增加肿瘤细胞对DDP的敏感性。
PGPIPN作为一种抗癌活性肽,副作用低,对正常人体细胞几乎无损伤,在未来的临床应用中将具有广阔的应用前景。
