DMOG对人牙周膜干细胞成骨分化和成血管能力影响的体外研究
2018-09-05李汉青何家才
张 璐,许 敏,李汉青,王 芳,何家才
目前由于严重的创伤、炎症、肿瘤切除等因素导致的颌骨缺损的治疗面临巨大挑战,而自体骨和异体骨在临床应用受限,运用基因工程技术修复骨缺损成为当前研究热点[1]。低氧诱导因子-1α(hypoxia-inducible-1α,HIF-1α)是一种低氧条件下被激活的转录因子,能调控细胞的增殖、分化和多种基因的表达,但常氧下易降解[2]。有研究[3]证实HIF-1α基因转染的骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)具有更好的成骨成血管能力,改善骨的修复与再生,然而其潜在风险阻碍了临床应用。二甲氧已二酰甘氨酸(dimethyloxalylglycine,DMOG)是人工合成的小分子脯氨酰羟化酶抑制剂,能够稳定常氧下HIF-1α的表达[4],因此作为一种新的替代方案,有希望安全应用于临床。鉴于此,该实验运用DMOG探讨其对人牙周膜干细胞(human periodontal ligament stem cells,hPDLSCs)体外成骨分化和成血管能力的影响。
1 材料与方法
1.1主要试剂和仪器DMEM培养基(美国Gibco公司);胎牛血清(FBS)(浙江天航生物科技有限公司);胰酶消化液、RIPA 裂解液、蛋白浓度测定试剂盒、BCIP/NBT碱性磷酸酯酶试剂盒(上海碧云天生物技术有限公司);PBS缓冲剂(美国Solarbio公司);DMOG(美国Selleck公司);PCR引物(上海生物工程股份有限公司);逆转录试剂盒、RT-PCR试剂盒(日本TaKaRa公司);茜素红(美国Sigma公司);HIF-1α兔单克隆抗体(美国CST公司);血管内皮生长因子(vascular endothelial growth factor,VEGF)小鼠单克隆抗体(美国Santa Cruz公司),山羊抗鼠/兔二抗(北京中杉金桥公司);PVDF 膜(美国Invitrogen公司);CO2恒温孵箱(美国Thermo公司);荧光倒置显微镜(德国Leica公司);实时荧光定量PCR仪(美国Stratagene公司);酶标仪(美国Bio-tek公司)。
1.2方法
1.2.1hPDLSCs体外分离培养 收集12~28岁因正畸减数需要拔除的牙体牙周均健康的前磨牙,在超净工作台内,无菌条件下,将牙齿牙冠向下用含3倍双抗的PBS反复冲洗。用无菌刀片刮取牙根中三分之一的牙周膜组织,剪成约1 mm3的小块,以5 mm间隔铺于6孔板皿底,加入少量DMEM培养液(含20% FBS、100 U/ml青霉素和100 μg/ml链霉素),放入37 ℃、5% CO2培养箱,4~6 h待组织块贴壁,加入上述DMEM培养液2 ml。每3~5 d换液,7~15 d左右当细胞从组织块周围爬出并达孔底60%左右时,用0.25%胰酶消化传代。
1.2.2流式细胞术检测hPDLSCs表面标志物 取第3代hPDLSCs,0.25%胰酶消化,PBS洗3遍,调整密度为4×106/ml的单细胞悬液,分装到EP管中,每管0.2 ml。分别加入CD34-FITC、CD44-FITC、CD45-FITC、CD90-APC、CD105-PE、CD146-PE抗体和阴性对照,4 ℃避光孵育60 min,PBS洗3遍后重悬,用流式细胞仪检测。
1.2.3MTT法检测hPDLSCs增殖能力与细胞活力 取对数生长期的hPDLSCs,以4×103/孔的密度接种于96孔板,次日细胞贴壁后,加入不同浓度的DMOG(0、0.1、1、10、100 μmol/L)。于37 ℃、5% CO2培养箱中分别培养24、48、72 h,弃上清液,每孔加入100 μl标准培养基(不含血清的DMEM培养基)和20 μl浓度5 g/L的MTT,37 ℃避光孵育4 h,弃孔内上清液,每孔加入150 μl的DMSO溶液,待甲臜充分溶解后,在酶标仪上测定490 nm处的吸光度值,每组设5个复孔。
1.2.4Western blot检测 取对数生长期的hPDLSCs,以1×105/孔的密度接种于6孔板,待细胞贴壁至皿底80%,加入不同浓度的DMOG(0、0.1、1、10、100 μmol/L),分别于12、24、72 h后,提取各组细胞总蛋白。BCA测定试剂盒测定各组蛋白浓度,调整各组浓度一致,99 ℃、10 min使蛋白变性,10% SDS-PAGE凝胶电泳,然后转移到0.45 μm的PVDF膜上,5%BSA封闭液室温下封闭1 h,分别加抗HIF-1α(1 ∶1 000)、抗VEGF(1 ∶800)、抗β-actin(1 ∶1 000),4 ℃孵育过夜,相应二抗1 ∶5 000室温孵育1 h,经ECL曝光成像。
1.2.5RT-PCR检测 取对数生长期的hPDLSCs,以1×105/孔的密度接种于6孔板,待细胞贴壁,实验组加入不同浓度的DMOG(0、0.1、1、10、100 μmol/L),分别于1、3、7、14 d提取细胞总RNA,进行RT-PCR定量检测核心结合因子2(Runt-related transcription factor 2 ,RUNX2)、碱性磷酸酶(alkaline phosphatase,ALP)、骨钙素(osteocalin,OCN)、VEGF基因表达水平。按TRIzol试剂盒说明书提取各组细胞总RNA,使用PrimeScriptTM-PCR kit逆转录试剂盒合成cDNA,以此为模板,用目的基因的引物进行扩增和检测。每个样品设置3个复孔,PCR所有引物由上海生工生物工程公司设计合成,引物序列见表1。
1.2.6ALP染色 取对数生长期的hPDLSCs,以5×104/孔的密度接种于12孔板,次日更换为不同浓度DMOG的成骨诱导分化培养基,每3 d换液,分别于成骨诱导培养14 d后,加入One-StepTMNBT/BCIP溶液(PIERCE)染色,拍照。
1.2.7茜素红染色 同1.2.6方法培养细胞,14 d时弃培养基,4%多聚甲醛固定30 min,蒸馏水洗3次,2%茜素红染液染色30 min,双蒸水冲洗,观察拍照,每孔加入0.5 ml 10%的氯化十六烷基吡啶,室温下待结节完全溶解,吸取上清液,在酶标仪上测定562 nm处的吸光度值。

表1 引物序列

2 结果
2.1hPDLSCs体外分离培养与鉴定采用组织块法分离培养hPDLSCs,约7~15 d可观察到有细胞从组织块周围爬出,细胞多呈长梭形并呈放射状排列,见图1。流式细胞术检测结果显示,hPDLSCs表面抗原CD44、CD90、CD105、CD146呈阳性,CD34、CD45呈阴性,见图2。
图1 hPDLSCs体外培养 ×100

图2 流式细胞术检测细胞表面标志物

图3 MTT法检测DMOG对hPDLSCs增值能力和细胞活力的影响
2.2DMOG对hPDLSCs增值能力和细胞活力的影响MTT结果显示:在基础培养基中,与空白对照组比较,培养72 h,0.1、1、10、100 μmol/L的DMOG组对hPDLSCs的增殖有明显抑制作用,差异有统计学意义(F=103.991,P<0.05),且这种抑制具有剂量依赖性(P<0.05)。在缺血清培养基中,与空白对照组比较,培养72 h,0.1、1、10 μmol/L的DMOG 组hPDLSCs的细胞活性明显提高,差异有统计学意义(F=10.722,P<0.05),100 μmol/L的DMOG组无明显差异,表明缺血清条件下,一定浓度范围的DMOG对hPDLSCs的细胞活力具有保护作用,见图3。
2.3Westernblot检测HIF-1α和VEGF蛋白水平的表达Western blot结果显示:空白对照组HIF-1α和VEGF蛋白表达水平较低,在DMOG的作用下,表达水平明显增加,见图4。

图4 Western blot检测HIF-1α和VEGF蛋白水平的表达
1:0 μmol/L组;2:0.1 μmol/L组;3:1 μmol/L组;4:10 μmol/L组;5:100 μmol/L组
2.4DMOG对hPDLSCs成骨分化和成血管相关基因表达的影响RT-PCR分别检测1、3、7、14 d成骨成血管相关基因Runx2、ALP、OCN、VEGF的相对表达水平。结果表明:与空白对照组比较,DMOG处理的hPDLSCs在3~14 d时Runx2的表达水平缓慢增加(F=9.129、38.657、1 802.759,P<0.05);ALP和OCN在14 d时基因表达水平明显增加,其中10 μmol/L的DMOG组ALP、OCN基因相对于空白对照组表达分别为(6.597±0.682)(F=68.527,P<0.05)、(2.956±0.0425)(F=913.618,P<0.05),而100 μmol/L的DMOG组成骨相关基因表达水平较低,差异有统计学意义(P<0.05);VEGF在1 d时表达水平明显增加并持续到14 d,且100 μmol/L的DMOG组表达水平最高(F=33.487,P<0.05),见图5。
2.5ALP染色及茜素红染色成骨诱导培养14 d,ALP染色结果显示:与空白对照组比较, 0.1、1、10 μmol/L的DMOG组ALP活性明显增高,100 μmol/L的DMOG组明显降低;茜素红染色结果显示:与空白对照组比较,0.1 μmol/L的DMOG组无明显差异,1、10 μmol/L的DMOG组钙结节生成量明显增多,半定量分析显示分别为空白对照组的1.6倍和2.1倍,100 μmol/L的DMOG组较空白对照组钙结节生成明显减少,差异有统计学意义(F=317.612,P<0.05),见图6、7。
3 讨论
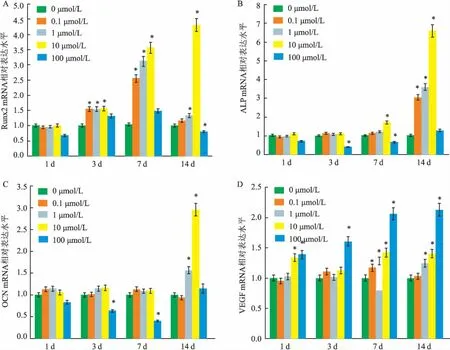
图5 RT-PCR检测成骨分化和成血管相关基因表达

图6 ALP染色及茜素红染色A:ALP染色;B:茜素红染色
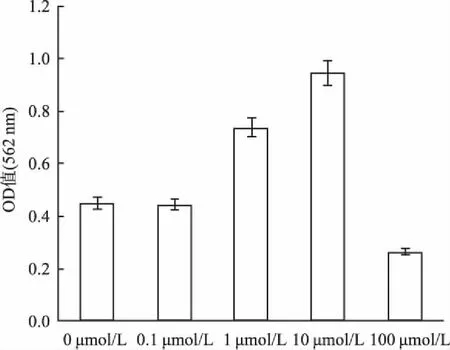
图7 茜素红染色的半定量分析
Seo et al[5]首次从人的牙周膜组织中成功分离出hPDLSCs,因具有多向分化潜能和克隆形成能力,成为牙周再生最理想的种子细胞。近年来随着研究的深入,hPDLSCs在骨修复再生、神经损伤修复等方面有了突破性进展[6-7],与BMSCs比较,避免骨穿带来的损伤和痛苦,临床操作方便,使hPDLSCs在组织工程技术中拥有巨大的运用前景。本实验采用组织块法分离培养hPDLSCs,流式细胞术检测结果显示间充质干细胞表面抗原CD44、CD90、CD105表达为高度阳性,造血干细胞表面抗原的CD34、CD45为高度阴性,这表明所培养的细胞符合成体干细胞的特性,为后续实验奠定了基础。
HIF-1α是一个对氧分子敏感的复合体,在正常氧分压下,HIF-1α亚基被脯氨酰羟化酶(prolylhydroxylase,PHD)羟基化而降解;在低氧条件下,PHD被抑制,HIF-1α与HIF-1β结合形成复合体,激活下游近百种靶基因的表达,调节细胞的增殖、分化等活动[8],而且HIF-1α可以诱导VEGF高表达,VEGF促进新血管形成,进而为骨缺损区输送大量与成骨相关的生长因子,增加骨修复与再生能力[9]。DMOG作为一种小分子酮戊二酸类似物, 通过与内源性的2-酮戊二酸竞争从而抑制PHD,稳定HIF-1α表达,已被证实DMOG具有神经保护、能促进缺血疾病的血管再生和促进间充质干细胞的成骨分化作用[10-12]。本实验给予不同浓度DMOG处理hPDLSCs,探索DMOG对hPDLSCs成骨分化和成血管能力的影响。MTT结果显示DMOG对hPDLSCs缺血清损伤具有保护作用,且10 μmol/L的DMOG作用最显著。有研究[13]显示,90%的间充质干细胞在移植体内的第1天死亡只有少数能存活,因此可以认为DMOG 可能提高hPDLSCs在体内移植部位的存活率。Western blot检测结果显示,常氧状态下,HIF-1α易降解,对照组表达较低,DMOG处理组明显增加,表明DMOG 能有效地抑制HIF-1α的降解,使其在细胞内稳定表达;VEGF表达也显著增加,且具有浓度依赖性,VEGF缓慢持续释放被认为是新骨血管形成的关键[14],因此,DMOG能通过提高hPDLSCs成血管能力间接改善骨修复能力。间充质干细胞成骨分化始于前体成骨细胞,进而分化为成熟的成骨细胞,研究[15]显示,Runx2是间充质干细胞成骨分化的关键因子,能调节间充质干细胞向前体成骨细胞分化过程中所必须的非胶原蛋白(如OCN),也是骨形成过程中最早和最具特异性的标志基因;ALP是成骨细胞分化的早期标志物,并参与成骨细胞的钙盐沉积。因此,本实验通过检测Runx2、ALP、OCN的表达来探索hPDLSCs的成骨分化,RT-PCR结果显示随着DMOG浓度的提高hPDLSCs的成骨分化能力逐渐增加,10 μmol/L时增加最显著,但当浓度达到100 μmol/L时,成骨分化能力明显被抑制,与ALP染色和茜素红染色结果相一致,这可能与DMOG显著抑制细胞增殖有关,具体机制仍需进一步探究。
