美洲大蠊提取物对大鼠皮肤创伤修复机制探讨
2018-09-05翟素珍邰胜燕肖永珊张春林
魏 操,翟素珍,邰胜燕,肖永珊,张春林
创伤修复一直是医学外科领域里面临的最基本最重要的问题之一。随着中草药在创面愈合中的作用越来越重要[1],美洲大蠊(PeriplanetaAmericanaL.)为蜚蠊目蜚蠊科(BlattidaeHandlirsch)大蠊属(Periplaneta)昆虫,其药用可追溯到《神农本草经》,基于美洲大蠊提取物具有抗肿瘤、抗衰老、保肝、强心、修复溃疡创面等功效,该药对创面修复的临床疗效良好并得到验证[2],但仍存在如蟑螂药用活性成分不明、药理机制不清楚等诸多问题。鉴于此,该研究建立了大鼠皮肤切创模型,观察美洲大蠊粗提物(PeriplanetaAmericanaextract,PAE)对创口愈合过程中的作用,检测血管内皮生长因子(vascular endothelial growth factor,VEGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)和CD68的表达,旨在观察PAE促进创伤修复及其药理作用的机制。
1 材料与方法
1.1主要试剂与仪器HE、Cy-3染色试剂盒(北京索莱宝公司);CD68抗体(英国Abcam公司);VEGF抗体(武汉Boster公司);bFGF抗体(美国Immunaly公司);β-actin一抗和羊抗兔二抗(北京博奥森公司);正置荧光显微镜(日本Nikon公司);石蜡切片机(德国LEICA公司); DK-8D型电热恒温水槽(上海一恒科学仪器有限公司);旋转蒸发仪(上海亚荣公司);DYCP-40E型电泳仪(北京六一仪器厂);蛋白电泳仪(北京百晶生物技术有限公司);凝胶图像处理系统(美国伯乐公司);Bullet Blender组织细胞破碎仪(北京海德创业生物科技有限公司);京万红药膏(天津药业有限公司),批准文号:国药准字Z12020440。
1.2实验动物选用SPF级SD大鼠60只,雌雄各半,体质量 (200±20)g,饲养温度22 ℃,湿度55%~65%,由陆军医学院附属大坪医院实验动物中心提供。
1.3PAE的制备[3]称美洲大蠊100 g,粉碎成粗粉,于50 ℃下烘干,用85%乙醇4 ℃浸泡过夜,依次加7、5、3倍量85%乙醇于60 ℃浸泡2、1.5、1 h,合并3次提取液,趁热过滤,减压回收乙醇至粘稠膏状,再加入1 L温热的蒸馏水,搅拌、静置,于 4 ℃过夜,除去上层油状物。剩余水溶液加入石油醚萃取,静置,取下层水溶液及沉淀,浓缩成稠膏,冷冻干燥得浸膏。
1.4实验方法
1.4.1动物分组 将SPF级SD大鼠60只随机分为5组:模型组12只,京万红组12只,PAE高、中、低组各12只。
1.4.2动物模型的制备 动物模型制备参照文献[4]。大鼠常规饲养3 d后,7.2%水合氯醛(0.5 ml/100 g)腹腔注射麻醉成功后,备皮,75%的酒精局部消毒手术区,于耳连线中间向下4 cm背部近颈侧以脊柱为中线位制作1.5 cm×1.5 cm全层皮肤创口,深至肌层,形成机械损伤动物模型。
1.4.3给药方法 PAE高中低剂量组分别外涂PAE 250、125、62.5 mg/(g·d);京万红治疗组外涂京万红药膏0.1 g/d;模型组常规饲养,不作任何处理。其余4组每日定时局部涂抹给药1次,持续给药14 d。
1.5观察指标及检测方法
1.5.1创面大体观察 建模后肉眼观察创面有无红肿、渗液及感染,创口收缩和表面结痂的情况。
1.5.2创面愈合率 分别在建模后的第3、7、14天摄取每组大鼠的创面图像,采用图像分析软件(Image J)计算创面面积,得出创面愈合率。
1.5.3病理组织学观察 从4%多聚甲醛固定液取出组织快,自来水冲洗3~4 h,行常规脱水、包埋、切片(厚约5~6 μm)、染色、封片,光镜下观察肉芽组织、毛囊、血管的生成情况,评价创面愈合质量。
1.5.4免疫荧光检测巨噬细胞CD68的表达 参照1.5.3方法行常规脱水包埋后,PBS洗涤3次,热抗原修复30 min,山羊血清(PBS稀释)封闭30 min,滴加稀释的CD68(1 ∶100)一抗4 ℃孵育过夜,洗涤3次,依次滴加荧光二抗和DAPI显色剂,孵育30 min, 最后抗荧光衰减剂封片,荧光镜观察拍片,统计分析。
1.5.5Western blot法检测VEGF、bFGF蛋白表达 经研磨后总蛋白经SDS-PAGE(10%)电泳,将蛋白转至PVDF膜,5%脱脂奶粉封闭2 h,滴加VEGF、bFGF一抗4 ℃孵育过夜,TBST洗涤3次,滴加二抗温育2 h,曝光、显影。Image J软件对蛋白条带结果进行光密度分析,内参对照采用β-actin。
1.6统计学处理使用SPSS 17.0软件进行分析,采用单因素方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1各组大鼠不同时间点肉眼观察结果建模后第3天,模型组创口稍红肿、少许渗液,边缘皮肤开始褶皱。京万红组和PAE高、中、低各组创口干净,创面被一层暗红色新生薄皮覆盖,创口边缘皮肤收缩褶皱明显。建模后第7天,模型组创面边缘缩小不明显,创面被一层暗红色薄皮覆盖未结痂。京万红组和PAE高、中、低各组创面收缩明显,创面痂皮较厚并覆盖整个创面。建模后第14天,模型组创口明显缩小被肉芽组织填充。京万红组和PAE高、中、低各组创面痂皮脱落,被新生表皮覆盖,瘢痕暗红。见图1。
2.2创面愈合率比较建模第0天各组创面面积比较,模型组(3.43±0.25) cm2、京万红组(3.57±0.29) cm2、PAE高(3.31±0.29) cm2、中(3.64±0.30) cm2、低(3.65±0.27) cm2组之间差异无统计学意义(F=2.381,P>0.05)。见图2。治疗后第3、7天,京万红组和PAE高、中、低组的创面愈合率均高于模型组,差异有统计学意义(F=11.064,P<0.05),治疗后第7天,PAE高中低组间比较, PAE中组愈合率高于PAE低组,差异有统计学意义(F=20.035,P<0.05);第14天,与模型组比较,京万红组和PAE中组差异有统计学意义(F=14.168,P<0.05)。见图3、表1。

表1 创面愈合过程中各组创面愈合率的比较
与模型组比较:*P<0.05;与PAE中组比较:#P<0.05
2.3HE染色结果与模型组比较,光镜结果显示,治疗后第3天,PAE中组可见新生毛细血管,成纤维细胞、汗腺细胞增生;治疗后第7天,模型组炎细胞浸润仍较明显,成纤维细胞和新生血管数量较之前增多,PAE中组可见大量新生血管和成纤维细胞,少量炎细胞浸润,上皮细胞增生明显,密集汗腺细胞,导管内径增大;治疗后第14天,模型组成纤维细胞增生明显,肉芽组织形成,上皮细胞增生明显,胶原纤维排列紊乱, PAE中组肉芽组织形成明显,胶原纤维成纵行排列整齐,汗腺细胞和导管大量增生,排列整齐,毛囊较多。见图4。

图1 建模后各组创面愈合情况

图2 各组皮肤创面初始面积比较
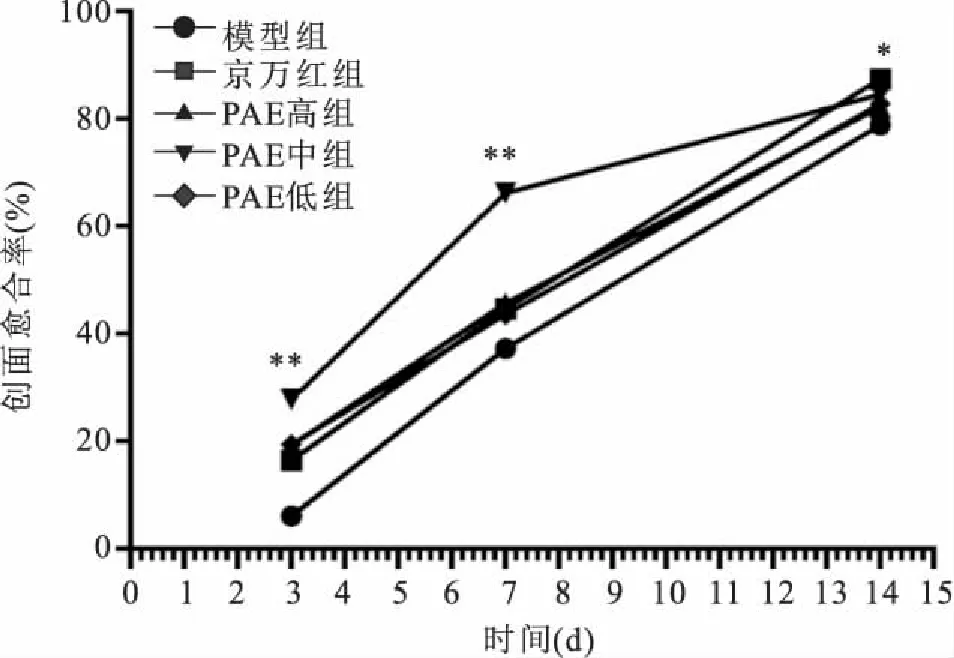
图3 各组不同时间点大鼠皮肤创愈合率比较
2.4胶原纤维染色结果Masson染色结果见图5~6,治疗后第3天,与模型组比较,京万红组和 PAE中组胶原纤维增加更明显,差异有统计学意义(F=37.239,P<0.01);治疗后第7天,PAE高组和PAE低组均高于模型组,差异有统计学意义(F=36.802,P<0.01)。PAE高中低组间比较,与PAE低组比较,PAE高组、PAE中组差异有统计学意义(F=20.247,P<0.05);第14天,与模型组比较,京万红组、PAE高组和PAE低组均减少,差异有统计意义(F=16.231,P<0.05);PAE中组的胶原纤维明显减少,差异有统计学意义(F=27.147,P<0.01);PAE高中低组间比较, PAE中组均显著少于PAE高组和PAE低组,差异有统计学意义(F=9.663,P<0.05)。

图4 创伤后第3、7、14天各组HE染色图 ×200
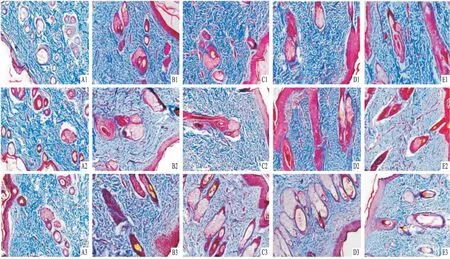
图5 创伤后第3、7、14天各组胶原纤维染色图 ×200
2.5创面肉芽组织中巨噬细胞的变化与模型组比较,第3、7天,京万红组和PAE高中低组中CD68阳性细胞数增加,PAE中组增加最明显;第14天,京万红组和PAE高中低组的CD68阳性细胞数减少,PAE中组减少更明显。见图7。
2.6创伤愈合过程中VEGF、bFGF蛋白的表达变化
2.6.1VEGF蛋白表达变化 治疗后第3天,与模型组比较,PAE 高组和PAE低组VEGF增加,差异有统计学意义(F=11.150,P<0.05);京万红组和PAE中组VEGF表达明显增高,差异有统计学意义(F=13.681,P<0.01);PAE高中低组之间比较, PAE中组VEGF均高于PAE高组和PAE低组,差异有统计学意义(F=18.520,P<0.05)。治疗后第7天,京万红组和PAE中组高于模型组,差异有统计学意义(F=10.120,P<0.05);PAE中组VEGF均高于PAE高组和PAE低组,差异有统计学意义(F=11.214,P<0.05)。第14天,PAE中组VEGF的表达量减少,差异有统计学意义(F=14.517,P<0.05)。见图8。
2.6.2bFGF蛋白表达变化 治疗后第3、7天,与模型组比较,京万红组和 PAE中组bFGF表达量增加,差异有统计学意义(F=22.353,P<0.05;F=9.960,P<0.05);PAE各组之间比较,与PAE低组比较, PAE中组bFGF表达量增加,差异有统计学意义(F=36.461、12.660,P<0.05);治疗后第14天,与模型组比较,PAE中组bFGF表达减少,差异有统计学意义(F=3.739,P<0.05)。见图9。

图6 创伤后第3、7、14天各组胶原纤维光密度值比较
与模型组比较:*P<0.05,**P<0.01;与PAE高、低组比较:#P<0.05

图7 创伤后第3、7、14天各组CD68阳性细胞数量比较 ×200
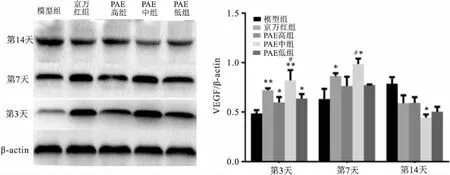
图8 创伤后第3、7、14天各组VEGF光密度值比较

图9 创伤后第3、7、14天各组bFGF光密度值比较
3 讨论
创伤修复是指在外伤或疾病的过程中,造成组织缺损后局部组织通过增生或再生方式进行修补的一系列复杂的病理生理过程。通常,创伤愈合率、病理组织分析是直接而有效的创面愈合的评价指标。通过观察创面愈合率、HE染色结果和胶原纤维染色结果,证实PAE治疗组创面修复的质量和速率较模型组优越,说明PAE能更好的促进创面修复。
CD68是巨噬细胞膜表面分子,是检测巨噬细胞存在的标志。Brochhausen et al[5]在实验中阐明在创伤炎症阶段CD68高表达通过吞噬病原体和分泌多种酶降解细胞外基质减轻炎症反应,在增殖阶段,大量CD68分泌细胞生长因子和趋化因子诱导组织的增生。Venosa et al[6]在实验中指出在增殖期肺损伤和修复与M2型(抗炎)巨噬细胞的积累有关,本实验结果与之一致。说明在创伤早中期CD68的高表达可能与巨噬细胞分化成M1型:通过吞噬作用减轻创面的炎症反应,同时也分化成M2型:分泌更多细胞因子促进肉芽组织生长有关,这点在牛轶雯 等[7]实验结果中已证实,创伤后期CD68低表达可能通过信号通路抑制CD68分泌更多的细胞因子防止创面肉芽组织过度生长形成瘢痕疙瘩。
VEGF是高度特异性促进血管内皮细胞生长因子,bFGF是来源于单核巨噬细胞或淋巴细胞的生长因子,卞明心 等[8]和Zhang et al[9]的实验中明确指出在创伤修复的早中期阶段通过刺激VEGF的表达促进新生毛细血管形成。Zhao et al[10]实验中发现通过增加bFGF表达加速细胞增殖促进创伤愈合,Lin et al[11]实验中发现通过下调VEGF和MMPS蛋白的表达来抑制肺癌细胞的生长。Akasaka et al[12]发现在创伤修复早期,细胞增殖超过细胞凋亡。因能促进肉芽组织形成,在创伤后期,细胞凋亡增加因使肉芽成长抑制,本实验结果与之一致。创伤早中期, VEGF、bFGF蛋白的高表达可能使创面快速地从炎症阶段过度到肉芽组织增生阶段,加速创面的成纤维细胞、毛细血管和细胞外基质快速生长,创伤后期, VEGF、bFGF蛋白明显下调,可能通过胶原纤维的合成与分解使胶原蛋白含量在新生的血管结缔组织中达到相对平衡,有效减少创面瘢痕的形成。
综上所述,PAE中组能更好地提高创面愈合速率,促进胶原沉积,毛细血管新生,成纤维细胞迁移和肉芽组织形成的作用,其药理机制可能与创伤修复不同阶段CD68分化和VEGF、bFGF表达有关,为进一步研究奠定基础。
