一种低成本的逆转录病毒感染白血病细胞的方法探析
2018-09-04张慧娟江丽霞钟田雨
张慧娟,张 伶,胡 蓉,江丽霞,钟田雨
对于中小城市的科研实验室来说,科研经费严重不足,科研设备不齐全。一旦涉及基础研究如载体构建,科研人员只有去花一笔不菲的费用去公司购买载体。该研究采用低成本的磷酸钙转染试剂进行逆转录病毒的包装,并用病毒原液成功感染悬浮细胞—KG-1a白血病细胞,大大节省了科研费用,同时解决悬浮细胞难转染的问题,对于在一般科研条件下做基础研究的科研人员,具有很大的参考价值。
1 材料与方法
1.1主要试剂磷酸钙转染试剂的配制:2 mol/L CaCl2(将29.4 g CaCl2溶于100 ml水,过滤后备用)和2×HBSS(将3.273 g NaCl2、0.149 g KCl、0.043 g Na2HPO4、0.43 g无水葡萄糖、2.338 g HEPES溶于180 ml的水,平均分至2瓶,分别调节pH至6.95和7.05,加水至100 ml,过滤后备用)。磷酸钙转染试剂、polybrene和嘌呤霉素均购自美国Sigma公司;RPMI 1640培养基和DMEM培养基购自美国Gibco公司;胎牛血清购自美国Hyclone公司。
1.2质粒、菌种和细胞培养MSCV-PIG(携带绿色荧光蛋白GFP)、Gag-pol、VSVG逆转录病毒载体由美国安德森实验室惠赠,pSES-HUS(携带红色荧光蛋白RFP)质粒、逆转录病毒包装细胞293T细胞、人白血病细胞株KG-1a由赣南医学院第一附属医院科研中心保存。在37 ℃、5% CO2的条件下用含10%的胎牛血清,青霉素(100 U/ml)、链霉素(100 U/ml)和L-谷氨酰胺(2 mol/L)的DMEM培养液培养293T细胞,RPMI 1640培养液培养KG-1a细胞。
1.3磷酸钙转染试剂最佳pH值选择将pSES-HUS 转染入293T细胞,将pH为6.95和pH为7.05的HBSS按1 ∶9、2 ∶8、3 ∶7……10 ∶0各配1 ml,转染时应用各种配比的HBSS,转染48 h后镜下观察细胞红色荧光表达强弱。
1.4逆转录病毒包装
1.4.1转染 准备好两个EP管:A管和B管。A管加入CaCl262.5 μl、MSCV-PIG 10 μg、Gag-pol 7.5 μg和VSVG 2.5 μg,振荡混匀。B 管为500 μl最佳pH的HBSS溶液。将B液加入A管:A管放在振荡器上,左手拿住A管的上端,右手将B液一滴一滴加入A管,该过程要持续1~2 min。加完样之后,会有细小的白色沉淀出现,静置30 min。将长在10 cm平皿融合度达60%的293T细胞去上清液,加入8 ml 高糖DMEM。将1 ml CaCl2-DNA-HBSS混合液均匀地一滴一滴滴入平皿, 轻轻混匀,放37 ℃、5% CO2培养箱孵育。6~8 h后换普通培养基。
1.4.2病毒原液收集和感染KG-1a细胞 转染48 h后收集293T细胞上清液,立即在平皿里加入10 ml DMEM培养基,继续培养293T细胞。病毒原液常温800 r/min离心5 min,用0.45 μm滤器过滤上清液以除去细胞碎片。再加入2 ml新鲜DMEM培养基,加入12 μl的polybrene,使polybrene终浓度为4 g/L,混匀。加入含KG-1a细胞的6孔板,2 ml/孔。用胶条封板,22 ℃、1 800 r/min,离心45 min后放入37 ℃、5% CO2培养箱。转染72 h后第二次收集病毒上清液,再次感染KG-1a细胞,步骤同上。

图1 不同pH值的HBSS溶液转染293T细胞后48 h荧光图和白光图 ×400
A、 F:pH 6.95与pH 7.05的HBSS溶液体积比为6 ∶4转染293T细胞后48 h荧光图和白光图;B、G:体积比为7 ∶3时的荧光图和白光图;C、H:体积比为8 ∶2时的荧光图和白光图;D、I:体积比为9 ∶1时的荧光图和白光图;E、J:体积比为10 ∶0时的荧光图和白光图
1.5KG-1a细胞稳筛病毒感染细胞3 d后,用含嘌呤霉素的RPMI 1640培养基换液,嘌呤霉素终浓度为2 g/L。稳筛出靶细胞后,将嘌呤霉素终浓度每2 d从2 g/L依次降为1.5、1、0.5、0 g/L。
2 结果
2.1获取磷酸钙转染法中HBSS溶液的最佳pH磷酸钙转染法中HBSS溶液的pH对转染效率有非常大的影响,为了获取最佳pH,本研究将pH 6.95和pH 7.05的HBSS溶液按不同比例混合,将携带红色荧光的pSES-HUS质粒转染至293T细胞,结果显示在pH 6.95与pH 7.05的HBSS溶液体积比在6 ∶4、7 ∶3、8 ∶2、9 ∶1和10 ∶0时镜下观察到明显的红色荧光,且pH 6.95与pH 7.05的HBSS溶液体积比值为8 ∶2时荧光最多,转染效率约为40%,表明此时为最佳转染pH。见图1。因此,将以此pH的HBSS做后续实验。
2.2逆转录病毒感染KG-1a细胞48h后荧光效率磷酸钙法将MSCV-PIG、Gag-pol和VSVG 逆转录病毒质粒共转染入293T细胞,转染48 h和72 h后分别收集病毒原液感染KG-1a细胞。感染48 h后KG-1a细胞荧光比较稀少和微弱,荧光感染效率约为10%,见图2。
2.3药物稳筛KG-1a细胞后的荧光效率逆转录病毒感染KG-1a细胞3 d后,加入2 g/L 嘌呤霉素进行稳筛,携带有MSCV-PIG逆转录病毒载体的KG-1a细胞具有抗嘌呤霉素抗性,能在药物筛选中存活。药物筛选后KG-1a细胞荧光增多,荧光变亮,其感染效率大于85%。见图3。

图2 逆转录病毒感染KG-1a细胞后48 h荧光图和白光图 ×400
A:逆转录病毒感染KG-1a细胞后48 h荧光图;B:逆转录病毒感染KG-1a细胞后48 h白光图

图3 嘌呤霉素筛选KG-1a细胞 ×400
A:加入2 g/L 嘌呤霉素筛选KG-1a细胞荧光图;B:加入2 g/L 嘌呤霉素筛选KG-1a细胞白光图
2.4病毒感染靶细胞中需要注意的问题Polybrene过量会杀死靶细胞,当加入8 g/L polybrene时,KG-1a细胞出现皱缩,胞内有细胞碎片,见图4A箭头所示;嘌呤霉素过量也会杀死靶细胞,当加入4 g/L嘌呤霉素时,细胞膜完全破碎,细胞碎片分散,只留下细胞影,见图4B箭头所示。
3 讨论
目前,基因干扰或过表达已经成为实验室研究基因功能的常规手段。无论是干扰或过表达,都需要质粒转染或病毒感染靶细胞。对于悬浮细胞,尤其是白血病细胞株,用质粒转染或腺病毒感染,其转染或感染效率都非常低,只有用逆转录病毒或慢病毒感染效果好。本研究通过磷酸钙转染方法获取逆转录病毒,采用病毒原液感染白血病细胞,并做稳筛,获取高感染率的目的细胞,在降低实验成本的同时也解决了悬浮细胞难转染的问题,为后续的实验研究奠定基础。
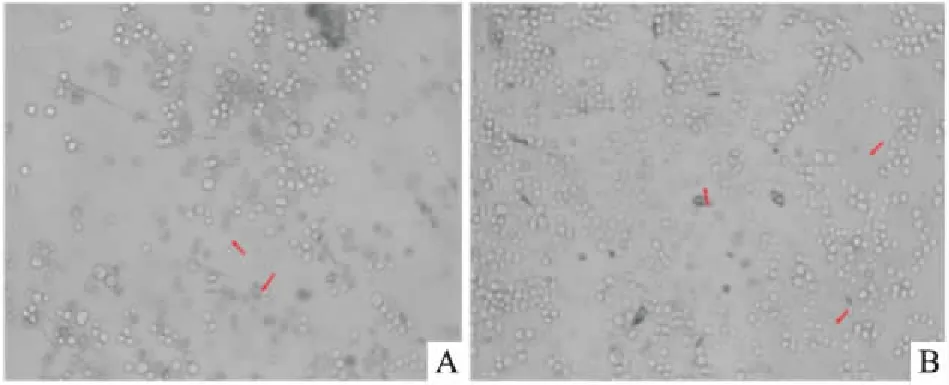
图4 polybrene或嘌呤霉素过量对KG-1a细胞的影响 ×400
A:加入8 g/L polybrene对KG-1a细胞的影响;B:加入4 g/L嘌呤霉素对KG-1a细胞的影响
磷酸钙转染法与常用的脂质体转染法相比,经济实惠,价格低廉,适合进行大规模的病毒包装,但是,要获得高效稳定的转染效率仍旧是实验研究中要面临的难题[1]。影响磷酸钙法转染效率的两个关键点是HBSS的pH值和形成的磷酸钙颗粒大小。本研究将不同体积比的pH 6.95和pH 7.05的HBSS溶液混合,结果显示只有在8 ∶2时293T细胞荧光最多,转染效率最高,而在其他比例如0 ∶9、1 ∶8中,红色荧光稀少。可见,在极小范围内改变pH值,可以极大地影响转染效率。这也可能是在实验中为何使用商品化的磷酸钙转染试剂,总是转染效果不佳的原因。另外一个影响磷酸钙法转染效率的是磷酸钙颗粒大小。有研究[2]表明形成1~3 μm大小的磷酸钙颗粒对提高磷酸钙法转染效率非常关键。本研究是将HBSS溶液逐滴地加入在振荡中的CaCl2-DNA混合物中,随后静置30 min,这样才能形成最佳大小的磷酸钙沉淀。漩涡振荡的时间长短会影响转染效率[3]。
逆转录病毒液离心过滤后,与6孔板内KG-1a细胞共孵育,同时加入polybrene。采用旋转法在22 ℃、1 800 r/min离心45 min,可以加大病毒颗粒与KG-1a细胞的接触面,增加病毒感染效率。Polybrene是一种多聚阳离子聚合物,广泛用于病毒介导的基因转染,有助于提高病毒感染效果[4-5]。其作用机制可能是通过中和细胞表面唾液酸与病毒颗粒之间的静电排斥从而促进吸附作用。研究[6]报道,与用病毒原液比较,采用病毒浓缩液细胞感染效率可大大提高。但是,病毒浓缩提纯需要超速离心或购买商品化的纯化柱纯化。对于中小城市的实验室,一般并不具备进行病毒浓缩的超速离心机,而购买纯化柱纯化,太过昂贵。本研究采用未经浓缩的病毒原液感染白血病KG-1a细胞,其感染率确实低,只有10%左右。但是,经过嘌呤霉素稳筛,携带病毒载体的靶细胞阳性率可以高达85%,完全满足后续的实验研究。
在病毒感染靶细胞过程中,还需要注意:polybrene过量或嘌呤霉素过量都可能杀死靶细胞。因此,在实验时,最好先做预实验筛选出最佳的药物浓度,既不损伤细胞又可获得最佳的感染效率。此外,还有许多实验细节需要注意:转染质粒的量要足够多,以保证后面包装出足够量的病毒感染靶细胞;嘌呤霉素稳筛出靶细胞后,进行药物撤离时,必须逐渐降低药物浓度,而不能立刻将药物浓度降为零,否则,靶细胞非常容易死亡。
本研究采用价格低廉的磷酸钙转染法进行病毒包装。创新之处在于用旋转离心法将病毒和靶细胞共孵育,采用未经浓缩的病毒原液感染难转染的白血病细胞,并通过药物成功地稳筛出阳性细胞株,保证后续研究。这对于需要做基础研究但科研条件一般的实验室来说,具有重要的借鉴价值。
