发酵鹰嘴豆乳产γ-氨基丁酸乳酸菌的复合诱变选育
2018-08-31董明盛
李 文,董明盛*
γ-氨基丁酸(γ-aminobutyric acid,GABA)是一种非蛋白质氨基酸,其作为中枢神经系统重要的抑制性神经递质,具有多种生理功能,如神经传导、降血压、利尿、抗氧化、抗炎等[1-3]。GABA广泛存在于自然界中,蔬菜和水果中的GABA含量太低,以鲜质量计,约只有0.03~2.00 μmol/g,而直接将GABA添加到食物中又被认为是非天然、不安全的[4-5]。因此,有必要通过一种自然的发酵过程,通过转化GABA前体物的方式,来增加食物中的GABA含量,乳酸菌是国际公认的食品安全级微生物[6],具有多种益生功效[7-8],乳酸菌已被广泛用于泡菜、奶酪、面包和酸奶等食品的生产中。研究表明乳酸菌具有胞内谷氨酸脱羧酶活性[9-11],其可催化L-谷氨酸或谷氨酸钠(monosodium glutamate,MSG)脱羧生成GABA。
鹰嘴豆是世界第二大消费豆类,产量居世界豆类第三[12]。鹰嘴豆富含蛋白质、氨基酸、维生素、粗纤维、谷胱甘肽及钙、铁、镁等成分,而淀粉和脂肪含量较低[13],且其具有降胆固醇及降血糖等功效。此外,其含有5%~10%的低聚半乳糖,有助于乳酸菌的生长,为GABA的产生提供了必要条件。目前,尚鲜见富含GABA鹰嘴豆乳生产的相关报道。
从自然界直接筛选得到的野生型菌株积累产物能力往往较低,无法满足实际生产的需要,因此,通过诱变育种手段改造菌株,为发酵工艺提供所需的突变型菌株是提高GABA产量最有效的途径。紫外诱变作为一种使用最早的物理诱变技术,沿用至今,效果显著[14]。紫外诱变是一种非电离福射,可以使DNA形成嘧啶二聚体,此二聚体可以在单链和双链相邻的两个胸腺嘧啶间形成[15],阻碍了DNA复制的正常进行,从而引起突变。紫外诱变操作方便,节约成本,已在细菌、真菌等菌种的选育中取得了较好的效果[16-18]。氯化锂作为一种高效、低毒的化学诱变剂,经常被用作诱变育种,已被成功应用于多种菌种选育[19-22]。复合诱变具有协同效应,如果两种或两种以上诱变剂合理搭配使用,诱变效果较单一诱变好[23]。其中,紫外与化学诱变剂的复合诱变被广泛应用[24-26]。
本研究在筛选获得具有发酵鹰嘴豆乳产GABA能力的野生型菌株的基础上,采用紫外诱变及紫外-氯化锂复合诱变的方式来提高菌株产GABA的能力,采用纸层析、筛选平板法、比色法、液相色谱法等筛选方式来获得产量提高的菌株,并检测其遗传稳定性,以期获得1株GABA产量提高且遗传稳定的菌株,更好地将其应用于富含GABA发酵鹰嘴豆乳的生产。
1 材料与方法
1.1 材料、试剂与培养基
植物乳杆菌M-6为本实验室分离自新疆波孜中,并保藏于本实验室。
GABA标准品 美国Sigma公司;牛肉膏、酵母膏、蛋白胨(均为生化试剂) 天津市福晨化学试剂厂;氯化锂、谷氨酸钠、茚三酮、邻苯二甲醛(o-phthalaldehyde,OPA)、β-巯基乙醇、正丁醇、冰醋酸等均为国产分析纯。
MRS(de Man Rogosa Sharpe)培养基:葡萄糖20.0 g、牛肉膏15.0 g、酵母膏5.0 g、蛋白胨10.0 g、无水乙酸钠5.0 g、柠檬酸铵2.0 g、K2HPO4·3H2O 2.62 g、MnSO4·H2O 0.198 g、MgSO4·7H2O 0.58 g、吐温-80 1.0 mL、蒸馏水1 000 mL,pH 6.0~6.5,121 ℃高压蒸汽灭菌20 min。
MRSG培养基:葡萄糖20.0 g、牛肉膏15.0 g、酵母膏5.0 g、蛋白胨10.0 g、无水乙酸钠5.0 g、柠檬酸铵2.0 g、K2HPO4·3H2O 2.62 g、MnSO4·H2O 0.198 g、MgSO4·7H2O 0.58 g、MSG 10 g、吐温-80 1.0 mL、蒸馏水1 000 mL,pH 6.0~6.5,121 ℃高压蒸汽灭菌20 min。
筛选平板:MRS平板,MRS培养基中添加1.5%的琼脂;高浓度MSG平板,MRS平板里添加MSG,使其终质量浓度分别为130、132、134、136、138、140 g/L,以出发菌株恰好无法生长的临界质量浓度作为筛选平板。
1.2 仪器与设备
ECLIPSE 80i科研级生物显微镜 日本Nikon Corporation公司;LRH-150型生化培养箱 上海益恒实验仪器有限公司;PB-20型pH计 德国Sartarius公司;64RL高速冷冻离心机 美国Beckman公司;1100型高效液相色谱(high performance liquid chromatography,HPLC)仪 美国Agilent公司;ZORBAX Eclipse Plus C18反相分析柱(4.60 mm×250 mm,5μm) 美国Agilent公司;722型分光光度计 上海菁华科技仪器有限公司。
1.3 方法
1.3.1 菌株生长曲线的绘制
将植物乳杆菌M-6接种于MRS培养基,于37 ℃活化培养14~16 h,再以3%的接种量接种到MRS培养基中,于37 ℃培养。从0 h开始,每隔2 h,取适量菌悬液用分光光度计测其600 nm波长处的OD值,以培养时间为横坐标,OD600nm值为纵坐标,绘制菌株的生长曲线。
1.3.2 紫外诱变
将M-6活化两次,培养至对数中后期,取10 mL菌悬液于平皿中,平皿置磁力搅拌器上,垂直摆放在功率为18 W的紫外灯下,在30 cm距离处进行紫外诱变,照射时间分别为0、30、60、90、120、180、240、300 s。照射完毕后,分别移取0.1 mL稀释至10-4、10-5、10-6的菌悬液涂布于MRS固体培养基或高浓度MSG平板上,于37 ℃避光培养48 h,统计紫外照射不同时间的突变株在MRS平板上的菌落数,按照如下公式计算致死率:

1.3.3 紫外-氯化锂复合诱变
将紫外诱变后的菌悬液涂布于含0%、0.5%、0.75%、1.00%、1.25%、1.5%、1.75%、2.00%氯化锂的诱变培养基平板上,37 ℃避光培养48 h,计数,统计致死率。
1.3.4 诱变菌株的筛选
1.3.4.1 高浓度MSG平板法
将活化两次的出发菌株涂布于含MSG质量浓度分别为130、132、134、136、138、140 g/L的MRS平板上,找出临界质量浓度,以此质量浓度作为筛选平板,将紫外诱变后的菌悬液涂布于此临界质量浓度的平板上,挑出能在此质量浓度平板上生长的突变株,留待下一步筛选。
1.3.4.2 MRSG发酵上清液的制备
将紫外-氯化锂诱变菌株活化两次后,以3%(体积分数)接种量接种于MRSG液体培养基中,置于37 ℃,静置培养48 h。发酵液经低温冷冻离心(10 000×g,4 ℃,10 min)后,收集上清液并置于4 ℃保存备用。
1.3.4.3 纸层析法
采用预染纸层析法筛选GABA产量提高的乳酸菌[27]。吸取MRSG发酵上清液1 μL,点样于层析纸上。采用正丁醇-冰醋酸-水体积比为2∶1∶1的体系为展开剂,添加0.8 g/100 mL茚三酮为显色剂,做密闭上行展开,展开后于80 ℃下显色30 min。以质量浓度为2 g/L的GABA和MSG标准品作对照。
1.3.4.4 Berthelot比色法[28-29]
取MRSG发酵上清液0.5 mL,依次加入0.5 mL浓度为0.2 mol/L的硼酸缓冲液(pH 9.0)、1 mL质量分数为6%的苯酚和1 mL次氯酸钠溶液,充分混匀后置于沸水浴中反应10 min,立刻放在冰浴中20 min,待样品出现蓝绿色后加入体积分数为60%的乙醇溶液,混匀,645 nm波长处测定其吸光度。
1.3.4.5 鹰嘴豆乳的制备及发酵
选取优质鹰嘴豆,清水冲洗后,室温浸泡12 h,以豆水比1∶10(g/mL)加入水,煮沸15 min,磨浆,过滤,滤液中加入0.2%的MSG,108 ℃灭菌15 min。
将活化后的乳酸菌用0.85 g/100 mL的生理盐水清洗两次,获得菌悬制备液。具体方法为[30]:发酵液于4 ℃、8 000 r/min离心15 min,去上清液,加等体积的生理盐水吹打菌体,重复操作两次。
待豆乳冷却后,按5%的接种量接入菌悬液,于37 ℃培养箱发酵48 h。发酵液经低温冷冻离心 (10 000×g,4 ℃,10 min)后,收集上清液并置于4 ℃保存备用。
1.3.4.6 HPLC法分析
采用HPLC进行GABA的定量分析[31]。洗脱条件见表1,流动相A为20 mmol/L的醋酸钠(pH 7.3),流动相B为乙腈。衍生试剂为OPA 40 mg,乙腈10 mL,β-巯基乙醇40 μL,混匀。硼酸缓冲液:硼酸2.47 g,用双蒸水溶解,调节pH 10.4,定容至100 mL。依次吸取500 μL硼酸缓冲液、100 μL OPA衍生试剂、100 μL发酵上清液混匀,室温反应5 min。取20 μL进样,流速0.8 mL/min,波长334 nm,柱温25 ℃。以GABA浓度为横坐标,峰面积为纵坐标,即可绘制出标准曲线和测定发酵上清液中GABA含量。
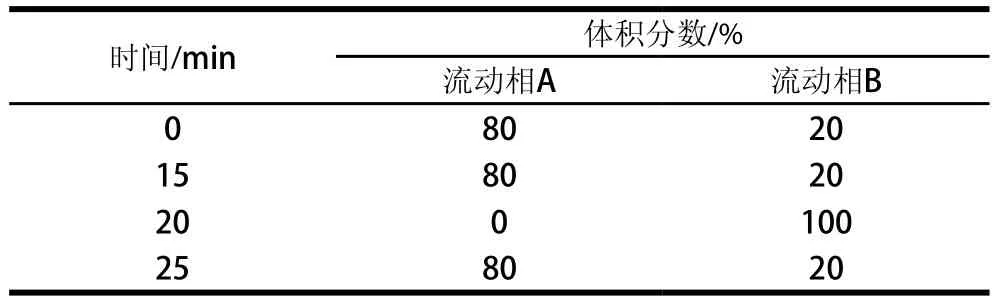
表1 梯度洗脱条件Table 1 Gradient program of mobile phase
1.3.5 遗传稳定性检测
将筛选得到的高产菌株进行传代培养,连续传10 代,分别检测每代菌株在鹰嘴豆乳中的GABA产量,以考察突变菌株的遗传稳定性。
1.4 统计分析
实验数据均为3次重复实验结果的平均值,数据表示成 ±s的形式,采用SPSS 16.0对数据进行统计分析,采用Duncan’s ANOVA进行多重比较,不同处理组之间P<0.05表明差异性显著,P<0.01表明差异性极显著。
2 结果与分析
2.1 出发菌株的生长曲线
出发菌株M-6的生长曲线见图1,菌株在MRS培养基中生长迅速,延滞期很短,2 h后即进入对数期,14 h后进入稳定期,当菌体处于对数中后期时,细胞生长迅速,代谢旺盛,对外界条件的变化较为敏感,因此,选定10~12 h的菌体进行之后的诱变实验。
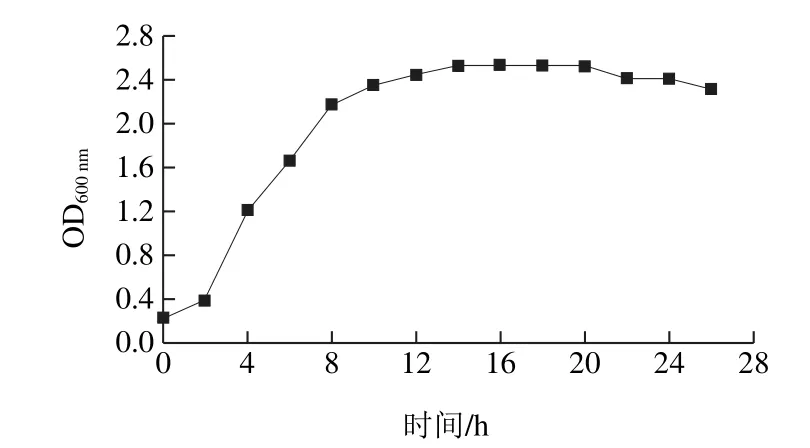
图1 出发菌株的生长曲线Fig. 1 Growth curve of the parental strain
2.2 紫外诱变最佳时间的确定
紫外线作为一种常用的物理诱变剂,可以使DNA形成胸腺嘧啶二聚体,胞嘧啶水合物及DNA链或氢键断裂等,从而导致DNA结构变化[32]。紫外照射时间对菌株致死率的影响见图2,随着诱变时间的不断延长,M-6的致死率呈上升趋势,而当致死率在70%~80%左右时,有利于正突变的产生[32],故诱变的最佳时间为240 s。
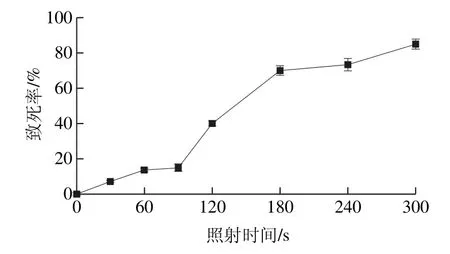
图2 紫外诱变时间对致死率的影响Fig. 2 Effect of UV irradiation time on morality
2.3 紫外-氯化锂复合诱变剂量的确定
氯化锂作为一种化学诱变剂,其单独使用时,诱变效果不是很明显,因此,常作为一种助诱变剂与其他诱变剂复合使用,往往可以起到较好的诱变效果[32]。采用紫外-氯化锂复合诱变对出发菌株进行处理,将紫外照射240 s的菌株涂布于不同质量分数梯度的氯化锂平板上,由图3可见,随着氯化锂质量分数的升高,菌株的致死率呈现上升趋势,低质量分数范围内致死率上升很快,质量分数大于1.5%后,上升速率变缓,当氯化锂质量分数继续增大至2%,平板上无菌落长出,当氯化锂质量分数为1.25%时,菌株的致死率为78.05%,选用此剂量作为氯化锂诱变的最佳剂量。
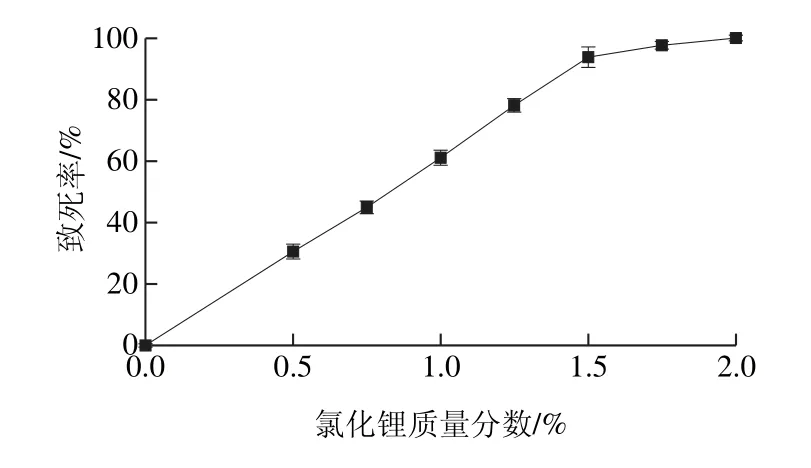
图3 氯化锂质量分数对致死率的影响Fig. 3 Effect of LiCl concentration on morality
2.4 菌株初筛
2.4.1 高浓度MSG平板初筛
由于诱变的目的是获得GABA产量提高的菌株,因此,其对转化底物的转化能力应有所提高,耐受性也应更好[23]。配制一系列含高质量浓度底物MSG的筛选平板,考察出发菌株在平板上的生长能力,结果见图4。可以看出,出发菌株在含138 g/L MSG的平板上,不再有菌落长出,因此,选用此质量浓度的MSG平板作为筛选平板,若突变株能在此平板上生长,则其GABA产量应有所提高。采用此法从紫外诱变的突变株中筛选出18 株能在高MSG平板上生长的突变株,留待复筛。
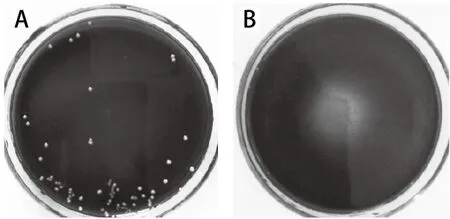
图4 菌株在含136 g/L(A)和138 g/L (B) MSG的MRS上的生长情况Fig. 4 Growth of strains on MRS with 136 g/L (A) and 138 g/L (B) of MSG
2.4.2 纸层析初筛
采用纸层析的方式对紫外-氯化锂诱变菌株进行初步筛选,通过GABA斑点的深浅初步判断GABA产量的高低,初步排除低产或不产GABA的菌株。
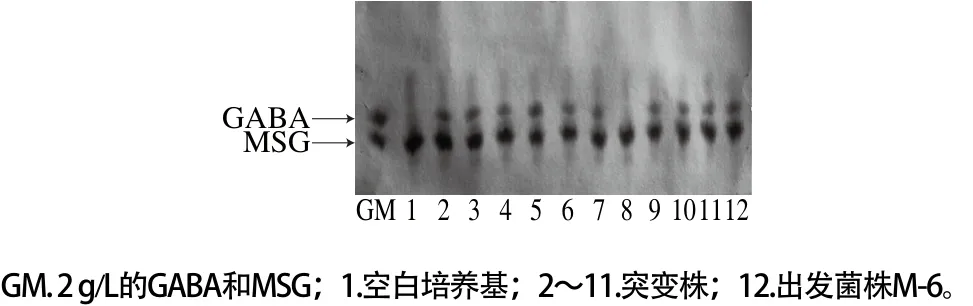
图5 诱变菌株的纸层析结果Fig. 5 Paper chromatography profiles of mutant strains
代表性纸层析的结果如图5所示,与出发菌株相比,2、3、5号GABA斑点加深,6号GABA斑点变浅,其他变化不大,因此,挑出2、3、5号进行后续的筛选。采用此法从紫外-氯化锂复合诱变的200多株突变株中挑选出20株突变株留待复筛。
2.5 Berthelot比色法及HPLC法复筛
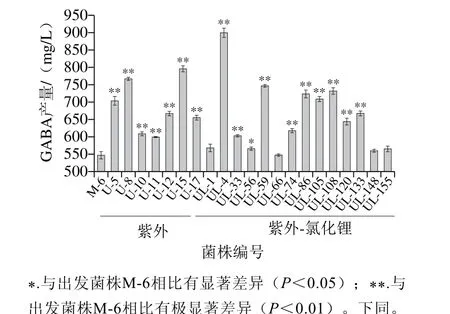
图6 诱变菌株在MRSG里产GABA的筛选结果Fig. 6 GABA production in MRSG by mutant strains obtained by UV and UV-LiCl
利用高MSG平板法和纸层析法,共筛选出纸层析GABA斑点颜色深于出发菌株的、138 g/L的MSG平板上能够生长的38 株菌株进行Berthelot比色法测定,通过比较OD值的大小,得到21 株诱变后GABA含量显著高于出发菌株的突变株,其中,紫外诱变的7 株,紫外-氯化锂复合诱变的14 株,利用HPLC法进行准确定量,结果见图6,紫外诱变所得的7 株菌GABA产量都极显著高于出发菌株(P<0.01),其中U-15产量最高,为795.75 mg/L,比出发菌株的产量提高了45.34%;复合诱变的菌株,除UL-1、UL-66、UL-148、UL-155四株菌与出发菌株无显著差异外,UL-56的GABA产量显著高于M-6(P<0.05),其他9 株菌的GABA产量极显著高于M-6(P<0.01)。其中UL-4的产量最高,为899.27 mg/L,比出发菌株M-6产量提高了64.25%。
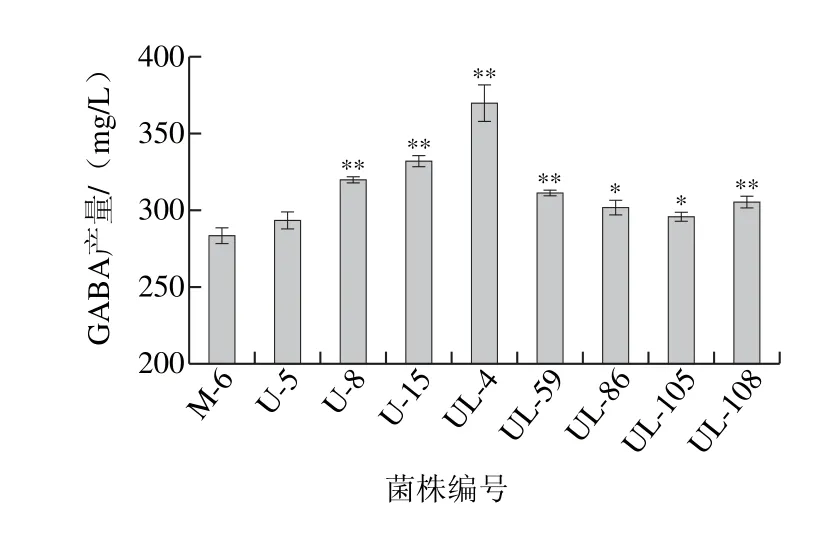
图7 诱变菌株在鹰嘴豆乳里产GABA的筛选结果Fig. 7 GABA production in chickpea milk by mutant strains obtained by UV and UV-LiCl
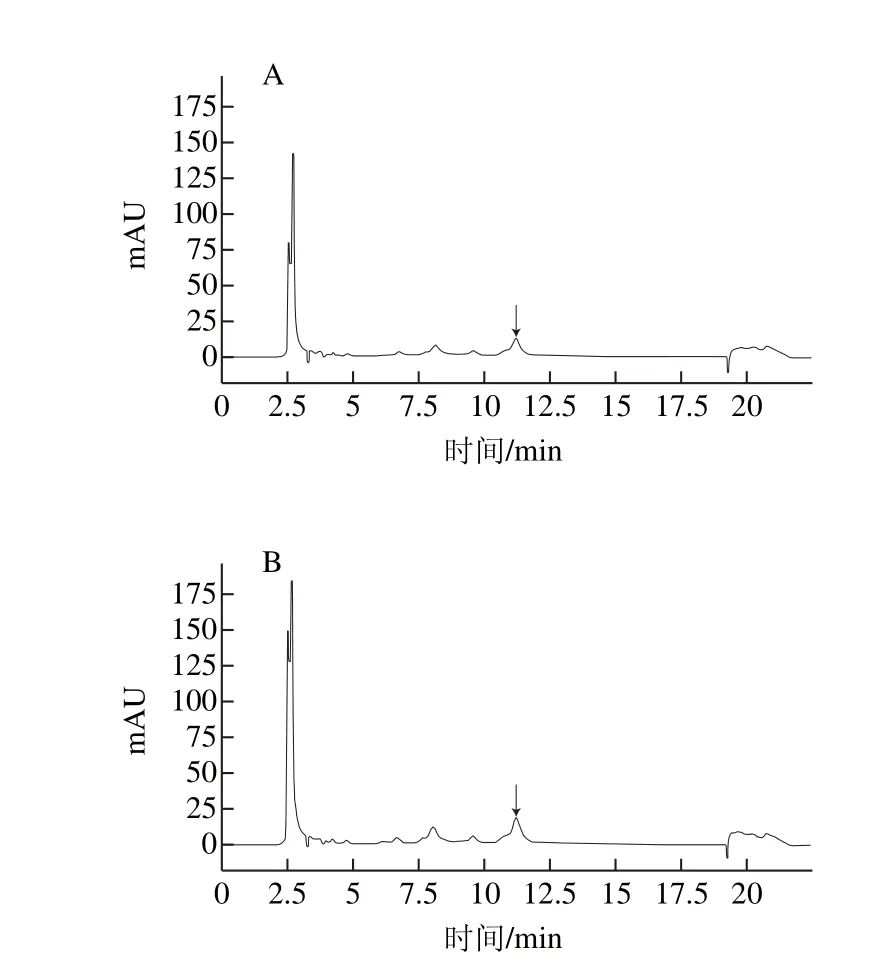
图8 M-6(A)及UL-4(B)发酵上清衍生物的HPLC图谱Fig. 8 HPLC chromatograms for cultural supernatants of M-6 and UL-4
从以上突变株中挑选出产量在700 mg/L以上的突变株,采用HPLC法检测其在鹰嘴豆乳中产GABA的能力,结果见图7。复合诱变突变株中的UL-4在鹰嘴豆乳中的GABA产量最高,为369.53 mg/L,比出发菌株提高了30.46%,在鹰嘴豆乳里GABA产量提高的幅度不如在MRSG培养基中大,可能是由于发酵基质的改变和底物浓度的降低,引起菌株转化能力的相应改变。出发菌株M-6及突变株UL-4在鹰嘴豆乳中发酵上清液的OPA衍生物HPLC见图8。可见,M-6和UL-4中出现了同样的GABA的OPA衍生物峰(箭头所指),且UL-4的GABA产量有所提高,体现在对应的峰面积大于M-6。
2.6 突变株性状
除检测GABA产量外,比较诱变对于突变株性状的影响。从图9菌株的单菌落形态来看,突变菌株和出发菌株的菌落形态均呈圆形,较小而厚,表面光滑,边缘整齐,形态基本一致。但紫外诱变后的菌落出现的时间稍晚于出发菌株,而紫外-氯化锂复合诱变后的菌株的出现时间更晚,这可能是因为紫外照射使细胞受到一定程度的损伤,需要一定时间的恢复,才能正常生长;复合诱变时,已经接受过紫外照射的菌株对氯化锂更为敏感,且在整个生长阶段都接触到诱变剂氯化锂,生长受到了较大且持久的影响。
图9 出发菌株(A)、紫外诱变菌株(240 s)(B)、紫外-氯化锂复合诱变菌株(C)的单菌落形态Fig. 9 Colonies of original strain (A), and mutant strains after UV irritation (240 s) (B) and after UV-LiCl mutagenesis (C) on MRS plates
2.7 遗传稳定性结果
将复合诱变所得产量最高的突变株UL-4传代10 次,测定每一代在鹰嘴豆乳中的GABA产量,结果见图10,可以看出,每代菌株的GABA产量间无显著性差异(P>0.05),即传代次数对GABA的产量无显著影响,说明该菌株具有较好的遗传稳定性。
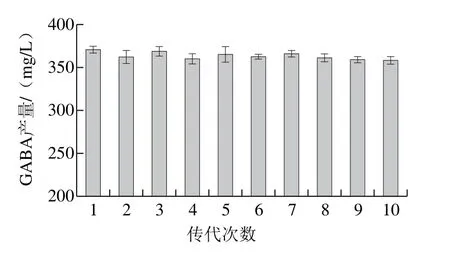
图10 突变株UL-4不同传代次数发酵鹰嘴豆乳的GABA产量Fig. 10 GABA content in chickpea milk inoculated with different generations of mutant UL-4
3 讨 论
紫外诱变方法是一种广泛采用的对微生物菌种进行改良的方法,其简便快捷,效果较为显著。在GABA的菌种选育方面,也得以广泛应用。蒋冬花等[33]以米曲霉(Aspergillus oryzae)的孢子为对象进行紫外诱变,经初筛、复筛后获得1 株GABA产量较高且稳定遗传的突变株As-8,其在合适的培养条件下,GABA产量最高可达4.2 g/L。姜宏瑛[34]采用紫外诱变唾液链球菌嗜热亚种,得到的突变株在含100 mmol/L L-谷氨酸钠的底物缓冲液中,GABA的转化率最高可达19.974 mg/(g·h),较出发菌株提高44.52%。相比单独一种诱变方法,复合诱变能有效改变菌株对诱变因素的敏感性,提高正向突变率,能够大规模提高生产菌株的产量[35]。黄翠萍等[36]采用紫外及亚硝基胍诱变嗜酸乳杆菌,得到高产突变株SW-135-13,其GABA产量为1.31 g/L。本实验尝试紫外-氯化锂复合诱变的方法对植物乳杆菌进行选育,得到的突变菌株UL-4,其在MRSG培养基和鹰嘴豆乳中的GABA产量分别为899.27 mg/L和369.53 mg/L,比出发菌株M-6产量分别提高了64.25%和30.46%,比单独紫外照射诱变获得的GABA产量增加幅度最大的突变株提高了13.01%和11.41%,可见紫外-氯化锂复合诱变可以发挥紫外线和氯化锂两种诱变剂的协同作用,好于单一紫外线诱变的效果。
随着天然食品与有机食品概念的提出,人们越来越倾向于采用益生菌发酵食品中的谷氨酸及其钠盐的方式来生产富含GABA的功能性食品,或是通过其他天然的方式来增加食品中的GABA含量,而不是额外地加入化学合成的GABA。GABA含量较高的发酵产品有发酵乳制品,酱油和奶酪等。Pouliot-Mathieu等[37]使用Lactococcus lactis ssp. lactis发酵奶酪后,GABA含量为320 mg/kg。Nejati等[38]采用植物乳杆菌和其他乳酸菌混合发酵牛奶,GABA含量为144.5 mg/kg。但鲜有乳酸菌发酵鹰嘴豆乳产GABA的相关报道。本实验诱变所得菌株可以较好地用于鹰嘴豆乳的发酵以富集GABA,为新型富含GABA功能性食品的开发提供了可能性。
