直接竞争ELISA法检测蜂蜜中氯霉素残留
2018-08-31韦倩妮杨金易孙远明徐振林李向梅雷红涛
刘 姚,韦倩妮,王 弘,杨金易,孙远明,徐振林,沈 兴,李向梅,雷红涛*
氯霉素(chloramphenicol,CAP)又称氯胺苯醇,是一种常用的广谱抗生素,结构式如图1所示。1947年,在Streptomyces Venezuelae的培养液中首次分离得到CAP[1],其抑菌机制是通过与原核细胞内的50S核糖体亚基结合,抑制蛋白质的合成从而抑制微生物的生长繁殖[2]。CAP具有抗菌效果明显、价格低廉等优点,因此广泛应用于畜牧业中,治疗畜禽肠道感染疾病[3]。近年来,许多研究表明CAP的过度摄入会威胁人类健康,国际癌症研究机构将CAP归为2A组,表明CAP或许对人类致癌;CAP还能抑制人体的造血系统,引起血细胞减少、灰婴综合症和再生障碍性贫血[4]。因此,欧盟、美国、日本等国家和地区均规定在食品中禁止使用CAP[5]。欧盟设定在肉类、鸡蛋、牛奶、水产品和蜂蜜中CAP的最低要求的性能限制为0.3 μg/kg[6]。然而CAP的违规使用依然广泛存在,为有效监控食品中CAP的含量,有必要对CAP进行严格的检测。

图1 CAP分子结构式Fig. 1 Structure of chloramphenicol
蜂蜜作为一种天然的甜味剂,广泛用作营养品[7]。有研究表明,蜂蜜富含酚醛树脂、挥发性物质、有机酸、丙酮醛、过氧化氢酶等,具有抗菌抗氧化活性[8]。与其他天然食品一样,蜂蜜容易受到环境的污染,如重金属、农药、抗生素污染。常用于检测蜂蜜中CAP的方法有液相色谱-质谱联用[9-12]、气相色谱[13]等,虽然灵敏度高,但是仪器昂贵、样品前处理复杂,且不适用于大量样品的筛查。近年来基于抗原-抗体特异性识别的基础上发展的免疫检测方法有表面等离子共振[14-16]、免疫传感器[17-19]、免疫层析试纸条[20]、多点纳米矩阵[21]、光敏比色免疫测定[22]等广泛用于蜂蜜中CAP的检测。酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)因其操作简便被广泛用于样品初分析和现场筛查[7]。
中国是世界上最大的蜂蜜生产、消费和出口国,2015年国家统计局数据显示中国产蜂蜜达50万 t,其中出口量占28.6%,国内消费占69.3%。为保障消费者健康安全和蜂蜜出口贸易的顺利进行,亟需研究开发蜂蜜中CAP高灵敏度快速检测试剂盒。目前,国外普遍采用商业化的直接竞争ELISA试剂盒对CAP残留进行检测,直接竞争ELISA具有灵敏度高和操作简单的优点;常用的试剂盒主要来源于德国r-Biopharm公司、英国RANDOX公司及荷兰Euro-Diagnostica公司[23]。国内关于CAP的残留ELISA检测试剂盒的研发,主要集中在间接ELISA试剂盒,仅有少数是直接竞争法ELISA试剂盒[24];直接竞争法ELISA采用的包被原有羊抗兔IgG抗体(二抗)[25]和CAP单克隆抗体[26]。本研究在已获得高特异性CAP单克隆抗体的基础上,对CAP直接竞争ELISA方法进行优化,为进一步研制蜂蜜中CAP残留直接竞争ELISA检测试剂盒提供理论依据。
1 材料与方法
1.1 材料与试剂
抗CAP单克隆抗体、CAP-辣根过氧化物酶标记物、3,3’,5,5’-四甲基联苯胺(3,3’,5,5’-tetramethylbenzidine,TMB)由广东省食品安全重点实验室制备并保存;蜂蜜(经仪器检测不含CAP) 市购;CAP标准品上海孟成科技有限公司;羊抗鼠IgG 武汉博士德生物公司;96 孔可拆卸酶标板 厦门美宜佳公司;其他试剂均为国产分析纯。
包被液:Na2CO31.69 g和NaHCO32.95 g,用蒸馏水定容至1 L;抗体稀释液:PBST(含0.05%吐温20的磷酸盐缓冲液(phosphate buffered saline,PBS));底物显色液:TMB显色液;终止液为10%硫酸溶液;洗液:Na2HPO4·12H2O 3.0 g、NaCl 8.5 g、吐温20 0.5 mL,用蒸馏水定容至1 L;磷酸钠缓冲液(phosphate buffer,PB)、PBS和硼酸缓冲液(硼液)均由实验室配制。
1.2 仪器与设备
Multiskan酶标仪、Wellwash 4MK2洗板机 美国Thermo公司;6K-15冷冻离心机 美国Sartorius-Sigma公司;82-5控温磁力搅拌器 金坛市恒丰仪器厂;DK-8D电热恒温水槽 上海医用恒温设备厂;R2100旋转蒸发器 无锡申科生物技术有限公司;HY-4调速多用振荡器 金坛市顺华仪器有限公司;KQ-50DA型数控超声波清洗器 昆山市超声仪器有限公司。
1.3 方法
1.3.1 直接竞争ELISA基本步骤
包被:用包被液将包被抗体稀释到合适浓度,加入96 孔板中,100 μL/孔,孵育过夜。封闭:使用洗液洗板2 次,拍干,每孔加入120 μL封闭液,37 ℃孵育3 h,甩干孔中的液体,置于37 ℃烘箱中1 h备用。抗原-抗体反应:每孔各加入50 μL的标准品与50 μL的酶标记抗原,37 ℃水浴孵育一定时间。洗板:用洗涤液洗涤6 次。加底物液:每孔各加入底物液缓冲液50 μL和底物液50 μL,显色10 min。终止反应:每孔各加入终止液50 μL,在酶标仪上测量波长450 nm处各孔吸光度。
1.3.2 标准品稀释液的确定
用不同稀释液(去离子水、PBST、PBS、PB液)配制CAP标准溶液,质量浓度分别为0.000、0.005、0.015、0.045、0.135、0.405、1.215、3.645、10.935、32.805、98.415 ng/mL和295.245 ng/mL。按照1.3.1节步骤进行测定,以CAP标准品质量浓度负对数为横坐标,以A450nm为纵坐标,绘制标准曲线。
1.3.3 包被温度的确定
分别在4 ℃和37 ℃包被过夜(12 h)。按照1.3.1节步骤测定,选择灵敏度较高、曲线斜率较大的温度为最佳包被温度。
1.3.4 包被抗体稀释倍数的确定
将包被抗体分别稀释不同倍数(1∶3 000、1∶4 000、1∶5 000、1∶6 000),于4 ℃包被过夜。按照1.3.1节步骤测定A450nm,绘制标准曲线。
1.3.5 酶标抗原稀释液的确定
分别使用PBST、PB液与硼液稀释酶标抗原,测定A450nm,绘制标准曲线。
1.3.6 酶标抗原稀释倍数确定
将酶标抗原分别按1∶2 000、1∶3 000、1∶4 000稀释倍数加入到酶标孔中,按1.3.1节步骤测定,绘制标准曲线。
1.3.7 竞争时间的确定
按照1.3.1节步骤,在加入药物与酶标抗原后,于37 ℃分别竞争反应20、25、30、40 min后显色,测定A450nm,绘制标准曲线。
1.3.8 直接竞争ELISA标准曲线的建立
由以上ELISA条件优化过程确定出各个因素的最佳值,按照1.3.1节步骤测定A450nm,以CAP标准品质量浓度负对数为横坐标,以A450nm为纵坐标,绘制标准曲线。
1.3.9 样品前处理方法的优化
1.3.9.1 提取方法的优化
振荡提取:称取蜂蜜样品3 g,加3 mL蒸馏水,振荡均匀,再加6 mL乙酸乙酯,振荡15 min。5 000 r/min离心10 min。吸取上层液2 mL。45 ℃旋转蒸干,加1 mL正己烷溶解残留物,再加1 mL PBS复溶。去除上层正己烷,取下层清液50 μL待测。
超声提取:称取样品3 g,加3 mL蒸馏水,振荡均匀,再加6 mL乙酸乙酯,超声15 min。5 000 r/min离心10 min。吸取上层2 mL。45 ℃旋转蒸干,加1 mL正己烷溶解残留物,再加1 mL PBS复溶。去除上层正己烷,取下层清液50 μL待测。
1.3.9.2 提取时间的确定
称取样品3 g,共设4 组。每组加3 mL蒸馏水,振荡均匀,再加6 mL乙酸乙酯,然后每组分别振荡5、10、20、30 min。5 000 r/min离心10 min。吸取上层2 mL。45 ℃旋转蒸干,加1 mL正己烷溶解残留物,再加1 mL PBS复溶。去除上层正己烷,取下层清液50 μL待测。
1.3.10 蜂蜜样品中CAP的检出限和定量限
取20 份空白样品,按照已确定的步骤进行测定,计算检出质量浓度的平均值C0以及标准偏差SC0。检出限为C0加上3 倍的SC0,定量限为C0加上10 倍的SC0。
1.3.11 添加回收实验
在样品中添加不同水平(0.3、1、3 ng/mL)的CAP标准品,按照样品前处理方法对样品进行处理。分别按照已优化的方法进行ELISA检测,并计算回收率。
1.3.12 重复性实验
对于所建立CAP的ELISA检测方法进行重复性考察,分别以批内与批间误差来表示。批内变异测定:每一标准品质量浓度作8 次重复,以其批内变异系数表示批内误差;批间变异测定:按照最佳检测条件分别作标准曲线,取不同批次包被的酶标板,每个标准品质量浓度每天作一次分析,连续进行7 d测定,综合7 d测得质量浓度进行分析,以其批间变异系数表示批间误差。
2 结果与分析
2.1 最佳反应条件
2.1.1 标准品稀释液的确定
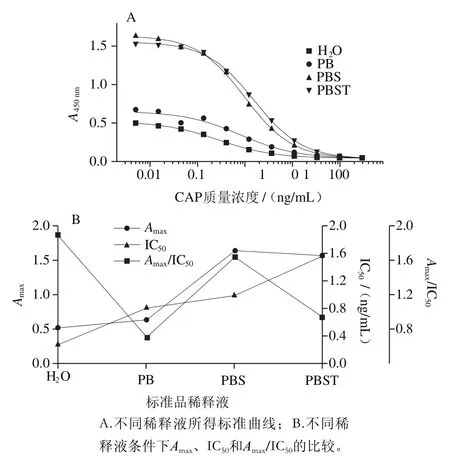
图2 CAP标准品稀释液的优化Fig. 2 Optimization of dilution of chloramphenicol standard
如图2所示,使用蒸馏水或者PB溶液配制标准溶液进行ELISA实验时,A450nm值偏低,而用PBS或PBST可提高A450nm值,且使用PBS时,IC50值低而Amax/IC50高,可能原因是PBS溶液具有一定离子强度,有较好的缓冲能力,使用其作为标准品稀释液进行ELISA反应时,不会破坏缓冲体系的pH值和离子浓度,因此选择PBS稀释标准品检测效果最佳。
2.1.2 包被温度的确定

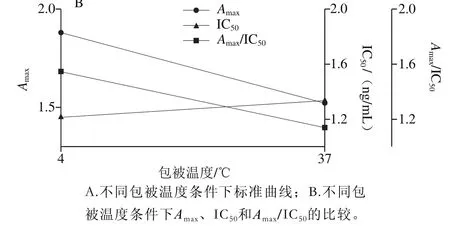
图3 包被温度的优化Fig. 3 Optimization of coating temperature
如图3所示,采用4℃包被过夜,A450nm值和Amax/IC50较高,并且比37 ℃包被更灵敏。抗体在37 ℃包被过程中,由于孵育时间偏长,部分蛋白变性,而4 ℃长时间孵育更有利与抗体充分吸附到固相载体上并保持抗体活性,因此选择4 ℃为最佳的包被温度。
2.1.3 包被抗体稀释倍数的确定

图4 抗体稀释倍数的优化Fig. 4 Optimization of antibody dilution
如图4所示,当包被抗体稀释倍数达到1∶4 000时,随着稀释倍数的提高,曲线灵敏度并没有明显变化,但A450nm值和Amax/IC50值逐渐降低,因此,选择1∶4 000作为包被抗体最佳稀释倍数。
2.1.4 酶标抗原稀释液的确定
如图5所示,用PBST稀释酶标记抗原,其检测值较低,但灵敏度和Amax/IC50最高,而其余2 种稀释液效果相当,可能原因是PBST的成分对于非特异性蛋白的竞争性结合的抑制作用更为明显,故选择PBST作为抗体稀释缓冲液。
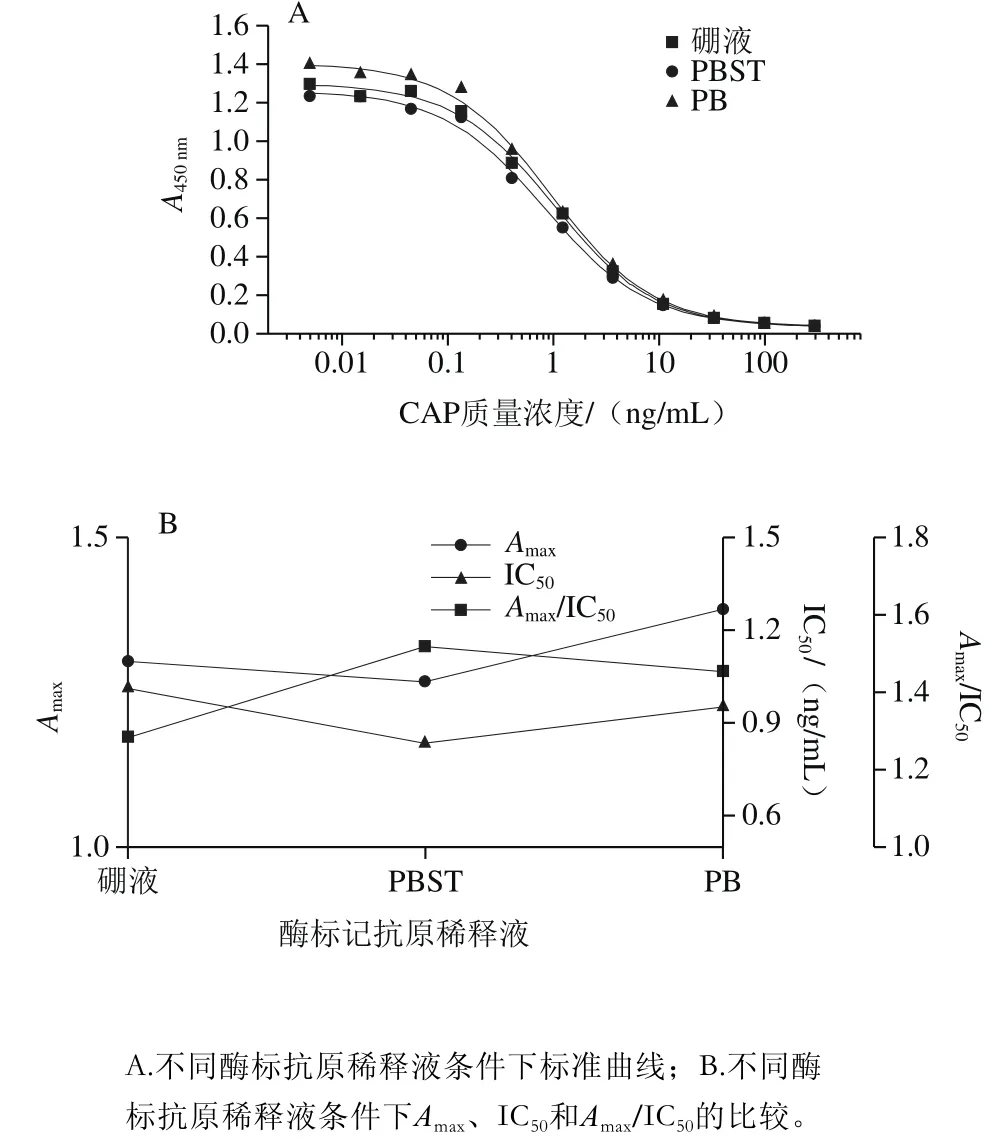
图5 酶标抗原稀释液的优化Fig. 5 Optimization of dilution solution for enzyme labeled antigen
2.1.5 酶标抗原稀释倍数的确定
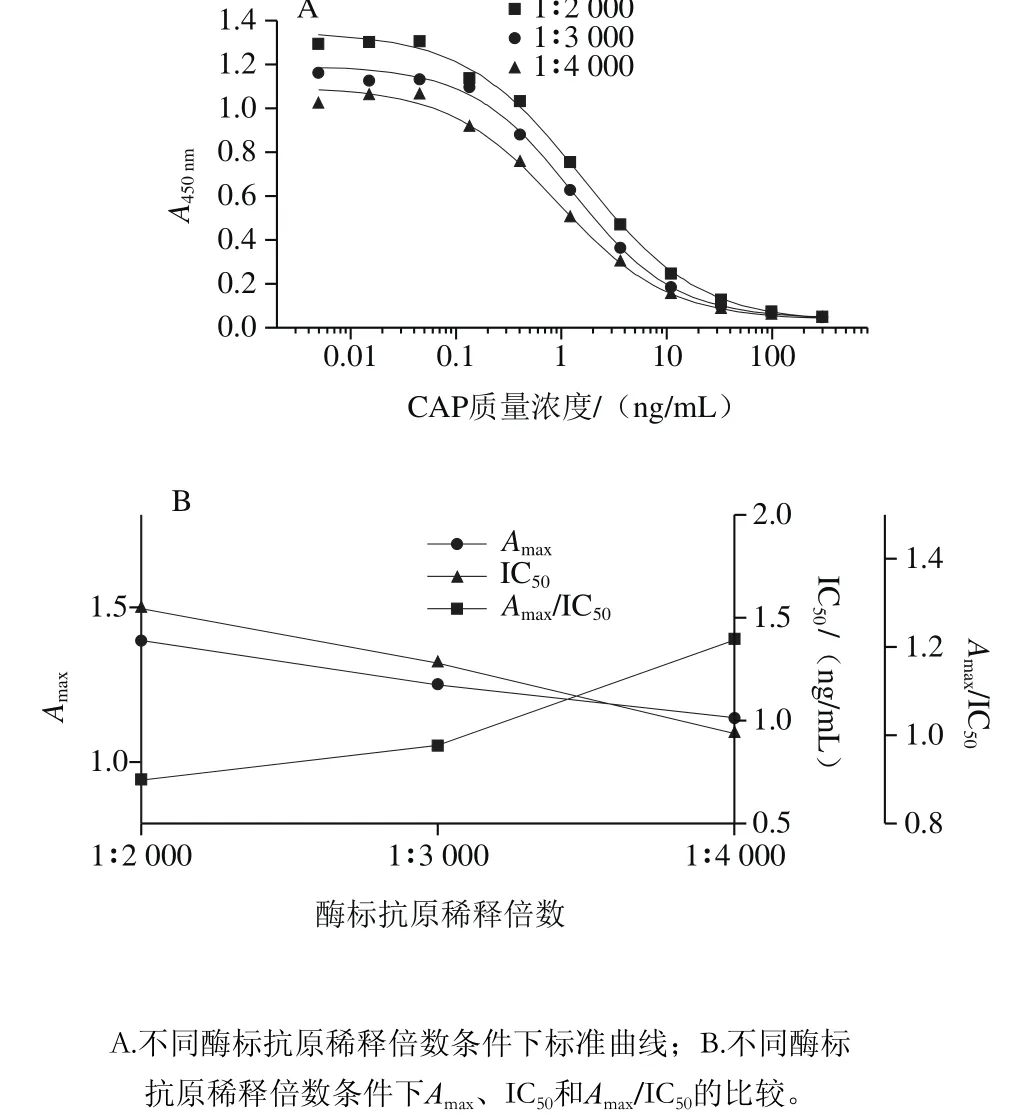
图6 酶标抗原稀释倍数的优化Fig. 6 Optimization of dilution degree of enzyme labeled antigen
如图6所示,随着酶标记抗原稀释倍数的提高,A450nm值和IC50值降低,Amax/IC50升高。当稀释倍数达到1∶4 000时,各个参数达最佳水平。因此酶标记抗原最佳稀释倍数为1∶4 000。
2.1.6 竞争时间的确定
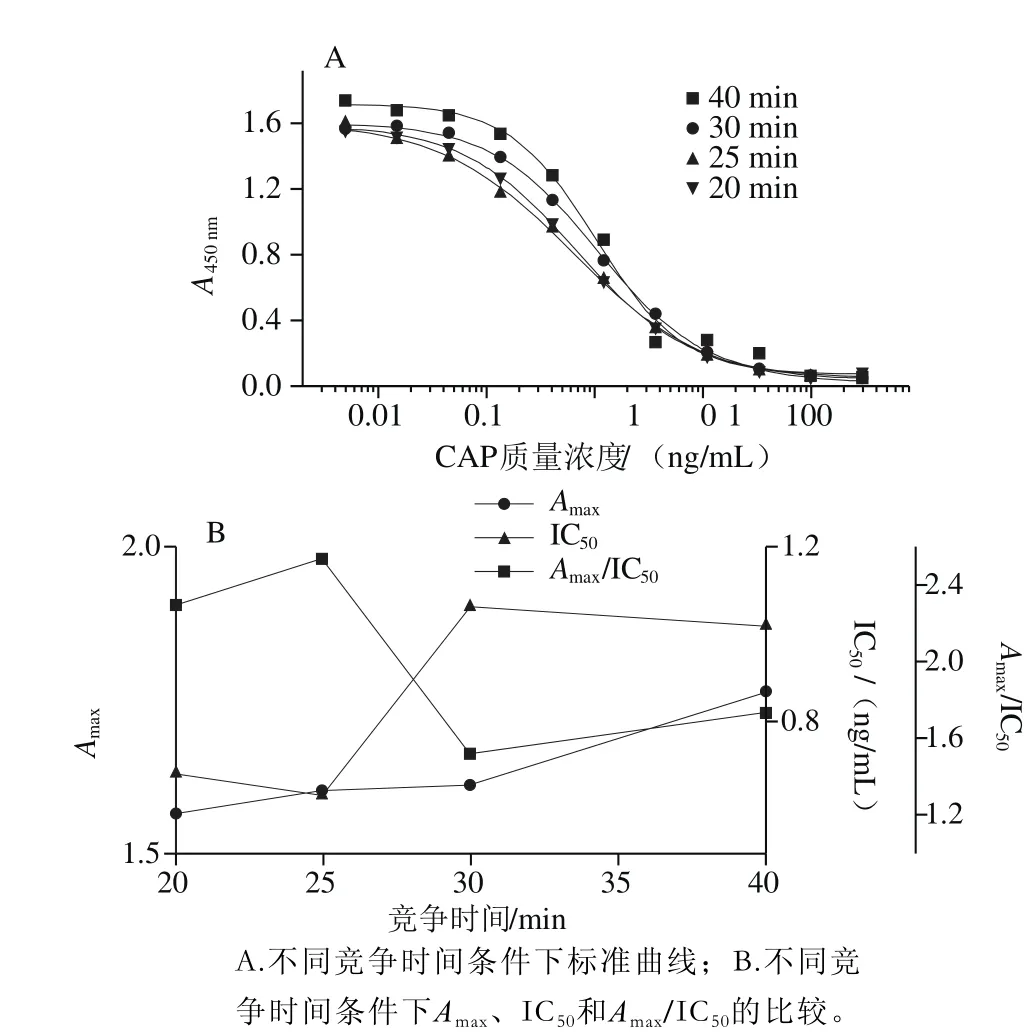
图7 竞争时间的优化Fig. 7 Optimization of competition time
如图7所示,随着竞争时间延长,检测值随时间的延长呈平稳上升趋势,Amax/IC50先升高再降低,在25 min处达到最高值。IC50值变化较为显著,在20~20 min内IC50值较低,但此后随竞争时间延长,IC50值急剧升高。因此ELISA反应最佳竞争时间为25 min。
2.1.7 标准曲线的建立
按照上述ELISA条件优化结果,得到CAP直接竞争ELISA方法的最佳反应条件,即:包被抗体稀释倍数1∶4 000,包被温度4 ℃,酶标记抗原稀释缓冲液为PBST,稀释倍数1∶4 000,最佳竞争时间25 min。
根据波长450 nm处吸光度,以CAP标准品质量浓度负对数为横坐标,以A450nm为纵坐标,绘制标准曲线。标准曲线的回归方程为y=-17.425x+97.509,相关系数R2为0.991 2,IC50为0.63 ng/mL。线性范围(IC20~IC80)为0.10~4.17 ng/mL。
2.2 样品前处理方法的优化
2.2.1 提取方式的确定结果
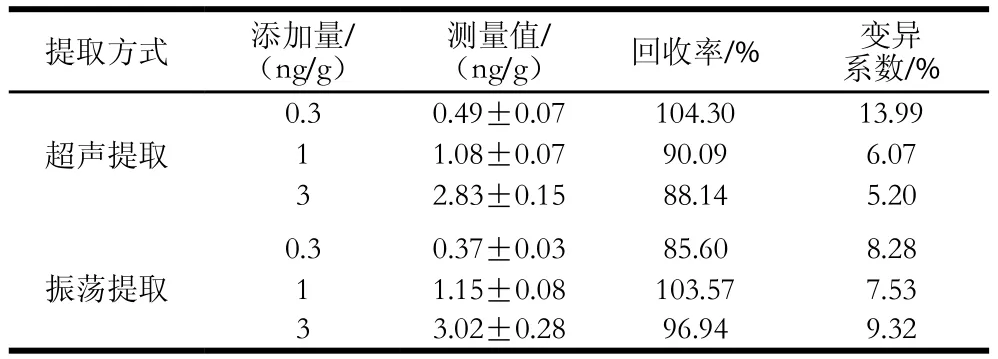
表1 蜂蜜不同提取方式添加回收率实验结果Table 1 Recoveries of chloramphenicol from honey samples using different extraction methods
如表1所示,采用超声提取和振荡提取2 种方式提取样品中的CAP,提取得率相差不大。振荡提取更为简便,因此确定振荡提取为样品前处理方式。
2.2.2 提取时间的确定结果
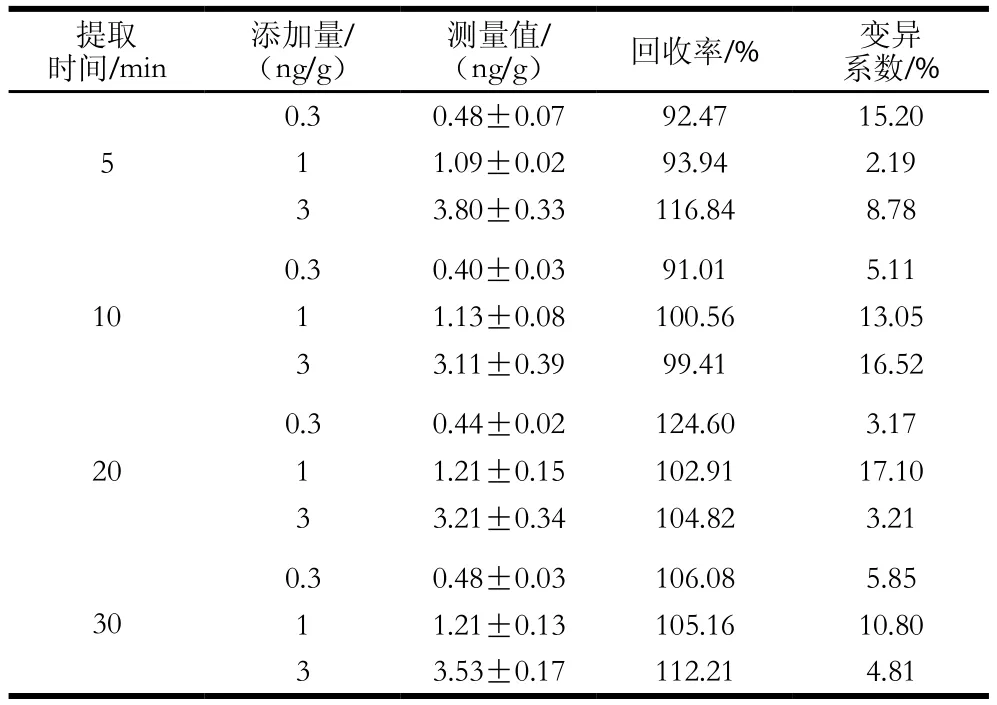
表2 不同提取时间添加回收率实验结果Table 2 Recoveries of chloramphenicol from spiked honey samples with different extraction times
如表2所示,不同提取时间条件下,样品的添加回收率均在90%~120%之间。5 min已可将样品中的CAP几乎完全提取出来。组织样品等其他样品的基质成分较蜂蜜更为复杂,为确保尽可能完全提取出各类样品中的CAP,又不至于使处理时间过长,故选择提取时间为10 min。
2.3 方法确证
2.3.1 蜂蜜样品中CAP的检出限和定量限结果
按照ELISA条件优化结果,本实验选取20 份空白蜂蜜样品,按照直接竞争ELISA方法测定。蜂蜜样品的检出限和定量限分别为0.15 ng/g和0.33 ng/g。
2.3.2 准确度结果
本实验对蜂蜜样品中CAP添加回收进行测定,如表3所示。选取3 个添加水平,分别为0.3、1 ng/g和3 ng/g,其回收率分别为100.94%、100.81%和97.58%,且批间和批内变异系数均小于11%,表明该方法准确度高。

表3 蜂蜜样品CAP添加回收实验结果Table 3 Recovery and precision of chloramphenicol from spiked honey sample
2.3.3 精密度结果
如表4所示,当CAP质量浓度为0.1 ng/mL时,变异较大,当质量浓度在0.3~8.1 ng/mL范围内,变异系数均小于10%,表明该方法重复性较好。
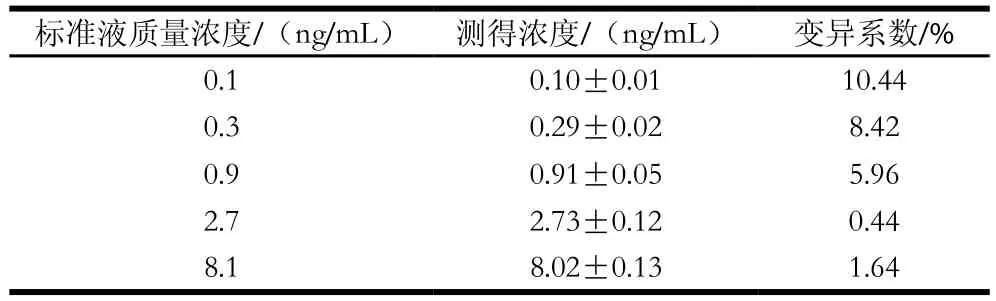
表4 批内变异(n=8)Table 4 Inter-assay coefficients of variation of the standard curve (n = 8)
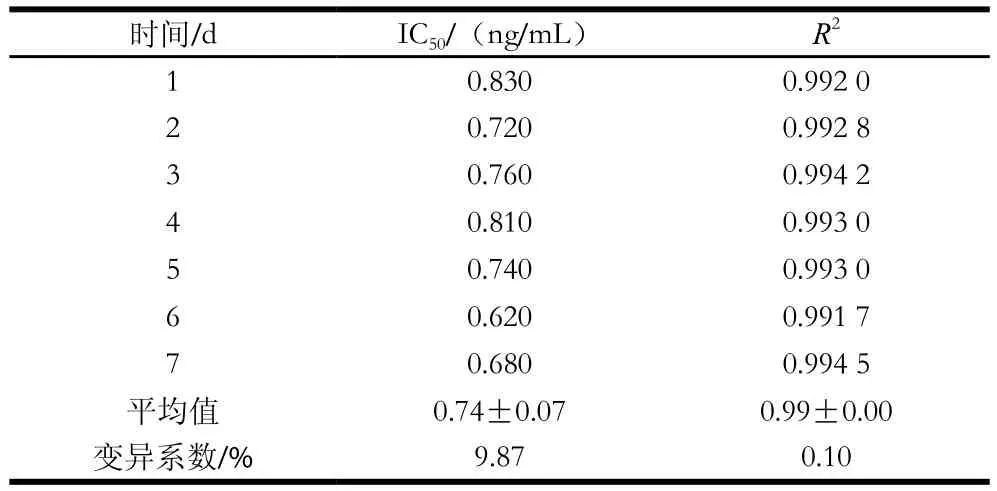
表5 批间变异(n=7)Table 5 Inter-assay coefficients of variation of the standard curve (n = 7)
如表5所示,不同时间内建立的标准曲线,IC50的变异系数均小于10%,表明所建立的方法重复性较好。
3 讨 论
ELISA方法的建立往往需要对反应条件进行优化[27-31]。郭逸蓉等[24]利用抗氯霉素琥珀酸单酯多克隆抗体作为包被原,建立CAP残留直接竞争ELISA检测试剂盒;采用方阵实验法,对包被多克隆抗体和酶标半抗原的稀释度进行优化,研究结果表明:所建立的直接竞争ELISA试剂盒对CAP的检测线(IC10)和线性范围分别为0.47 ng/mL和0.24~250 ng/mL,在虾肉、鸡肉、蜂蜜和鲜奶中的检测线为1~2 μg/kg,检测反应过程需要80 min左右。张立辰等[26]利用CAP单克隆抗体为包被原,优化了样品稀释液的离子强度和pH值,建立海产品中CAP残留直接竞争ELISA检测方法,其检测线IC15为(0.10±0.03) ng/mL,检测反应过程也需要80 min左右。Guo Lingling等[20]为建立CAP间接竞争ELISA检测方法,对包被原、甲醇浓度、NaCl含量、pH进行了优化,结果表明IC20~IC80为0.11~1.36 ng/mL。
本实验对CAP标准品稀释液、包被温度、包被抗体稀释倍数、酶标抗原稀释液、酶标抗原稀释倍数和竞争时间6 个单因素进行优化,建立最优CAP直接竞争ELISA方法,优化后的反应条件为:包被抗体稀释倍数1∶4 000,包被温度4 ℃,酶标记抗原稀释缓冲液为PBST,稀释倍数1∶4 000,最佳竞争时间25 min。在此条件下,建立的ELISA方法检出限可达(0.04±0.01) ng/mL,检测范围为0.10~4.17 ng/mL,检测反应时间需要40 min左右,满足国内外规定的CAP检出限。同时蜂蜜空白样品的检出限和定量限分别是0.15 ng/g和0.33 ng/g,回收率分别为97.58%、100.81%和100.94%,满足实际检测的需要。与前人CAP直接竞争ELISA检测方法相比,本研究所建立的方法检测限更低、检测反应过程耗时更短。
直接竞争ELISA法灵敏度高、操作简单,可同时进行大量样品的检测,非常适合现场监控和大量样本初筛。本研究建立的蜂蜜中CAP残留直接竞争ELISA检测方法,耗时短、灵敏度高,经液相色谱-质谱、气相色谱-质谱等仪器法进一步确定后,有望给直接竞争ELISA法试剂盒的商品化带来理论参考依据。
