巯基改性海泡石的制备及其吸附除镉性能
2018-08-31符云聪赵瑰施李鹏祥黎红亮刘代欢
符云聪,赵瑰施,张 义,刘 晨,李鹏祥,黎红亮,刘代欢
(1.湖南永清环保研究院有限责任公司,湖南长沙 410330;2.永清环保股份有限公司,湖南长沙 410330)
镉普遍存在于环境中,它容易通过工业废料进入水体中,如金属加工、电镀、制革厂、化学制造厂、冶金工程、矿业和电池厂都会产生镉污染[1-2]。许多研究显示镉能够引起肺水肿、痛痛病、肝损伤、肾功能不全、高血压和贫血等健康问题[3-4]。镉之类重金属的去除迫在眉睫。
去除水中重金属的方法主要有化学沉淀、混凝、共同沉淀、膜过滤、离子交换、电化学处理和吸附法[5]。这些方法中,吸附法去除污染物因其快速[6]、高效[7]、易操作和吸附剂种类丰富等优点通常被优先选择。因此,有必要寻找一种理想的低成本且高效的材料用于重金属镉的去除。近年来,海泡石作为吸附剂受到了广泛关注和研究,海泡石是一种天然的水合硅酸镁黏土矿物,其理论上的化学组分为 Mg4Si6O15(OH)2·6H2O,由硅氧四面体和镁氧八面体构成。构成海泡石硅氧四面体基础的氧,组成了连续晶层,并提供了大量的通道和孔洞[8]。这些通道中含有沸石水和可交换阳离子(K+和Ca2+),硅氧四面体最外缘的Si-O-Si 发生断裂,形成Si-OH,此基团大量存在于海泡石表面,是主要的活性中心,能与吸附物分子作用形成共价键并结合在一起[9]。巯基硅烷作为一种有机改性剂在一定条件下能与黏土矿物结合,且巯基有很强的络合能力,能很好地固定重金属离子,不易被洗脱[10]。因此,巯基改性海泡石引起了人们的关注,近年来也有部分关于巯基硅烷改性海泡石的研究[11-12]。然而,这些文献中少有关于巯基改性海泡石吸附除镉性能的研究。因此,关于巯基改性海泡石吸附除镉性能研究是有必要的,它有利于巯基改性海泡石在吸附去除镉领域的实际应用。
本试验用3-巯丙基三乙氧基硅烷改性天然海泡石,经过红外扫描发现巯基硅烷成功与海泡石结合,得到巯基改性海泡石。对改性后的海泡石进行吸附除镉性能研究试验,包括吸附等温线、吸附动力学、pH和盐离子强度对吸附镉的影响,通过这些试验展现了改性海泡石的吸附性能并揭示了其吸附镉的机制。
1 材料与方法
1.1 供试材料和仪器
吸附剂材料采用天然海泡石(标记为SEP)和3-巯丙基三乙氧基硅烷改性的海泡石(巯基改性海泡石标记为SEP-MPTES)。其他试验材料如3-巯丙基三乙氧基硅烷、无水乙醇、九水硝酸镉、氯化钠、氢氧化钠、浓盐酸等均为分析纯。所有溶液用去离子水配制(18 M Milli-Q)。红外光谱采用美国PerkinElmer公司的红外光谱仪,采用KBr压片,扫描范围为450~4 000 cm-1;SEM采用美国FEI quanta-200环境扫描电子显微镜;溶液中Cd2+浓度测定用电感耦合等离子体发射光谱仪-Thermo iCAP6300 Duo。
1.2 试验方法
1.2.1 巯基改性海泡石
改性海泡石的改性过程:3-巯丙基三乙氧基硅烷改性海泡石(SEP-MPTES)以天然海泡石为基础,先把10 g海泡石放入去离子水中搅拌混匀得到海泡石悬浊液(海泡石与水比为1∶20);然后在悬浊液中加入19.2 mL无水乙醇和2.4 mL 3-巯丙基三乙氧基硅烷混合剂室温搅拌6 h,用去离子水充分洗净,80 ℃烘干研磨制得。
1.2.2 水体吸附试验
饱和吸附试验:配制1 000 mg/L的硝酸镉溶液作为母液,稀释母液,配制一系列1~25 mg/L的硝酸镉溶液,分别量取40 mL置于100 mL离心管中,分别称取巯基改性海泡石和天然海泡石0.02 g加入各个浓度的Cd(Ⅱ)污染液中,材料与污液比为0.5 g/L,25 ℃恒温振荡24 h。按时取样,再经0.45 μm滤膜过滤,测定溶液中Cd2+浓度。每种处理,三个平行。数据采用Excel 2013进行整理,利用Origin 9进行数据拟合并制图。
吸附动力学试验:配制浓度为5 mg/L的硝酸镉溶液,分别称取巯基改性海泡石和天然海泡石0.25 g加入500 mL Cd(Ⅱ)污染液中,材料与污液比为0.5 g/L,25 ℃恒温振荡,在不同时间取样,再经0.45 μm滤膜过滤,测定溶液中Cd2+浓度。每种处理,三个平行。
pH对吸附镉的影响:配制浓度为5 mg/L的硝酸镉溶液,用氢氧化钠或盐酸调节pH值分别为3~8,分别称取巯基改性海泡石和天然海泡石0.02 g加入40 mL Cd(Ⅱ)污染液中,材料与污液比为0.5 g/L,25 ℃恒温振荡24 h,按时取样,再经0.45 μm滤膜过滤,测定溶液中Cd2+浓度。每种处理,三个平行。
盐离子强度对吸附镉的影响:配制浓度为5 mg/L的硝酸镉溶液,添加氯化钠调节离子强度分别为0.01~0.1 mol/L,分别称取巯基改性海泡石和天然海泡石0.02 g加入40 mL Cd(Ⅱ)污染液中,材料与污液比为0.5 g/L,25 ℃恒温振荡24 h,按时取样,再经0.45 μm滤膜过滤,测定溶液中Cd2+浓度。每种处理,三个平行。
吸附容量qe(mg/g)计算如式(1)。
(1)
其中:C0—镉的初始浓度,mg/L;
Ce—镉的最终浓度,mg/L;
V—体积,mL;
m—质量,mg。
2 结果与讨论
2.1 FTIR分析
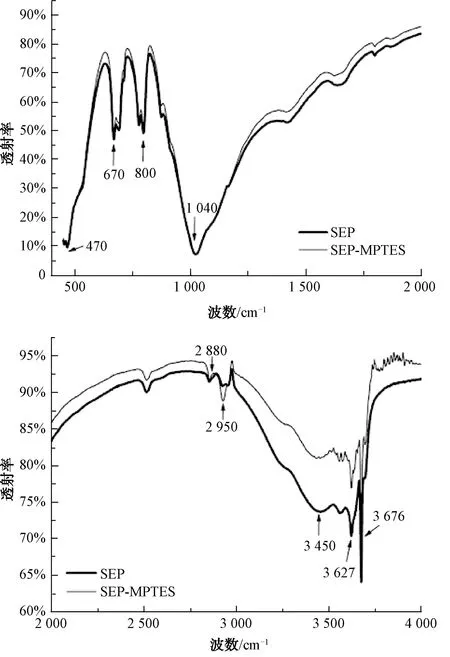
图1 海泡石及改性海泡石的红外光谱图Fig.1 FTIR Spectra of Sepiolite and Modified Sepiolite

2.2 SEM分析
如图2所示,海泡石和改性海泡石的表面形态用扫描电子显微镜进行表征。由图2可知,海泡石和改性海泡石均为层片状结构。海泡石(a)层片状结构相互堆积比较严实,孔隙较少且体积较大、比表面积小;改性海泡石(b)层片状结构比较松散,孔隙较多且体积较小、比表面积大。改性后比表面积增大,孔隙增多,更有利于重金属离子与改性海泡石的结合点位反应。

图2 海泡石(a)及改性海泡石(b)的扫描电子显微镜图片Fig.2 SEM Patterns of Sepiolite(a) and Modified Sepiolite(b)
2.3 吸附等温线
为了探索巯基改性海泡石(SEP-MPTES)和天然海泡石(SEP)对Cd(Ⅱ)的吸附机制,用Langmuir 和Freudlich拟合吸附等温线,两个方程[14]分别如式(2)、式(3)。
(2)
(3)
其中:Ce—材料吸附Cd(Ⅱ)的平衡浓度,mg/L;
qe—Cd(Ⅱ)平衡吸附容量,mg/g;
qm—Cd(Ⅱ)最大吸附容量,mg/g;
b—Langmuir常数,L/mg;
n、kf—Freundlich等温吸附常数。
Langmuir和Freundlich吸附等温线如图3所示,相关拟合参数如表1所示。两种材料对Cd(Ⅱ)的吸附符合Langmuir方程相关系数,R2均≥0.95。Langmuir模型比Freundlich模型更适合此吸附过程,说明此吸附过程是发生在均匀表面的单层吸附。
由表1可知,Langmuir拟合发现SEP-MPTES对Cd(Ⅱ)的最大吸附容量(8.87 mg/g)是天然海泡石(3.42 mg/g)的2.59倍。吸附容量提高是因为巯基基团的接入增加了海泡石的吸附位点,除了天然海泡石所具有的静电吸附、离子交换吸附和羟基配位吸附,巯基改性海泡石还多了巯基配位吸附[10,15],巯基配位吸附进一步提高了海泡石对Cd(Ⅱ)的吸附容量。材料表面的巯基基团能够与重金属离子通过共价结合的方式,直接生成稳定的内层配合物或通过静电结合反应生成外层配合物[11]。
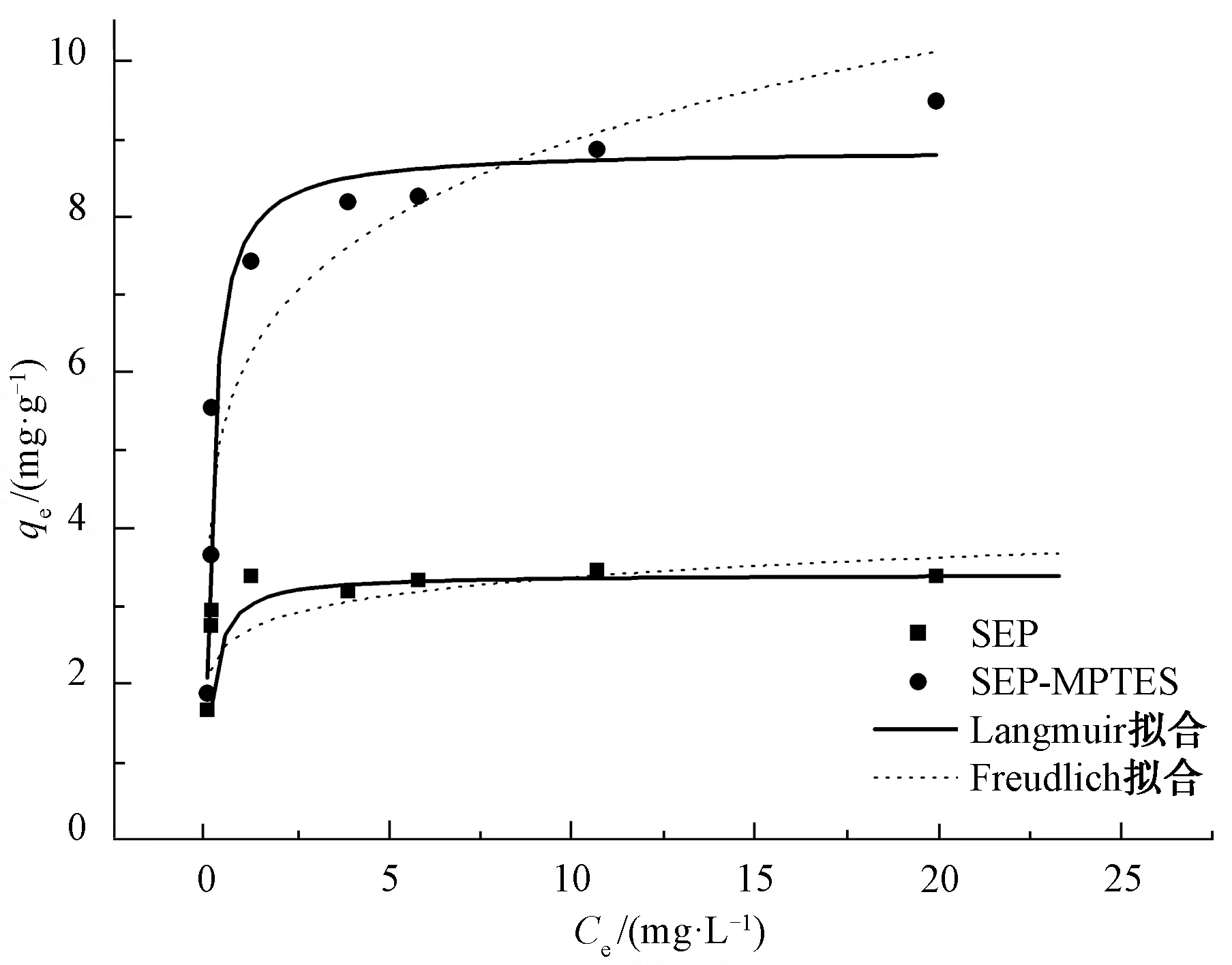
图3 海泡石及巯基改性海泡石吸附Cd(Ⅱ)的Langmuir和Freundlich拟合模型Fig.3 Langmuir and Freundlich Fitting Model for Cd(Ⅱ) Adsorption by SEP and SEP-MPTES

表1 海泡石和巯基改性海泡石吸附Cd(Ⅱ)的Langmuir和Freundlich拟合参数Tab.1 Langmuir and Freundlich Fitting Parameters for Cd(Ⅱ) Adsorption by SEP and SEP-MPTES
2.4 吸附动力学
如图4所示,利用假一级动力学方程和假二级动力学方程对试验数据进行拟合,发现该吸附过程符合假二级动力学过程,两个方程[16]如式(4)、式(5)。
ln(qe-qt)=lnqe-k1t
(4)
(5)
其中:k1—假一级动力学方程的速率常数,s-1;
k2—假二级动力学方程的速率常数,g/(mg·s);
qe—平衡吸附容量,mg/g;
qt—t时间下的吸附容量,mg/g。

图4 海泡石及巯基改性海泡石吸附镉的动力学模型Fig.4 Pseudo-First-Order and Pseudo-Second-Order Kinetic Fitting Model for Cd(Ⅱ) Adsorption by SEP and SEP-MPTES
如表2所示,相关系数R2比较发现,SEP和SEP-MPTES在假二级动力学方程中更好,均达到了0.9以上,说明SEP和SEP-MPTES对水体中Cd(Ⅱ)的吸附更符合假二级动力学方程。

表2 海泡石和巯基改性海泡石吸附镉的假一级和假二级动力学参数Tab.2 Pseudo-First-Order and Pseudo-Second-Order Kinetic Fitting Parameters for Cd(Ⅱ) Adsorption by SEP and SEP-MPTES
2.5 pH对吸附镉的影响
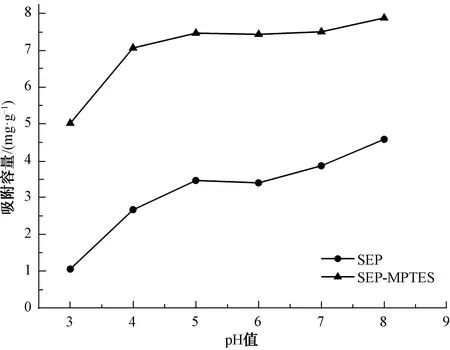
图5 pH值对海泡石及巯基改性海泡石吸附Cd(Ⅱ)的影响Fig.5 Effect of pH Value on Cd(Ⅱ) Adsorption by SEP and SEP-MPTES
pH对海泡石及巯基改性海泡石吸附镉的影响如图5所示,随着pH值从3升至8,SEP和SEP-MPTES对镉的吸附容量分别从1.06 mg/g升至4.58 mg/g,从5.02 mg/g升至7.88 mg/g。吸附容量随着pH的升高而升高,当pH值为8时,吸附容量达到最大。酸性条件下,大量的氢离子与Cd(Ⅱ)离子竞争吸附位点,使得SEP和SEP-MPTES对Cd(Ⅱ)的吸附容量降低;或是巯基基团的硫质子化从而降低巯基基团螯合Cd(Ⅱ)的能力[17],使得SEP-MPTES对Cd(Ⅱ)的吸附容量降低。同样,随着pH降低,带负电荷的吸附位点减少,正电荷的吸附位点增加,静电排斥不利于吸附带正电的镉离子。因此,随着pH升高,镉离子与海泡石表面静电吸附增加,从而达到更高的吸附容量[18]。在pH值为3~8时,SEP-MPTES比SEP对Cd(Ⅱ)的吸附容量更高,表明SEP-MPTES与天然海泡石相比是更加有效的吸附Cd(Ⅱ)材料。
2.6 离子强度对吸附镉的影响

图6 盐离子强度对海泡石及巯基改性海泡石吸附镉的影响Fig.6 Effect of Ionic Strength (NaCl) on Cd(Ⅱ) Adsorption by SEP and SEP-MPTES
盐离子强度对海泡石及巯基改性海泡石吸附镉的影响如图6所示,随着钠离子浓度从0 mol/L升高至0.1 mol/L,SEP和SEP-MPTES吸附镉容量逐渐降低。离子强度大范围变化影响了镉的表面吸附,重金属离子在水中的活度系数与重金属离子和电解质含量有关。当电解质浓度增加,材料界面会被压缩,吸附容量降低[19];也可能是钠离子作为竞争离子在海泡石表面发生了静电吸附或是离子交换吸附,减少了海泡石上的吸附位点,从而导致对镉的吸附容量降低。如图6所示,当钠离子浓度大于0.05 mol/L时,SEP对镉的吸附容量基本保持不变,表明电性吸附点位吸附阳离子已经饱和,吸附容量不受离子强度的影响。钠离子浓度提高更容易影响SEP-MPTES对镉的吸附,说明改性后增加的巯基基团吸附位点受到钠离子的影响,一定程度上抑制了巯基对镉的化学吸附。其中,当钠离子浓度在0.05~0.1 mol/L时,SEP-MPTES中的巯基对镉的化学吸附受到钠离子的影响最大,说明SEP-MPTES对镉的吸附机制以化学吸附为主,物理吸附为辅[20]。
3 结论
(1)巯基改性海泡石的红外表征测试分析显示,3-巯丙基三乙氧基硅烷成功地结合在天然海泡石上。
(2)Langmuir和Freundlich吸附等温线拟合可知,巯基改性海泡石吸附镉反应更适合Langmuir吸附模型,巯基的加入进一步提高了海泡石的饱和吸附容量,海泡石改性后对Cd(Ⅱ)的饱和吸附容量为改性前的2.59倍。
(3)假一级动力学方程和假二级动力学方程拟合可知,巯基改性海泡石与Cd(Ⅱ)的反应更适合假二级动力学方程。
(4)随着pH值从3升至8,巯基改性海泡石对Cd(Ⅱ)的吸附容量随着pH升高而升高,当pH值为8时,吸附容量达到最大。
(5)随着钠离子浓度从0 mol/L升高至0.1 mol/L,巯基改性海泡石对镉的吸附容量逐渐降低。
