转化生长因子-β信号通路抑制剂对胚胎干细胞定向分化的影响
2018-08-31张念平
刘 浩 赵 燕 张 晓 张念平
(济南市第三人民医院,山东 济南 250032)
胚胎干细胞(ESCs)具有很强的自我更新能力和增殖分化能力,是细胞移植治疗神经退行性疾病和脊髓损伤比较理想的细胞来源〔1,2〕。对神经细胞移植来说,应尽可能获得足够数量的、均一的神经细胞亚型,避免杂细胞污染。虽然已经发现许多关键细胞因子〔如成纤维细胞生长因子(FGF)、单羧酸转运体(MCT)8、音猬因子(SHH)和空通气孔同源框(EMX)2等〕与ESCs的神经分化相关〔3〕,但目前的诱导方法仍不能使所有的ESCs分化为神经类细胞〔4,5〕。转化生长因子(TGF)-β通过控制一系列细胞生理进程(如细胞增殖、迁移、凋亡等)来影响生物体稳态平衡及多个器官和系统的发育〔6〕。近年来有大量文献报道TGF-β信号通路在ESCs的多能性维持、自我更新能力维持及细胞命运决定等方面发挥重要作用〔7~9〕。本实验在文献报道的神经诱导方法的基础上,联合使用两种TGF-β抑制剂对ESCs进行诱导分化,探讨TGF-β信号通路在ESCs向神经干细胞(NSCs)分化过程中的作用,并观察ESCs来源的NSCs向神经细胞分化的能力。
1 材料和方法
1.1小鼠胚胎成纤维细胞(MEF)制备 取妊娠13.5 d的小鼠,脱臼处死后置于75%酒精中浸泡5 min。剖腹后取出子宫,用含1%双抗的磷酸盐缓冲液(PBS)冲洗3次。取出胎鼠并去除头尾、四肢和内脏,将剩余组织用PBS洗3次。以剪刀剪碎组织,加入0.25%的胰酶(碧云天公司,中国)消化3~5 min,MEF培养基终止消化。1 000 r/min离心5 min,弃上清,加入MEF培养基吹打均匀后移入10 cm培养皿,2~3 d传代一次。取第3~4代细胞,以10 μg/ml的丝裂霉素C(Sigma-Aldrich公司,美国)处理备用。MEF培养基:89%达尔伯克改良伊格尔培养基(DMEM)高糖(Gibco公司,美国)、10%胎牛血清(浙江天杭生物科技股份有限公司,中国)、1%双抗(碧云天公司,中国)。
1.2ESCs培养 将经丝裂霉素C处理的MEF细胞按3×104/cm2密度接种至0.1%明胶包被的培养皿上,使用MEF培养基培养,24 h后细胞完全贴壁铺展开。将小鼠ESCs细胞(R1)接种在MEF细胞上,以ESCs培养基培养,每天换液。每2~3 d将ESCs细胞连同MEF细胞以0.05%的胰酶消化,再以1.5×104/cm2的密度接种至新的MEF细胞上。ESCs培养基:82%DMEM高糖、15%胎牛血清(FBS,Serana公司,德国)、1% 非必需氨基酸(Gibco公司,美国)、0.1 mmol/L 2-巯基乙醇(广东翁江化学试剂有限公司,中国)、2 mmol/L L-谷氨酰胺(Gibco公司,美国)、1 000 U/ml LIF(leukemia inhibitory Factor,PeproTech公司,美国)、1% 双抗(碧云天公司,中国)。
1.3ESCs的定向分化 ESCs向NSCs诱导分化参考Ying等〔10〕的单层分化方法:将ESCs连同MEF消化后,差速贴壁两次(每次30 min),以去除MEF细胞。收集未贴壁的ESCs细胞,以(0.5~1.5)×104/cm2的密度种到0.1%明胶包被的培养皿中,使用N2B27培养基培养。其中实验组培养基中加TGF-β抑制剂:1 μmol/L的A83-01(MedChemExpress公司,美国)和100 μg/L的Noggin(R&D Systems公司,美国),对照组不加。每2 d换液一次,培养9 d即可获得NSCs。ESCs来源的NSCs向神经细胞分化:将实验组和对照组来源的NSCs以(2~3)×104/cm2的密度种到多聚-D-赖氨酸包被的培养皿中,以分化培养基培养7 d。ESCs来源的NSCs向多巴胺(DA)能神经元诱导分化参照文献报道的方法〔4,10〕。N2B27培养基:DMEM/F12培养基中加入0.5%的N2和1%的B27(Thermo Fisher Scientific公司,美国)。分化培养基:N2B27培养基中加入0.2 mmol/L的L-抗坏血酸(Sigma-Aldrich公司,美国),20 ng/ml的脑源性神经营养因子(BDNF,R&D Systems公司,美国)与1 μmol/L的环磷酸腺苷(南京奥多福尼生物科技有限公司,中国)。
1.4免疫荧光染色 吸弃培养皿中的培养基,PBS洗一次。4%的多聚甲醛固定20 min,PBS洗3次,每次5 min。吸弃上清,加5%~10%的牛血清白蛋白(BSA)封闭30 min。吸弃BSA后直接加一抗4℃过夜。第2天取出,室温孵育30 min,PBS洗3次,每次5 min。加入荧光二抗(博士德公司,中国),室温孵育1~2 h,PBS洗3次,每次5 min。加4′,6-二脒基-2-苯基吲哚二盐酸盐(DAPI)染色15 min,PBS洗3次,每次5 min。以甘油缓冲液封片,在荧光显微镜下观察。一抗分别为Nestin(Santa Cruz公司,美国)、β-tubulinⅢ(CST公司,美国)、微管相关蛋白(MAP)2(Abcam公司,英国)、酪氨酸羟化酶(TH)(CST公司,美国)。
1.5实时荧光定量PCR(qRT-PCR) 以Trizol法提取总RNA,测OD值定量RNA浓度,纯度和质量好的RNA样品OD260/OD280比值应在1.9~2.1。将mRNA逆转录成cDNA,选β-actin为内参基因,用荧光定量试剂盒(大连TakaRa公司,中国)在ABI7500荧光定量PCR仪上进行qRT-PCR反应(相关引物见表1)。结果分析使用比较阈值法来检测目的基因的相对表达量,相对表达量计算公式:RQ=2-△△CT,其中 △△CT=(CT实验组目的基因-CT实验组内参基因)-(CT对照组目的基因-CT对照组内参基因)。
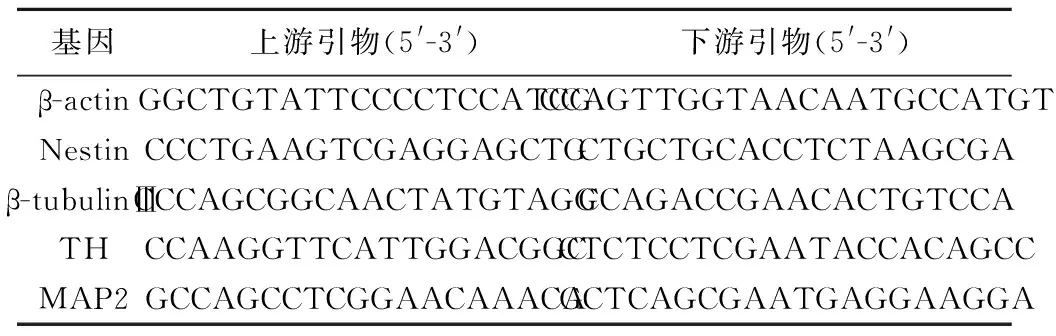
表1 qRT-PCR所需引物及其序列
1.6细胞形态学观察和计数 荧光染色以后,从至少3次独立的分化实验中随机选择10个视野,分别对各个荧光下的细胞进行拍照,双标的需要用Image-pro plus6.0软件对图像进行叠加处理。DAPI核染色阳性为总细胞数,根据荧光颜色计单标、双标的阳性细胞数。阳性细胞率=阳性细胞数/总细胞数×100%。对计数结果进行统计学分析。
1.7统计学分析 实验至少重复3次,使用软件SPSS18.0进行t检验。
2 结 果
2.1TGF-β抑制剂对ESCs向NSCs分化的影响 ESCs经N2B27培养基诱导9 d后,进行NSCs标志物Nestin的免疫荧光染色(见图1)。Nestin阳性细胞呈红色,细胞细长,部分细胞呈放射状排列。实验组和对照组均可见明显的神经上皮细胞形成的典型结构──神经花环结构。细胞计数结果显示,对照组Nestin阳性率(60.100%±2.900%)显著低于实验组(69.600%±0.780%,P<0.01)。qRT-PCR结果表明实验组中Nestin基因的表达水平(1.803±0.296)明显高于对照组(1.000±0.076,P<0.05)。
2.2TGF-β抑制剂对ESCs向神经元分化的影响 实验组和对照组的ESCs经单层贴壁培养诱导为NSCs后,继续以分化培养基培养7 d,然后进行β-微管蛋白Ⅲ(β-tubulinⅢ,神经元早期标志物)免疫荧光染色(图2)。荧光显微镜下见β-tubulinⅢ阳性细胞呈绿色,胞体较NSCs明显增大,呈梭形或椭圆形,有1~2条细长突起自胞体发出。对照组β-tubulinⅢ阳性率(26.400%±1.442%)明显低于实验组(42.900%±2.961%,P<0.001)。qRT-PCR结果表明实验组β-tubulinⅢ表达量比对照组提高47.1%(P<0.001),对照组为1.000±0.032,实验组为1.471±0.062。
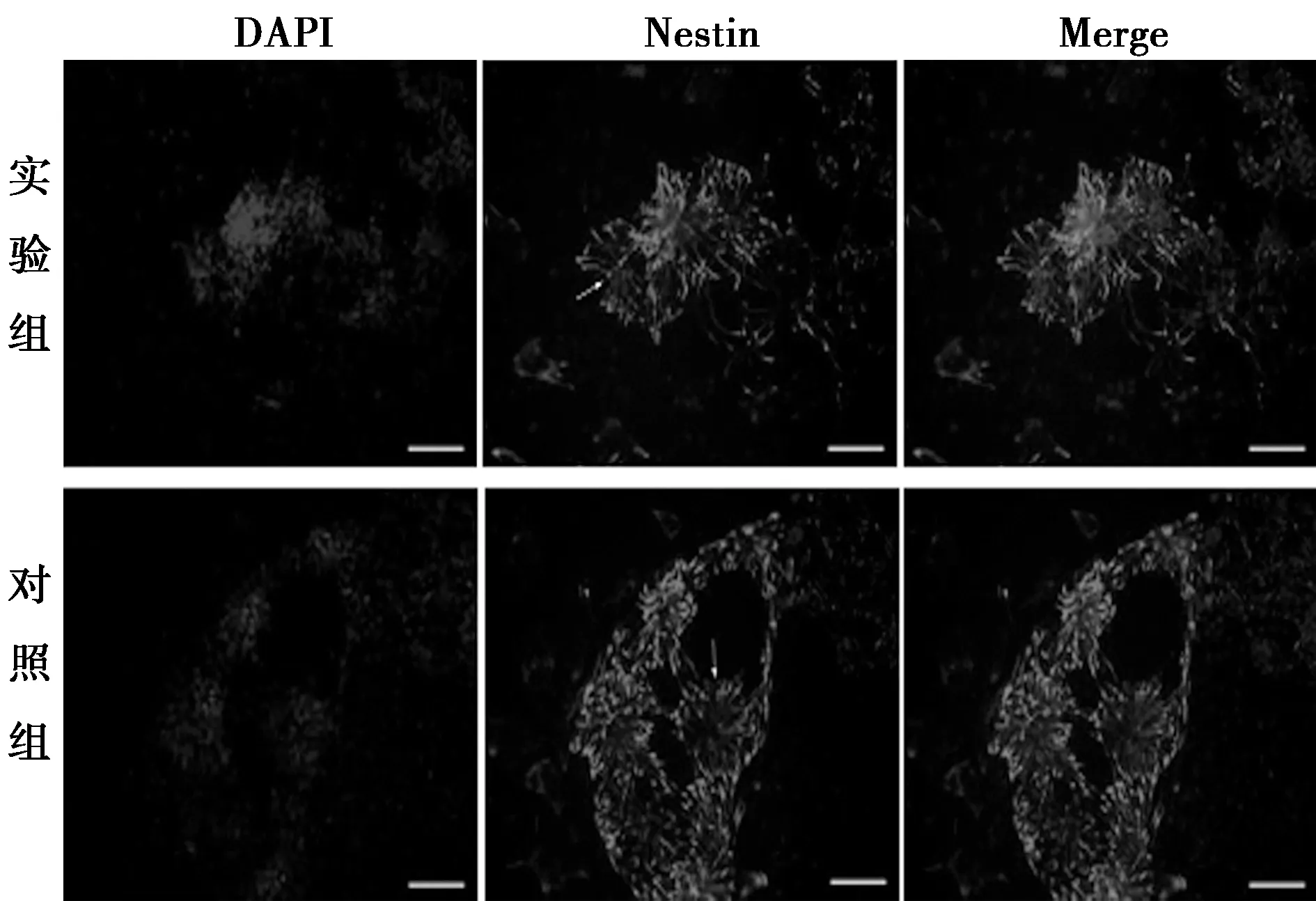
标尺=100 μm;下图同图1 ESCs在N2B27培养基中培养9 d后,进行Nestin免疫荧光染色)
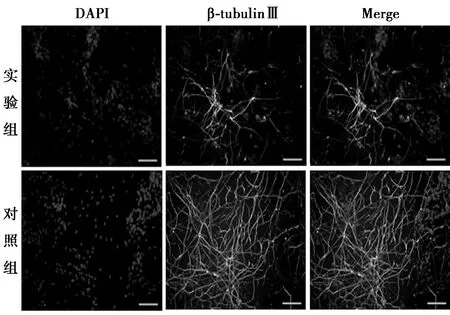
图2 实验组和对照组的NSCs经分化培养基培养7 d后,进行β-tubulinⅢ免疫荧光染色
2.3TGF-β抑制剂对ESCs向DA能神经元分化的影响 将实验组和对照组来源的NSCs向DA能神经元诱导分化后,进行MAP2(成熟神经元标志物)和TH(DA神经元标志物)染色。MAP2阳性细胞为红色,TH阳性细胞呈绿色,MAP2和TH均为阳性的细胞,图片经叠加呈现黄色(见图3)。可见TH阳性细胞均为MAP2阳性,而MAP2阳性细胞仅部分为TH阳性,这表明分化终末的成熟神经元中只有一部分细胞是DA能神经元。TH+/MAP2+阳性细胞轮廓清晰,胞体大而饱满,呈类圆形或椭圆形,发出一个或两个细长突起,部分细胞也可见胞体发出分支较多的树突。对照组TH+/MAP2+阳性率为7.100%±0.768%,实验组为14.000%±1.550%,差异有统计学意义(P<0.01)。qRT-PCR结果显示,实验组多巴胺能神经元标志物TH(1.353±0.045)和成熟神经元标志物MAP2的表达量(1.252±0.031)分别比对照组(1.000±0.052、1.000±0.014)提高35.3%(P<0.01),25.2%(P<0.05)。
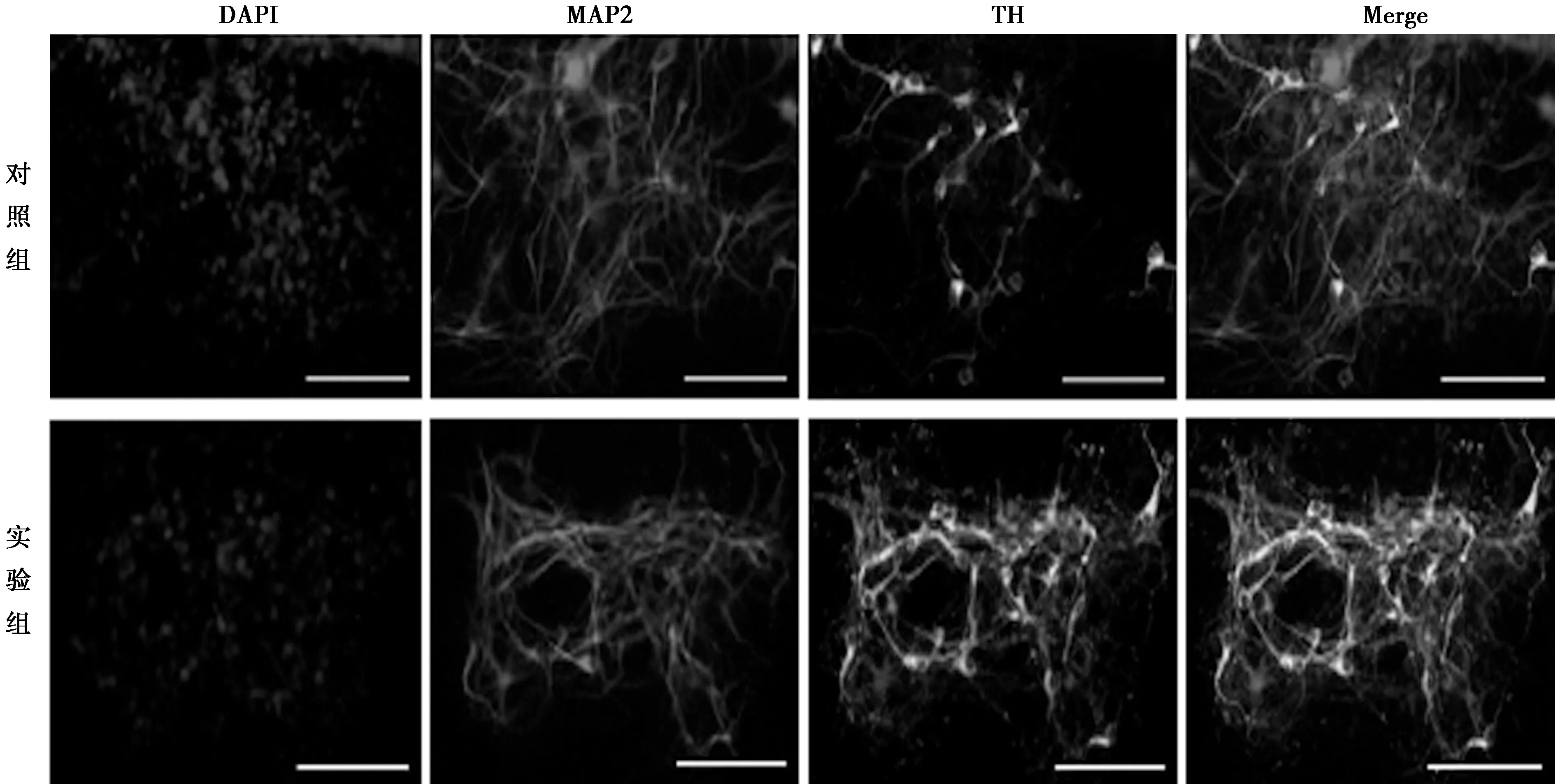
图3 将实验组和对照组的NSCs向DA能神经元诱导后,进行TH、MAP2免疫荧光染色
3 讨 论
脊椎动物TGF-β超家族根据配体不同可以划分为两个亚家族:①TGF-β/活化素(Activin)/Nodal亚家族;②骨形态发生蛋白(BMP)/生长分化因子(GDF)/苗勒管抑制物(MIS)亚家族〔6〕。TGF-β信号通路的受体包括Ⅰ型受体(也叫ALK受体)和Ⅱ型受体。在进行信号传导时,Ⅰ型受体和Ⅱ型受体组成的复合物与TGF-β超家族的配体结合,导致Ⅱ型受体首先被激活,激活的Ⅱ型受体随后磷酸化Ⅰ型受体。活化的Ⅰ型受体又进一步激活受体活化型Smad蛋白(R-Smads),R-Smads与共同通路型Smad 蛋白(Co-Smad4)结合并进入细胞核,调控下游基因的转录〔11〕。TGF-β超家族在细胞生长迁移、增殖分化、生存凋亡等过程中发挥重要作用〔12,13〕,文献报道同时抑制TGF-β信号通路的两个亚家族能促进多能性干细胞向神经谱系分化〔14〕。
TGF-β/Activin/Nodal亚家族能维持ESCs的多能性,抑制这些信号通路可触发ESCs分化〔15〕。BMP信号通路是BMP/GDF/MIS亚家族的一个分支,它抑制ESCs的神经分化〔16〕。BMP-4是BMP信号通路的一个重要成员,BMP-4除了能维持ESCs的自我更新能力外,还能抑制神经分化而促进细胞表达与中胚层分化相关的标志物〔16,17〕。A83-01通过选择性抑制TGF-β的Ⅰ型受体ALK5、Activin/Nodal的Ⅰ型受体ALK4和Nodal的Ⅰ型受体ALK7来阻断TGF-β/Activin/Nodal信号通路〔18〕。而Noggin能高亲和力的结合BMP2、BMP4、BMP7,阻止它们与受体结合从而促使ESCs向神经谱系分化〔15〕。需要值得注意的是,在Ying等〔10〕的单层贴壁培养神经诱导方法中,ESCs在N2B27培养基中培养4 d,就有超过60%的细胞表达Sox1(一个重要的NSCs标志物),这说明绝大多数ESCs的分化命运在早期就已经被决定。而TGF-β信号通路在早期胚胎的神经诱导过程中发挥关键作用,神经发育的“默认模式”(default model)理论认为消除TGF-β信号可使胚胎细胞获得向神经元分化的命运,这个过程无须伴随形成中、内胚层细胞〔8〕。
本文表明经TGF-β抑制剂处理的ESCs更容易分化为DA能神经元。在早期大脑发育过程中,中脑DA能神经元起源于中脑腹侧中线,它的发育依赖于两个关键的脑部中心(底板、峡部)所产生的分化信号:SHH、FGF8和Wnt-1〔19〕,其中SHH和FGF8的共同作用是神经管中不同位置的DA能神经元形成的充分必要条件〔20〕。BMP来源于神经管背侧,能拮抗分泌自底板的SHH,削弱SHH信号通路的作用〔21〕。当使用抑制剂阻断了BMP的活性后,可增强细胞对SHH的反应性〔22〕。这可能从一方面解释了使用TGF-β抑制剂后ESCs向DA能神经元分化增多的原因。
本研究表明TGF-β信号通路在调控ESCs神经分化过程中发挥重要作用。然而,控制ESCs神经分化的细胞因子和信号通路繁多且复杂,还可能与TGF-β信号通路发生串话(cross talking)作用,这需要进一步的研究。
