基于单中心的胃混合性腺神经内分泌癌临床病理特征及预后分析
2018-08-30周宇红刘天舒
徐 蓓,周宇红,纪 元,王 妍,刘天舒
复旦大学附属中山医院肿瘤内科,上海 200032
2010年世界卫生组织(World Health Organization,WHO)命名的混合性腺神经内分泌癌(mixed adenoneuroendocrine carcinoma, MANEC)是一类非常罕见的恶性肿瘤,之前被称为腺类癌和混合性外分泌-内分泌癌等,好发于胃肠管、食管和胆囊等处[1-2]。MANEC由腺癌和神经内分泌癌2种恶性成分组成,且这2种成分的比例均不低于整个肿瘤细胞群的30%。由于发病率较低,目前缺乏关于MANEC起源、组织学特征和临床特点的深入研究。因此,本研究回顾性分析了复旦大学附属中山医院收治的胃MANEC患者的临床特点及预后,为更深入地认识胃MANEC并探索进一步的临床诊疗策略提供依据。
1 资料与方法
1.1 一般资料 收集2014年11月至2015年12月就诊于复旦大学附属中山医院,经病理确诊的胃MANEC患者14例。其中,男13例(92.86%),女1例;年龄范围54~85岁,平均年龄(63.43±9.08)岁。纳入的14例患者起病时多为非特异性腹部不适症状,1例出现反复发作的腹泻、稀水便,3例出现急性上消化管出血,1例反复低热,1例幽门不全性梗阻。术中获得的病理组织采用免疫组织化学法检测突触素(synaptophysin,SYN)、人类表皮生长因子受体2(human epidermal growth factor receptor-2,HER-2)和c-MET蛋白表达情况。本研究经医院伦理委员会审核,所有患者均知情同意并签署知情同意书。
1.2 辅助检查及病理诊断 14例患者均因腹部不适症状行胃镜检查,发现胃部占位性病变,并行活检。手术前及手术后行胸腹部增强计算机断层扫描(computed tomography,CT)检查和/或上腹部磁共振(magnetic resonance imaging,MRI)检查,以明确病灶部位及有无远处转移。最终诊断经术后病理确诊,诊断标准参照2004年WHO标准。本研究所有14例患者的病理和免疫组织化学检测结果均指定专人重新复核和记录。
1.3 随访和疗效评估 通过查阅病历资料,对全部14例患者的临床资料进行回顾性研究。所有患者于术后每半年定期在本院进行影像学和肿瘤指标复查。电话随访患者生存时间,随访截止时间为2017年11月30日。无进展生存期(PFS)为自确诊之日至患者病情进展或末次随访日的时间间隔。总生存期(OS)为自确诊之日至末次随访日或患者死亡的时间间隔。按照实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)1.1版本进行疗效评估。
1.4 统计学处理 采用SPSS 18.0软件进行数据分析,计数资料分析采用χ2检验,Kaplan-Meier法绘制生存曲线,运用COX比例风险回归模型对患者性别、年龄、淋巴结转移、TNM分期及病理特点等进行单因素或多因素预后分析。采用双侧检验,检验水准(α)为0.05。
2 结 果
2.1 患者一般资料 结果(表1)表明:14例患者病理类型均为MANEC,即癌组织部分呈腺癌,部分呈神经内分泌癌,且每种成分所占比例均高于或等于30%。其中,病灶位于近端8例(54.1%),远端6例(42.9%);胃小弯10例(71.4%),胃大弯4例(28.6%);血清肿瘤指标癌胚抗原(carcinoembryonic antigen,CEA)升高6例(42.9%),糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)升高3例(21.4%)。1例患者既往有硬皮病病史8年,长期口服雷公藤和吗替麦考酚酯治疗;1例因胃腺癌于2年前行胃癌根治术,此次出现胃MANEC而行残胃癌根治术。
PFS:无进展生存期;OS:总生存期
2.2 治疗及随访情况 所有患者均接受手术治疗,13例(92.9%)为根治性手术,1例为姑息性手术;术后1例患者出现双肺动脉多发栓塞。6例(42.9%)患者接受术后辅助化疗,其中3例化疗方案为6个周期的SOX(奥沙利铂+替吉奥)方案,2例为6个周期的XELOX(奥沙利铂+卡培他滨)化疗方案,之后均再行替吉奥单药口服治疗2个周期;其中1例患者因为高龄且体质较弱,予替吉奥单药口服辅助化疗3个月后死亡,随访时间为4.4个月。另有1例患者先行5个周期XELOX方案的新辅助化疗,然后接受根治性手术,术后再次接受4个周期XELOX方案辅助化疗。
所有患者随访时间为4.4~36.7个月,中位随访时间为24.2个月。随访期间6例患者病情进展,6例(42.9%)患者死亡。其中1例患者在随访过程中发现单发脑转移和多发骨转移,并于确诊进展后2个月死亡。
2.3 患者组织病理学特征 按2010年美国癌症联合会(American Joint Committee on Cancer,AJCC)第7版胃神经内分泌肿瘤(neuroendocrine tumors,NET)分期系统进行分期诊断。结果(表2)表明:Ⅱ期患者5例(35.7%),Ⅲ期患者9例(64.3%)。肿瘤分化程度:中等分化5例(35.7%),低分化9例(64.3%)。Lauren分型中,肠型9例(64.3%),混合型2例(14.3%),弥漫型3例(21.4%)。腺癌所占比例平均为(42.14±12.51)%;腺癌成分的T分期:T1期1例(7.1%),T2期3例(21.4%),T3期10例(71.4%)。
所有患者的神经内分泌癌成分均为G3级(即Ki-67阳性指数>20%),所占比例平均为(57.86±12.51)%,且均不属于形态上分化良好且具有高增殖活性的NET G3。神经内分泌癌成分的T分期分别为:T2期6例(42.9%),T3期4例(28.6%),T4期4例(28.6%)。
伴癌栓者共9例(64.3%),其中癌栓检出腺癌成分4例,检出神经内分泌癌成分5例。神经束侵犯11例(78.6%),其中检测到腺癌成分7例,检测到神经内分泌癌成分4例。淋巴结转移阳性9例(64.3%),转移成分为单纯神经内分泌癌3例,单纯腺癌2例,2种成分皆有4例。
免疫组织化学和FISH检测结果(表3)提示:腺癌成分中HER-2阳性患者2例(14.3%,均经FISH检测再次证实),HER-2阴性12例;c-MET阳性患者11例(78.6%),c-MET阴性3例;神经内分泌癌成分中SYN阳性患者14例。
2.4 预后分析 单因素分析显示,神经内分泌癌成分的T分期是预后的不良因素(P=0.003,表2)。单因素和多因素分析均提示肿瘤的部位(远近端和大小弯侧)、患者发病时血清CEA与CA19-9水平、TNM分期、术后是否接受辅助化疗、腺癌成分的分化程度、Lauren分型、癌栓情况、神经束侵犯、淋巴结转移情况以及HER-2与c-MET的表达情况与患者生存无明显相关,组间差异均无统计学意义(表1~表3)。

表2 胃MANEC患者的临床病理特征与预后 N=14
PFS:无进展生存期;OS:总生存期

表3 胃MANEC患者HER-2和c-MET表达与预后的关系
PFS:无进展生存期;OS:总生存期
2.5 典型病例介绍 患者男性,77岁,因上腹部不适起病。行胃镜检查发现近小弯侧溃疡型肿块,遂行胃癌根治术。术后病理提示:(远端胃)溃疡型MANEC,腺癌成分为黏液腺癌,约占30%;神经内分泌癌成分约占70%,Ki-67指数为70%,核分裂象易见,癌组织浸润至胃壁浆膜层,脉管见癌栓,神经束见癌侵及;切缘阴性。检出小弯侧淋巴结16枚,其中5枚见神经内分泌癌转移,2枚见混合性癌转移;检出大弯侧淋巴结20枚,其中11枚见神经内分泌癌转移,6枚见混合性癌转移,另见2枚混合性癌结节。免疫组化染色(图 1):腺癌成分HER-2阴性,神经内分泌癌成分c-MET(70%阳性),Ki-67(密集区70%阳性)。由于患者高龄且体质较弱,予替吉奥单药口服辅助化疗3个月后死亡,随访时间共计4.4个月。
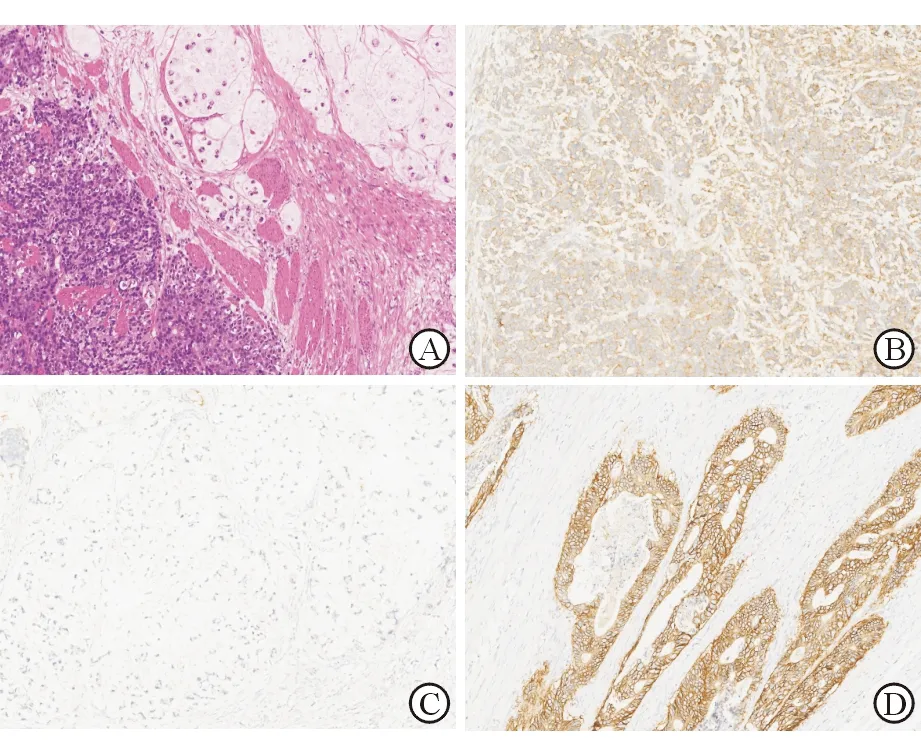
图 1 典型患者术后病理H-E及免疫组化染色
A:H-E染色;B:c-MET免疫组化染色阳性;C:免疫组化染色HER-2阴性;D: 免疫组化染色HER-2阳性对照.Original magnification:×200(A), ×100(B,C,D)
3 讨 论
神经内分泌肿瘤(NET)是一类来源于神经内分泌系统的肿瘤,多见于胃、肠、胰腺等消化系统和肺部。美国2004年NET发病率为5.25/10万人,约占所有恶性肿瘤的1%~2%;而且,近年来无论是在美洲还是亚洲,NET发病率均呈现出逐渐升高的趋势[3-4]。亚洲人群中,胃NET约占消化系统NET的14.6%,其中MANEC的发病率相对更低[4]。MANEC作为2010年WHO对NET分类新定义的一个类别,发病率极低,现有资料大多为病例报道,故其发生机制、发病率、临床表现和预后等尚不明确。
消化系统NET以无功能型相对多见。胰腺NET中无功能型占45%~60%[5]。本研究中入组的胃MANEC患者大多表现为无特异性的消化道症状,仅1例患者出现反复腹泻。基于本院能够检测的外周血生长抑素、胰高血糖素和胃泌素等水平均未超出正常范围,诊断功能型NET依据不足,故推测MANEC患者也以无功能型相对多见。结果提示,MANEC疾病临床表现隐匿,无特异性,早期诊断难度较大。
Scardoni等[6]的研究中,6例胃肠胰腺MANEC患者(其中胃MANEC患者2例)均为男性,年龄范围为63~89岁。本研究中,92.86%的胃MANEC患者为男性,发病平均年龄为(63.43±9.078)岁,范围为54~85岁。目前尚未发现胃MANEC发病率在性别上有明确差异,发病年龄高峰亦未阐明。而由本研究结果推测,可能胃MANEC在男性中的发病率较高,并且老年人群易得;然而,不排除单中心、小样本研究结果存在一定偏倚,因此还需要开展大样本的随机对照研究来进一步证实。
Cazzo等[7]报道1例83岁女性的残胃癌诊断为MANEC,该患者在35年前曾因消化道溃疡行胃部分切除术。Nemoto等[8]报道1例75岁男性胃癌患者,胃肠吻合术后50年在原手术吻合口位置再次出现肿瘤,此次出现的是胃MANEC。既往研究多证明,胃空肠吻合术后的吻合口局部是二次肿瘤的高发部位[9],其发生机制多被认为是肠胃反流胆汁和胰腺分泌物长期刺激胃黏膜,增加了局部组织的DNA损伤,促进肿瘤发生和发展[10]。然而也有研究认为,分流十二指肠分泌物的治疗并未能降低癌的发生率,也不能阻止肿瘤的发展[11]。本研究纳入的14例患者中,有明确胃腺癌根治术病史者仅1例,其余13例均无手术诱因,仍然发生了胃MANEC。因此,推测胃肠吻合手术可能与胃MANEC的发病有关,但二者的相关性尚值得深入分析。本研究中1例患者既往有硬皮病病史,长期口服雷公藤和吗替麦考酚酯治疗。免疫抑制剂的使用是否在MANEC的发生和发展过程中发挥着一定的作用,目前也并不清楚。
目前,胃MANEC的组织起源仍存在争议。Scardoni等[6]通过二代基因测序发现,MANEC患者的TP53基因突变率达91.7%,而在ATM、CTNNB1、ERBB4、JAK3、KDR、KRAS和RB1位点发现低频率突变,进而提出MANEC的突变特点可能提示疾病是单克隆起源。目前较公认的胃MANEC的组织起源假说认为,MANEC组织中的腺癌和神经内分泌癌成分均来自内胚层多潜能干细胞,是肿瘤发展过程中干细胞多向分化的结果[12]。另一种假说则认为,腺癌和神经内分泌癌分别起源于不同细胞系;但也有研究报道了3种组织学不同的恶性肿瘤(神经内分泌癌、腺癌和鳞状细胞癌)紧密混合在一起的胃MANEC病例,而3种细胞系混合并都发生恶性癌变的可能性目前尚没有充分的理论依据来支持[13]。
通常认为,MANEC的预后要比单纯的NET差,但临床证据尚不充分。理论上,MANEC中2种不同组织学类型的恶性成分均能决定肿瘤的生物学行为,并且起决定作用的应当是恶性程度最高、侵袭性最强的成分,往往是神经内分泌癌成分[14-15]。本研究中,神经内分泌癌成分所占比例大多超过50%,组织学分级均为恶性程度最高的G3级,这意味着患者的预后可能不佳。
既往研究认为,MANEC局部的浸润深度和肿块大小在决定患者生存期和预后方面并不占有非常重要的地位,而淋巴结侵犯与远处转移则起着更为重要的作用[16]。本研究显示,神经内分泌癌成分的局部浸润深度是预后的不良因素,腺癌成分的浸润深度和淋巴结侵犯情况可能对患者的预后有不良影响。本研究中13例(92.9%)患者接受了根治性手术治疗,随访过程中共6例患者发现远处转移;而且这6例患者均在出现远处转移后,疾病迅速进展,甚至死亡。这与既往研究的结论基本相符,淋巴结侵犯与远处转移是影响患者预后的最重要的因素,其他因素包括恶性级别最高的肿瘤成分的局部浸润深度和比例可能对患者预后也有一定的影响。
Cho等[4]认为,MANEC占整个胃肠胰腺NET的3.8%,各期总体的5年生存率为42.6%,由于该研究没有详细区分不同分期患者的生存情况,故不能从中明确得知MANEC的预后与另外3类NET的具体差异。本研究中,超过半数的患者伴有癌栓、神经束侵犯和淋巴结转移,且转移成分常为腺癌和神经内分泌癌2种成分的混合。虽然目前尚不能看出患者的预后情况是否与一般的胃肠胰腺神经内分泌癌相仿或者更差,但由于高龄、癌细胞周围侵袭性明显、大多患者分期相对较晚、组织学分级高,患者的总生存似乎更差。本研究由于样本量小,随访时间短,也未能够阐明上述问题,随着随访时间的延长,可能以后能够有进一步的发现。
综上所述,胃MANEC是一种具有复杂特征的少见恶性肿瘤,至今国际上仍然没有标准的治疗方案,而癌细胞周围侵袭性明显,预后相对可能更差。本研究中肿瘤c-MET表达阳性率达78.6%,这是否能够预测患者对抗c-MET治疗的敏感性,目前尚不明确。下一步希望从分子生物学角度进行深入研究,以期探索该肿瘤发生与发展的一些关键生物靶标。
