Myc/his-TDP-43融合蛋白对tau外显子10可变剪接的影响
2018-08-30缪世琛屈舒婷任梁梁顾建兰
缪世琛,屈舒婷,陆 颖,唐 啸,任梁梁,顾建兰
南通大学医学院,南通 226001
反式激活反应DNA结合蛋白(trans-active response DNA-binding protein of 43 kDa, TDP-43)包含414个氨基酸,存在于各种神经退行性疾病中,包括路易体病、皮质基底节变性和阿尔茨海默病(Alzheimer disease, AD)等[1-2]。TDP-43含有2个高度保守的RNA识别基序(RNA recognition motif,RRM)和1个富含甘氨酸的尾巴[3]。其中,RRM的主要功能是介导TDP-43与双/单链DNA、RNA结合,是TDP-43发挥可变剪接调节作用所必需的。
Tau蛋白过度磷酸化是AD的致病机制之一。为了探讨TDP-43对tau基因剪接以及表达的调节,本课题组构建了pCI/TDP-43·HA,发现其在细胞中过表达后可促进4R-tau的表达[4]。TDP-43是高度磷酸化的磷蛋白,其功能受磷酸化调控。本课题组后续须研究哪些蛋白激酶可以磷酸化TDP-43和可能的磷酸化位点,及磷酸化后对TDP-43调节tau功能的影响。本课题组现有的蛋白激酶,如酪蛋白激酶[5]、蛋白激酶A[6]等表达质粒都构建在与TDP-43相同的载体pCI-Neo质粒上,且携带相同的HA标签。这为利用表达标签的优势研究蛋白激酶和TDP-43的相互作用带来了困难。因此,本研究将TDP-43构建到带myc、his标签的pcDNA3.1载体上,将pcDNA3.1/TDP-43·myc·his和tau迷你基因共转染,探讨myc/his标签肽对TDP-43蛋白在tau外显子10可变剪接中的作用。
1 材料与方法
1.1 主要材料及试剂 细菌、细胞和质粒:大肠杆菌DH5α购自天根生化科技(北京)有限公司;pCAG/TDP-43质粒购自Origene公司;HEK-293FT细胞(人胚肾细胞)和N2a细胞(小鼠神经瘤母细胞)购自中国科学院上海生物化学与细胞生物学研究所。抗体和其他试剂:myc抗体(9E10)购自Millipore公司;tubulin抗体购自Sigma公司;辣根过氧化物酶(HRP)标记的羊抗鼠、羊抗兔IgG抗体购自Jackson Immuno Research Laboratories公司;抗GAPDH抗体购自Santa Cruz公司。BamH Ⅰ、NotⅠ购自NEB公司;DNA marker、T4DNA连接酶购自Promega公司;PrimeSTARTMHS DNA聚合酶购自TaKaRa公司;质粒小量抽提试剂盒、凝胶回收试剂盒购自天根生化科技(北京)有限公司;预染蛋白Marker购自Bio-Rad公司;RT试剂盒、DMEM培养基、胎牛血清购自Invitrogen公司;蛋白定量试剂盒和ECL化学发光试剂盒购自Pierce公司;Fugene HD购自Roche公司。引物由英潍捷基(上海)贸易有限公司合成。培养板及相关细胞实验耗材购自Corning公司。
1.2 真核表达质粒pcDNA3.1/TDP-43·myc·his的构建 根据GenBank报道的TDP-43编码序列(coding sequence),设计并合成了相应的上下游引物,以pCAG/TDP-43为模板,扩增目的基因,反应总体系100 μL,含5×反应缓冲液20 μL,模板pCAG/TDP-43共20 ng,上、下游引物各2 μL(10 μmol/L),PrimeSTARTMHS DNA聚合酶1 μL(2.5 U/μL),dNTP mix 8 μL(10 mmol/L);扩增条件为98℃ 预变性5 min,98℃ 30 s、68℃ 90 s重复35个循环,总延伸为68℃ 10 min。
琼脂糖凝胶电泳鉴定并用DNA回收试剂盒回收PCR产物。纯化的PCR产物和pcDNA3.1的空载质粒分别用限制性核酸内切酶BamH Ⅰ和NotⅠ进行双酶切,37℃过夜。酶切后电泳鉴定并用凝胶回收试剂盒回收酶切产物。将酶切回收后的pcDNA3.1空载和TDP-43目的片段按1∶8的比例,用T4DNA连接酶(10 μL体系)4℃连接过夜。
全部连接产物转化到DH5α感受态细胞,涂布于含100 μg/mL的氨苄青霉素(ampicillin, Amp)的琼脂糖平板上,37℃孵箱内倒置培养过夜。挑取3~4个单菌落,接种于含Amp的5 mL LB液体培养基中,37℃培养过夜。离心后回收菌体,用质粒小量抽提试剂盒抽提质粒。质粒用BamH Ⅰ和NotⅠ双酶切3 h后电泳,选取在1 200 bp处有目的条带的克隆进行测序鉴定。将经PubMed比对正确的质粒用于后续实验。
1.3 细胞培养和转染 HEK-293FT细胞用含10%胎牛血清(fetal bovine serum, FBS)的Dulbecco’s modified eagle medium(DMEM)培养基,N2a细胞用含10%血清的DMEM/F12培养基于37℃、5% CO2培养箱中培养,倒置相差显微镜下观察细胞。转染前1 d,细胞用0.25%的胰蛋白酶消化,用不含抗生素的DMEM/FBS培养基终止反应,细胞以50%的融合度接种于24孔细胞培养板中,每组3个复孔。第2天,细胞覆盖达90%左右,按照Fugene HD操作说明进行转染,48 h后处理细胞。
1.4 Western印迹法测定蛋白表达 细胞转染48 h后,每孔细胞用100 μL 1×Loading buffer 于100℃ 沸水中裂解5 min。提取的蛋白用Pierce OD660蛋白定量试剂盒测定浓度后,调整蛋白浓度一致,10%或12%SDS-PAGE电泳分离后,电转至PVDF膜上,5%脱脂牛奶封闭1 h,anti-myc单克隆抗体(1∶1 000)或anti-tubulin(1∶5 000)、anti-GAPDH抗体(1∶1 000)4℃孵育过夜,用含0.1% Tween 20的TBS(TBST)洗涤后,与辣根过氧化物酶(horse radish peroxidase,HRP)标记的二抗室温孵育2 h,TBST洗涤3次后显影。
1.5 反转录聚合酶链式反应(reverse transcription polymerase chain reaction, RT-PCR) Tau迷你基因和不同量的TDP-43或siTDP-43转染至HEK-293FT细胞,48 h后用RNA抽提试剂盒(OMEGA)提取总RNA,取总RNA 1 μg,加入5 mmol/L dNTP mix 2 μL、10 μmol/L Oligo dT181 μL、补适量DEPC水至总体积10 μL,65℃ 5 min;加入10×反转录buffer 2 μL、MgCl24 μL、DTT 2 μL、40 U/μL RNase OUTTM1 μL、200 U/μL SuperScrip Ⅲ 1 μL,50℃ 50 min、85℃ 5 min;加入RNaseH 1 μL (2 U),37℃ 20 min。以cDNA为模板,用PrimeSTARTMHS DNA Polymerase(TaKaRa)进行PCR反应检测tau外显子10的可变剪接,引物序列为:5′-GGT GTC CAC TCC CAG TTC AA-3′(上游),5′-CCC TGG TTT ATG ATG GAT GTT GCC TAA TGA G-3′(下游)。鼠GAPDH引物序列:5′-TGC TGA GTA TGT CGT GGA GTC TA-3′(上游),5′-AGT GGG AGT TGC TGT TGA AGT CG-3′(下游)。扩增条件为98℃预变性5 min,98℃ 10 s、68℃ 40 s 共30个循环,总延伸为68℃ 10 min。PCR产物经1.5%的琼脂糖凝胶(含0.5 μg/mL溴化乙锭)电泳后,分析条带。
1.6 TDP-43各截断体的构建 根据TDP-43蛋白的结构设计并合成各截断体的引物,以构建成功的pcDNA3.1/TDP-43·myc·his为模板扩增目的基因。纯化的PCR产物和pcDNA3.1空载体分别用BamH Ⅰ和NotⅠ双酶切,琼脂糖凝胶电泳鉴定后,回收酶切产物。将酶切后的pcDNA3.1和TDP-43各截断体的片段在4℃连接、转化,通过Amp选择培养后,挑斑摇菌,提取质粒,酶切鉴定后测序。
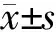
2 结 果
2.1 pcDNA3.1/TDP-43·myc·his全长质粒的构建 结果(图1)显示:电泳图1.2 kb处有目的片段,测序结果也显示pcDNA3.1/TDP-43·myc·his质粒构建成功。

图1 pcDNA3.1/TDP-43·myc·his全长质粒的酶切鉴定
2.2 过表达或下调TDP-43对tau迷你基因可变剪接的影响 为验证pcDNA3.1/TDP-43对tau外显子10可变剪接的影响,在HEK-293FT细胞中过表达不同量的pcDNA3.1/TDP-43·myc·his,同时共转tau迷你基因SI9/SI10。48 h后,RT-PCR检测tau外显子10的可变剪接产物;Western印迹法检测TDP-43(anti-myc)的表达。结果显示:TDP-43促进tau外显子10的编码,促进作用呈剂量依赖性(图2A)。进一步的验证实验结果显示:TDP-43促进tau外显子10的表达,siTDP-43下调TDP-43表达后则作用相反(P<0.05或0.01,图2B)。
图2 过表达或下调TDP-43对tau迷你基因SI9/SI10可变剪接的影响
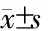
2.3 TDP-43及其各截断体质粒的构建和表达 pcDNA3.1/TDP-43·myc·his全长质粒为模板,PCR扩增获取目的片段,双酶切(图3A)鉴定及公司测序鉴定结果显示,TDP-43系列截断体构建成功。将pcDNA3.1/TDP-43·myc·his及各截断体质粒转染至HEK-293FT细胞,48 h后Western 印迹结果(图3B)显示,除缺失核定位信号的4个质粒(pcDNA/TDP-43-188-414、237-414、255-414、273-414)外,其余质粒均在相应的相对分子质量附近有蛋白表达。
图3 pcDNA/TDP-43各截断体的酶切鉴定和表达
A:TDP-43各截断体用BamH Ⅰ和NotⅠ于37℃酶切3 h后电泳结果;B:HEK-293FT细胞中转染TDP-43及各截断体质粒48 h后Western 印迹结果.1: TDP-431-104; 2: TDP-431-179; 3: TDP-431-275; 4: TDP-431-306; 5: TDP-431-383; 6: TDP-43100-275; 7: TDP-43100-414; 8: TDP-43188-414; 9: TDP-43237-414; 10: TDP-43255-414; 11: TDP-43273-414; 12: TDP-43
3 讨 论
AD是老年人常见的神经变性疾病。AD的病因及发病机制尚未明确,特征性病理改变为β-淀粉样蛋白沉积形成的细胞外老年斑和异常过度磷酸化的tau蛋白聚集形成的神经细胞内神经元纤维缠结[7]。Josephs等[8]研究发现,57%AD患者的神经元内含有TDP-43,提出TDP-43可能是与AD发病相关的第3种蛋白质。
TDP-43是一种DNA和RNA结合蛋白,参与mRNA的稳定、RNA转录、剪接、RNA加工、microRNA的生物合成、细胞凋亡、细胞分裂、神经元完整性和可塑性等的调节[3]。TDP-43异常聚集与肌肉萎缩性侧索硬化症(渐冻症)有关,并在AD的进展中扮演着重要角色[5]。TDP-43在AD病理进程中的作用机制目前尚不清楚。高度保守的SR核蛋白家族参与体外前体mRNA剪接位点的选择,其中SC35、9G8、ASF/SF2等参与tau外显子10可变剪接的调节[9-11]。本课题组最近研究[4]结果发现,pCI/TDP-43·HA可以促进4R-tau的表达。本研究成功构建了pcDNA3.1/TDP-43·myc·his质粒,与tau迷你基因SI9/SI10共转后,发现TDP-43呈剂量依赖性地促进4R-tau的表达,下调TDP-43则抑制4R-tau的表达。该结果证明,携带不同的标签肽不影响TDP-43对tau外显子10可变剪接的促进作用。
TDP-43蛋白全长分子中含有多个丝氨酸、苏氨酸和酪氨酸位点,其中有多个潜在的磷酸化位点(NetPhos 2.0软件分析结果)。文献[12-13]报道,酪蛋白激酶可磷酸化TDP-43,促进TDP-43在细胞内的聚集。为进一步研究蛋白激酶对TDP-43的磷酸化及磷酸化对TDP-43功能的影响,后续实验将把构建在pcDNA3.1载体上、带myc/his标签的TDP-43全长或各截断体质粒和构建在pCI-Neo载体上、带HA标签的酪蛋白激酶、蛋白激酶A等蛋白激酶质粒共转入细胞表达,观察哪些蛋白激酶可以磷酸化TDP-43及各结构域在AD等神经退行性病变中作用的分子机制,以期为神经退行性疾病的防治提供分子生物学依据。
