柴胡皂甙D对肺纤维化小鼠上皮-间质转化的干预作用及机制研究*
2018-08-29管淑红王智刚朱煜明徐乾乾
管淑红,王智刚,朱煜明,徐乾乾,周 军
(江苏省常州市第一人民医院呼吸内科 213000)
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)本质为原因不清楚的间质性肺炎,主要表现为肺间质的纤维化,以往研究认为该病尚无特效药物治疗和改善预后[1]。随着对该病的重视,越来越多的新药涌现出来,2015版IPF治疗指南依据一些新药研究证据,对吡非尼酮和尼达尼布这两种药物进行了有条件推荐[2]。鉴于我国的国情,IPF患者通常面临经济成本、依从性等挑战,从这两种药物中获益甚少。
柴胡皂甙具有抗病毒、抗炎、抗肝肾等器官纤维化、抗肿瘤、调节内分泌、治疗肾炎等作用,其中最具有活性的成分是柴胡皂甙D(SSD) 。本课题组致力于研究SSD对肺纤维化的干预作用及机制,早期部分动物体内外实验已证实SSD能通过保护肺泡上皮细胞免于过度凋亡、抑制成纤维细胞增殖等机制缓解肺纤维化病情[3],本文将系列报道SSD对肺纤维化小鼠上皮-间质转化(EMT)的干预作用及机制研究。
1 材料与方法
1.1实验动物及分组 所有实验小鼠均购自扬州大学实验动物中心,均为清洁级6周,体质量为18~22 g,雄性昆明种,总共60只。采用随机数字表法将60只小鼠分为3组:对照组、博来霉素(BLM)组及SSD组,各20只。BLM组和SSD组通过文献[4]方法制备肺纤维化模型,均给予气管内注入浓度为5 mg/kg的 BLM溶液,并通过旋转的方式保证药物充分分布在肺内,术后常规喂养。而对照组则给予相同体积0.9%的氯化钠。配置SSD溶液方法如下:将SSD 20 mg溶入二甲基亚砜(DMSO)3 mL中,用生理盐水稀释至100 mL,避光保存,SSD组每日腹腔内注入SSD溶液(2.0 mg/kg),BLM组和对照组每日同等条件下腹腔内注入0.2 mL生理盐水+DMSO(3 mL DMSO 溶于97 mL生理盐水),连续28 d。
1.2方法
1.2.1标本收集 在用药后的第14、28天,各组随机选取10只实验小鼠,均取出其肺组织,右肺组织保存于-70 ℃冰箱,用于检测E钙黏蛋白、抗纤维连接蛋白、Wnt蛋白和β-actenin蛋白的表达;左肺完整置于4%多聚甲醛溶液中固定,用于HE染色。
1.2.2病理切片观察 将多聚甲醛固定后的左肺组织用石蜡包埋,切片后给予苏木素-伊红(HE)染色,然后通过光镜下观察肺组织的损伤程度和胶原纤维的变化,采用SZAPIEL等[5]研究分级。肺泡炎:0级为无肺泡炎症;Ⅰ级为轻度肺泡炎,有少量炎症细胞浸润;Ⅱ级为中度肺泡炎;Ⅲ级为重度肺泡炎,病变弥漫。肺纤维化:0级为无或少量胶原纤维;Ⅰ级为胶原纤维轻度增多;Ⅱ级为胶原纤维中度增多,可伴有肺泡结构紊乱;Ⅲ级为胶原纤维明显增多,肺泡塌陷、融合、结构紊乱。肺泡炎及肺纤维化等级资料分别记为1~4分。
1.2.3Western blot检测肺组织E钙黏蛋白、纤维连接蛋白、Wnt蛋白、β-actenin蛋白表达 100 mg组织加1 mL RIPA裂解液于玻璃匀浆器中研磨、裂解。离心后加入2×十二烷基硫酸钠(SDS)上样缓冲液,煮沸后于10% SDS-聚丙烯酰胺凝胶电泳(PAGE)中恒压90 V电泳2 h,采用5%脱脂奶粉封闭1 h,一抗2 h,二抗1 h,用显色剂ECL-plus染色最后在Typhoon扫描仪中成像,采用Imagequant TL软件分析光密度值。
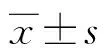
2 结 果
2.1肺组织病理学观察 光镜下观察,对照组肺结构正常,未见炎性细胞浸润(图1A)。BLM组第14天炎性细胞明显浸润,肺泡间隔明显增宽(图1B);第28天肺组织结构破坏,部分肺泡塌陷融合,其间可见炎性细胞浸润,见大量宽带状及片状胶原纤维,呈弥漫性肺纤维化(图1C)。SSD组肺泡炎及肺纤维化程度较同期BLM组均明显减轻(图1D和 1E)。各组小鼠肺泡炎和肺纤维化程度的定量分析结果见表1。对照组第14和28 天肺泡炎和肺纤维化程度评分比较无明显差异,其余各组比较差异均有统计学意义(P<0.05)。其中,SSD组和BLM组肺泡炎及肺纤维化程度评分均高于同期对照组(P<0.05),且SSD组低于同期BLM组(P<0.05)。
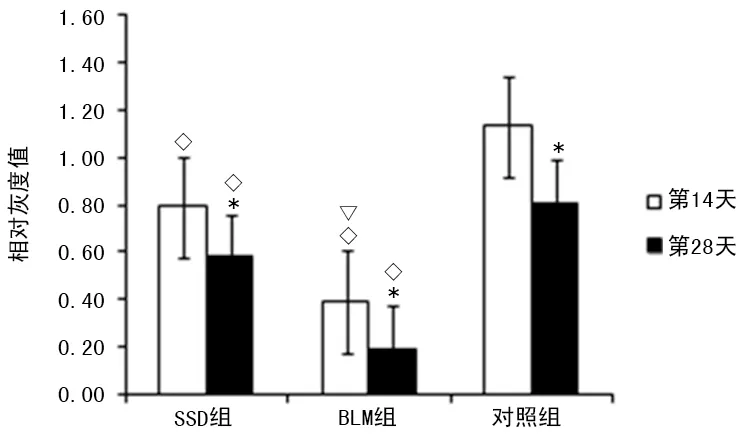
2.2Western blot检测肺组织E钙黏蛋白、纤维连接蛋白表达 在造模第14和28天,Western blot检测肺组织E钙黏蛋白表达显著下调(P<0.05),而纤维连接蛋白表达则显著上调(P<0.05)。同期相比,SSD组和BLM组E钙黏蛋白的表达均低于对照组(P<0.05),且SSD组高于BLM组(P<0.05);同期相比,SSD组和BLM组纤维连接蛋白的表达均高于对照组(P<0.05),且SSD组低于BLM组(P<0.05),见图2~4。
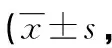
表1 各组小鼠给药后肺泡炎和肺纤维化程度评分比较分)
a:P<0.05,b:P<0.01,与对照组比较;c:P<0.05,d:P<0.01,与BLM组比较
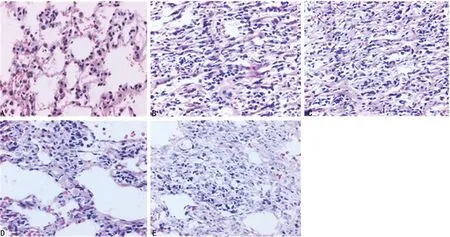
A:对照组第28天;B:BLM组第14天;C:BLM组第28天;D:SSD组第14天;E:SSD组第28天
图1各组小鼠给药后不同时间肺组织病理形态变化(HE,×200)
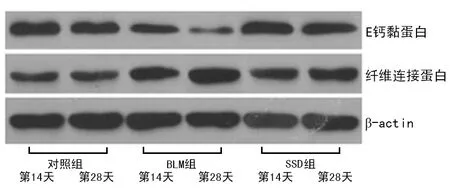
图2 E钙黏蛋白和纤维连接蛋白的Western blot
*:P<0.05,与第14天比较;◇:P<0.05,与同期对照组比较;▽:P<0.05,与同期SSD组比较
图3 E钙黏蛋白表达的相对灰度值比较
*:P<0.05,与第28天比较;◇:P<0.05,与同期对照组比较;▽:P<0.05,与同期BLM组比较
图4纤维连接蛋白表达的相对灰度值比较
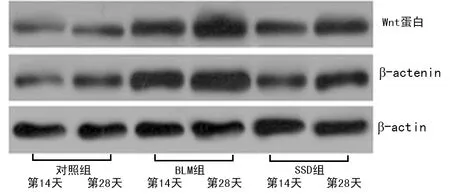
图5 Wnt蛋白和β-actenin蛋白的Western blot电泳图
*:P<0.05,与第28天比较;◇:P<0.05,与同期对照组比较;▽:P<0.05,与同期BLM组比较
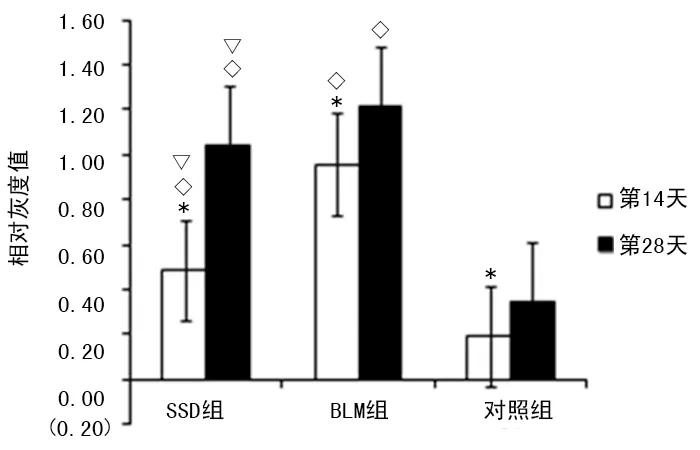
图6 Wnt蛋白表达的相对灰度值比较
*:P<0.05,与第28天比较;◇:P<0.05,与同期对照组比较;▽:P<0.05,与同期BLM组比较
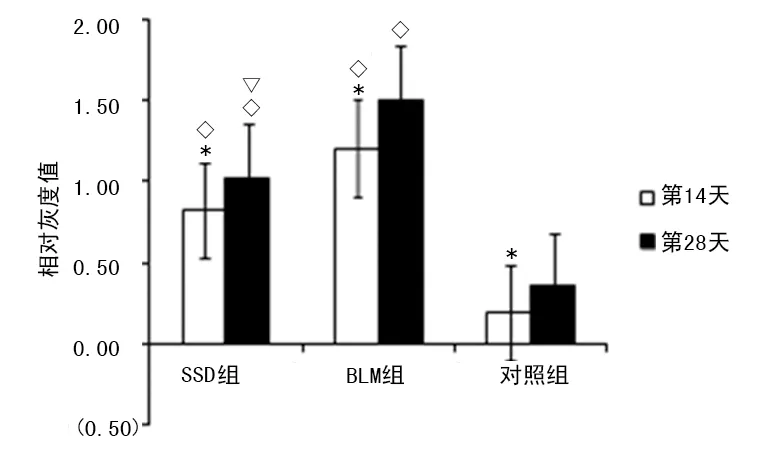
图7 β-actenin蛋白表达的相对灰度值比较
2.3Western blot检测肺组织Wnt蛋白、β-actenin蛋白表达 在造模第14和28天,Western blot检测肺组织Wnt蛋白、β-actenin蛋白表达均显著上调(P<0.05)。同期相比,SSD组和BLM组Wnt蛋白、β-actenin蛋白的表达均高于对照组(P<0.05),且SSD组低于BLM组(P<0.05),见图5~7。
3 讨 论
IPF的发病受多种因素影响,主要包括炎症导致的组织损失和组织损伤后的修复叠加等。CHINLOSI等[6]通过免疫组织化学染色研究了20例IPF患者的肺活检标本,其中在18例患者的增殖性细支气管损害局灶发现了胞核内Wnt途径靶基因产物cyclinD1、β-catenin和基质金属蛋白酶等的表达,表明IPF的发病与Wnt途径的活化有关;同时,该研究在其他类型的间质性肺病(inter stitial lung disease,ILD)患者的标本中均没有检测到胞核内Wnt途径相关分子表达的改变,表明Wnt途径的活化仅限于IPF。此外,研究还显示Wnt途径的活化在EMT中具有重要的作用,导入Wnt-1基因可以增高MDCK和HCE等上皮细胞系细胞胞质内β-catenin的表达,促使淋巴样增强因子1(LEF1)转入胞核内,进而引发轻微的EMT;DLD-1上皮肿瘤细胞导入LEF-1基因后,其胞核内β-catenin呈现稳定的高表达,导致显著EMT的发生,因此EMT过程具有可逆性[7]。但是,Wnt途径的活化在EMT过程中的作用及其在IPF发病中对肺内细胞和分子的影响需要进行更进一步的研究[8]。
本文对上皮标志E-钙黏蛋白及间叶标志纤维连接蛋白表达进行检测,结果表明,予以SSD干预后,无论是复制肺纤维化模型的中期还是后期,E-钙黏蛋白的表达下调均受到保护,而纤维连接蛋白的表达上调却被抑制,这与德国COSTABEL等[9]提出的IPF的EMT学说结果一致,WOLTERS等[10-11]的研究也证实了这一结果。有研究[12-14]显示,BLM组小鼠肺组织表达Wnt蛋白及β-catenin蛋白有明显上调,这可能与IPF患者的肺组织内Wnt/β-catenin信号传导通路异常激活,β-catenin是Wnt/β-Catenin信号转导通路的核心因子有关[15]。SSD组中小鼠肺组织表达Wnt蛋白及β-catenin蛋白显著低于BLM组,这可能是由于SSD通过抑制Wnt/β-catenin信号传导通路介入EMT病理过程从而减缓肺组织纤维化进展。
依据IPF发病机制观点的改变,治疗IPF理念也发生相应变化,目前推荐及早的给予抗纤维化,加上小剂量抗炎,在于预防而不是逆转已存在的肺纤维化。2012年,Panther-IPF临床实验证实波尼松、硫唑嘌呤、N-乙酰半胱氨酸联合治疗IPF未有疗效,反而增加病死率和住院风险[16]。因此,在IPF治疗中,干预Wnt/β-catenin通路中的一个或几个环节,阻断信号传导链、抑制EMT进程,可以达到预防和控制病情的疗效。
