白藜芦醇抑制ApoE-/-小鼠动脉血管氧化应激及炎症损伤的作用研究*
2018-08-29李自立马小峰黄江伟
李自立,马小峰,黄江伟
(南华大学附属南华医院心血管内科,湖南衡阳 421002)
动脉粥样硬化(AS)的发病与低密度脂蛋白(LDL)、高血压、糖尿病、吸烟等因素刺激导致自由基生成增多及炎性因子的大量释放诱发的血管的炎性反应密切相关[1-2]。白藜芦醇是一种天然的多酚类化合物,研究[3-4]显示,其可显著减少活性氧簇的生成、减少动脉平滑肌细胞凋亡率,对抗动脉平滑肌细胞的氧化损伤,但其具体作用途径尚未见研究报道。本研究成功复制AS小鼠模型,观察了白藜芦醇对AS小鼠的疗效及其对IL-6/STAT3信号通路的影响,旨在探讨白藜芦醇抗AS的具体作用机制。
1 材料与方法
1.1实验动物 SPF级ApoE-/-小鼠及 C3H 小鼠,体质量(20±2)g,均购自广东省实验动物中心。小鼠饲养于SPF级动物实验室,室温保持在(24±0.2)℃,湿度保持在45%左右,黑白12 h交替,环境安静,自由饮食水,每笼单笼饲养6只,适应性喂养1周后进入实验。
1.2AS小鼠模型的制备及分组 10只10周龄雄性 C3H 小鼠设置为对照组,用普通饲料进行喂养。将80只10周龄ApoE-/-小鼠给予高脂饲料饮食, 4 周成功复制AS 模型,采用随机数字表法分为模型组、白藜芦醇高剂量组、白藜芦醇低剂量组和辛伐他汀组,每组各20只。
1.3动物分组及给药 白藜芦醇高、低剂量组分别用0.2 mL 30 g/L和15 g/L的白藜芦醇进行灌胃,给药体积为每日0.2 mL,同时继续给予高脂饮食。模型组每天给予0.2 mL生理盐水灌胃,继续高脂饮食。均于每日9:00灌胃给药,各组均给予相应的处理14周。
1.4观察指标
1.4.1血脂 实验进行14周后禁食水12 h,摘取各组小鼠眼球并取约1 mL血液,离心后留取血清,全自动生化分析仪检测各组小鼠总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)及高密度脂蛋白胆固醇(HDL-C)等变化情况。
1.4.2主动脉根部病理形态学变化 干预14周后,用10%水合氯醛麻醉并固定小鼠,在无菌操作下打开小鼠胸腔,分离胸主动脉,多聚甲醛固定、乙醇脱水,包埋,切片,进行苏木素-伊红(HE)染色操作,观察各组小鼠主动脉病理形态学变化。同时,用灭菌注射用水冲洗胸主动脉标本,进行油红染色,观察各组小鼠主动脉内中性TG、脂质蛋白情况。
1.4.3氧化应激指标水平变化 分离小鼠主动脉,在冰上采用PBS溶液制成10%的匀浆液,4 ℃离心,留取上清液,检测各组小鼠主动脉组织中丙二醛(MDA)、一氧化氮(NO)、超氧化物歧化酶(SOD)及谷胱甘肽(GSH)水平变化。
1.4.4ELISA法检测TNF-α、IL-1、IL-6的表达 分离小鼠主动脉,在冰上采用PBS溶液制成10%的匀浆液,4 ℃离心,留取上清液,采用ELISA法检测各组小鼠主动脉组织中TNF-α、IL-1、IL-6的水平。
1.4.5Western blot法检测IL-6、JAK1、STAT3蛋白的表达 冰上分离各组检测小鼠的主动脉,采用蛋白裂解缓冲液提取总蛋白,并采用Bradford 法进行蛋白定量。用10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质,进行聚偏氟乙烯(PVDF)的转膜,封闭,放入相应的一抗和二抗,ECL曝光, X射线显影后,运用凝胶扫描成像系统进行分析及定量,以β-actin为内参。
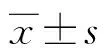
2 结 果
2.1血脂水平比较 白藜芦醇各剂量组及辛伐他汀组各时间点TC、TG、LDL-C、AI水平显著低于模型组(P<0.05)。HDL-C随着喂养时间的延长有逐渐增高的趋势,但与模型组同期比较差异无统计学意义(P<0.05),见表1。
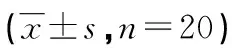
表1 各组小鼠血脂水平比较
*:P<0.01,与对照组比较;#:P<0.05,△:P<0.01,与模型组比较

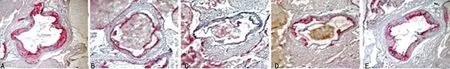
A:对照组;B:模型组;C:辛伐他汀组;D:白藜芦醇低剂量组;E:白藜芦醇高剂量组
图1白藜芦醇对高脂血症小鼠动脉内膜组织病理学的影响
A:对照组;B:模型组;C:辛伐他汀组;D:白藜芦醇低剂量组;E:白藜芦醇高剂量组
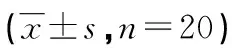
图2 各组小鼠动脉内壁厚度
*:P<0.05,与对照组比较;#:P<0.05,与模型组比较
2.2组织病理学变化 干预14周后,对照组小鼠主动脉结构正常。模型组主动脉内膜增厚,管腔狭窄,管腔内可见斑块形成并向管腔内突出,内膜增厚处可见大量泡沫细胞、胆固醇结晶和炎性细胞排列紊乱,内皮细胞明显缺损,弹力板断裂,厚薄不均。各给药组小鼠的动脉内膜病理情况明显好转,见图1。
2.3油红染色变化 模型组血管内壁增厚,染色加深,而各给药组动脉内膜厚度变薄,染色较淡。模型组主动脉脂质蓄积面积显著多于对照组(P<0.05)。而各给药组显著少于模型组 (P<0.05),见图2。
2.4TUNEL染色法检测主动脉粥样硬化斑块内细胞凋亡情况 模型组小鼠主动脉管腔内可见大量的红色颗粒(即凋亡细胞核),位置、大小与斑块一致。各给药组主动脉管腔中仅见少量红色颗粒。模型组凋亡细胞指数显著高于对照组(P<0.05)。而各给药组凋亡细胞指数显著低于模型组(P<0.05),见表2。
2.5氧化应激水平比较 各给药组MDA、NO水平显著低于模型组,SOD和GSH水平高于模型组(P<0.05)。而各给药组间比较差异无统计学意义(P>0.05),见表3。
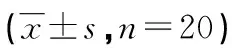
表3 白藜芦醇对高脂血症小鼠氧化应激指标的影响
*:P<0.05,与对照组比较;#:P<0.05,与模型组比较
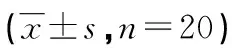
表4 白藜芦醇对高脂血症小鼠炎性因子水平的影响
*:P<0.05,与对照组比较;#:P<0.05,与模型组比较
2.6TNF-α、IL-1、IL-6的表达水平比较 各给药组TNF-α、IL-1及IL-6水平显著低于模型组(P<0.05),且尤以白藜芦醇高剂量组降低最明显,结果见表4。
2.7JAK1、p-JAK1、STAT3及p-STAT3蛋白的表达 白藜芦醇高、低剂量组p-JAK1及p-STAT3蛋白显著低于模型组,差异有统计学意义(P<0.05),见图3及表5。
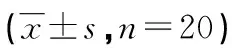
表5 白藜芦醇对高脂血症小鼠STAT3信号通路的影响
*:P<0.05,与对照组比较;#:P<0.05,与模型组比较
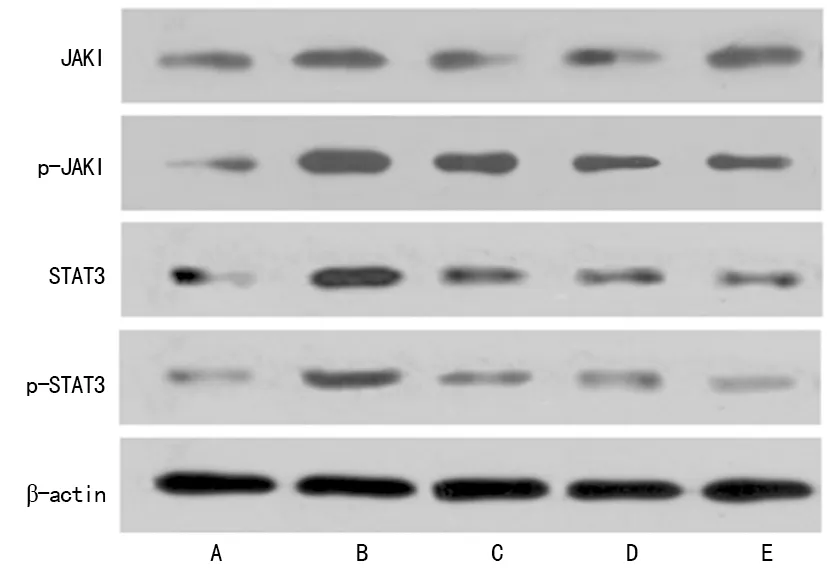
A:对照组;B:模型组;C:辛伐他汀组;D:白藜芦醇低剂量组;E:白藜芦醇高剂量组
图3各组JAK1、p-JAK1、STAT3及p-STAT3蛋白的表达
3 讨 论
白藜芦醇提取自中药虎杖中的一类多酚类物质,药理学研究证实,其具有调节脂质代谢、抗炎、抗氧化及抗血管平滑肌细胞增殖的作用。ApoE-/-小鼠是基因敲除小鼠,通过高脂饲料饮食,可复制出AS小鼠模型,与人类AS的病理极为相似[6]。本研究显示,给予高脂饲料饮食后,模型组小鼠TC、TG、LDL-C、AI水平逐渐升高,组织病理学观察及TUNEL染色法均可见动脉内膜粥样斑块形成,提示AS小鼠模型复制成功。而给予白藜芦醇治疗后,小鼠的血脂水平显著下降,动脉内膜病理情况及主动脉脂质蓄积面积均显著好转,提示白藜芦醇可显著降低AS小鼠的血脂水平,减轻AS病变程度,降低斑块面积,延缓AS病变进程。
研究[7-8]发现氧化应激反应参与了AS的病变过程。当患者发生AS的早期,动脉内膜发生局部氧化及抗氧化酶活性的改变,动脉内膜的氧化应激反应产生大量的氧自由基,攻击动脉内皮细胞,加重内膜的炎性损伤,加速AS的病变进程。MDA是细胞被自由基攻击后的最终产物,其水平在一定程度上反映了氧自由基的代谢状况及组织被自由基攻击的氧化程度[9]。NO是由内皮细胞产生的一种氧自由基,正常情况下可对内皮细胞产生保护作用,而在AS过程中,NO可发生过量表达,引起血管内皮功能障碍,损伤动脉内膜系统[10]。GSH和SOD是机体自由基的主要清除系统,维持着人体氧化系统与还原系统的动态平衡,当AS病变过程中,机体的自由基增多,GSH和SOD可被大量消耗。本研究结果显示,模型组小鼠MDA、NO水平显著高于对照组,总SOD活性和GSH水平显著低于正常组。提示AS病变进程中存在着活跃的氧化应激反应,促进了AS的进程。而给予药物治疗后,MDA和NO水平显著降低,总SOD活性和GSH含量显著增高。说明白藜芦醇可显著改善一定程度上抑制了机体的氧化应激水平,提高血管内皮的抗氧化能力,延缓AS病变进程,疗效与辛伐他汀相当。
IL-6/STAT3信号通路参与了AS的进程[11]。研究显示[12],在AS病变中,内皮细胞受损,导致血管内皮细胞等多种细胞分泌炎性因子,促进AS的发生发展。IL-6作为急性期炎性反应的诱导因子,促进STAT3的磷酸化并转移至细胞核内,促进其下游TNF-α、IL-6等多种炎症因子的激活,介导并促进细胞的炎性损伤。同时,TNF-α还可调节巨噬细胞对IL-6的分泌,IL-1亦可促进成纤维细胞合成和分泌IL-6,上述信号分子共同参与了血管内皮细胞的炎性损伤进程,加速了AS的病变。本研究结果显示,在AS过程中,机体的TNF-α、IL-1及IL-6水平上调,JAK/STAT3信号被激活,启动相关炎性因子的表达,促进AS的发展。而给予白藜芦醇治疗后,各项指标均显著改善,说明白藜芦醇可能通过抑制JAK1/STAT3通路减轻ApoE-/-小鼠动脉血管内的氧化应激及炎性损伤。
