紫铆因抑制脂多糖诱导小胶质细胞炎性反应的作用机制研究*
2018-08-29杨浩池陈明会李剑星刘亦恒张海英
付 媛,杨浩池,陆 睿,陈明会,李剑星,吕 婕,刘亦恒,张海英△
(1.广东医科大学人体解剖学教研室,广东东莞 523808;2.海南医学院人体解剖学教研室,海口 571101; 3.海南省海口市人民医院骨科中心 570208)
小胶质细胞是位于中枢神经系统内的固有的巨噬细胞样免疫效应细胞,同时也是脑内神经炎症调节过程中的主要效应细胞[1-2]。但当小胶质细胞被异常激活,长期处于过度活化状态时,可以产生大量的炎症介质和炎症因子,引起慢性炎性反应,损伤神经元,使神经元退化、变性甚至死亡[3]。漆树科植物漆树(rhus verniciflua stokes)皮中含有丰富的黄酮类物质,其活性成分有紫铆因。研究发现,紫铆因具有抗氧化、抗炎症、诱导肿瘤细胞凋亡等多种药理作用[4]。因此,本研究拟用脂多糖(lipopolysaccharide,LPS)作为诱导激活剂,用 BV2细胞系作为小胶质细胞的体外模型细胞,建立体外神经炎症模型,探讨紫铆因对LPS诱导小胶质细胞活化引起炎性反应的可能作用机制。
1 材料与方法
1.1材料 BV2小鼠小胶质细胞系购自中国科学院昆明细胞库;紫铆因、脂多糖、MTT购自Sigma公司; TRIzol Reagent 购自Life Invitrogen 公司; Taq SYBR Green qPCR Premix购自Nova公司; HRP山羊抗小鼠IgG、HRP驴抗兔IgG购自Thermo公司;Cy3 山羊抗兔IgG购自Millipore公司;β-actin小鼠单克隆抗体购自Sigma公司;p44/42 MAPK(ERK1/2)兔单克隆抗体、Phospho-p44/42 MAPK(ERK1/2)兔单克隆抗体、MEK1/2兔单克隆抗体、Phospho-MEK1/2兔单克隆抗体、Phospho-c-Raf兔单克隆抗体、NF-κB p65兔单克隆抗体购自Cell Signalling公司;Raf-1兔单克隆抗体购于Abcam公司;Lamin B 兔多克隆抗体购于Santa Cruz公司。
1.2方法
1.2.1细胞培养 BV2小胶质细胞使用含10%胎牛血清和1%的青链霉素的RPMI 1640 培养基,培养于25 cm2的细胞瓶中,置37 ℃、5% CO2的培养箱中培养。实验分为正常组:BV2细胞正常培养,不添加任何干预因素;模型组:LPS(10 μg/mL)诱导BV2小胶质细胞活化;实验组:紫铆因(1、10、30 μg/mL)预处理2 h后,与LPS(10 μg/mL)共培养。培养24 h后,收集细胞用于后续实验。
1.2.2MTT法检测紫铆因对小胶质细胞存活率的影响 取对数生长期的正常BV2细胞,以1×105个/mL密度接种于96孔板,培养过夜后换无血清培养基进行加药处理,加入不同浓度紫铆因(0、1、10、30、50、100 μg/mL)继续培养,每组设6个复孔,24 h后进行MTT实验,检测细胞存活率,实验重复3次。
1.2.3qPCR法检测炎症因子IL-1β、IL-6、TNF-α mRNA的表达变化 根据实验分组收集细胞按TRIzol说明书提取RNA,检测所提RNA纯度及完整性,根据HiFi-MMLV cDNA Kit说明书进行反转录反应合成cDNA,根据Taq SYBR Green qPCR Premix进行qPCR反应,观察炎症因子IL-1β、IL-6、TNF-α mRNA的表达,引物于NCBI网站设计,并经过比对,由上海生工公司合成,具体序列见表1;反应参数为:94 ℃预变性3 min,94 ℃变性10 s,60 ℃退火15s,72 ℃延伸30 s,共40个循环,以GAPDH为内参扩增目的基因,用2-△△Ct方法进行相对定量分析,实验重复3次。
1.2.4Western blot检测NF-κB p65、ERK信号通路相关蛋白的表达 根据实验分组收集细胞,根据细胞核蛋白和浆蛋白提取试剂盒提取核蛋白和胞浆蛋白,用RAPI裂解液提取总蛋白,用BCA法测定蛋白浓度后,取30 μL上样经SDS-PAGE电泳后转移到NC膜上,5%脱脂奶粉室温封闭1 h,β-actin(1∶5 000),p-ERK(1∶2 000)、ERK、MEK、p-MEK、Raf、p-Raf、NF-κB p65均(1∶1 000)4 ℃摇床低速孵育过夜;加入 HRP标记的二抗(1∶5 000)室温轻摇孵育1 h,于凝胶成像仪中显影拍照,以β-actin作为内参确定组间目标蛋白表达的差异和变化,实验重复3次。

表1 qPCR引物序列
1.2.5免疫荧光法检测紫铆因对 NF-κB p65核转移的影响 将各组细胞接种于小圆片上, 处理结束后4%多聚甲醛室温固定细胞20 min;5%驴血清+0.1% Triton封闭、打孔、通透90 min; NF-κB p65(1∶400)4 ℃摇床低速孵育过夜;加入cy3山羊抗兔荧光二抗(1∶200),37 ℃孵育1 h;加入DAPI复染细胞核5 min;取出小圆片,事先于载玻片上滴加抗荧光淬灭剂,于正置荧光显微镜下观察、成像,实验重复3次。
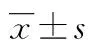
2 结 果
2.1LPS诱导BV2小胶质细胞活化细胞模型建立 参照文献[5-6]中采用的LPS剂量,本实验中选用LPS浓度为10 μg/mL干预正常BV2小胶质细胞,并且预实验结果显示用LPS 10 μg/mL干预正常BV2细胞24 h后,对细胞存活率无明显影响。
2.2MTT法检测紫铆因对BV2小胶质细胞存活率的影响 与正常组相比,各浓度的紫铆因对BV2细胞存活率均无明显影响,差异无统计学意义(P>0.05),见图1。
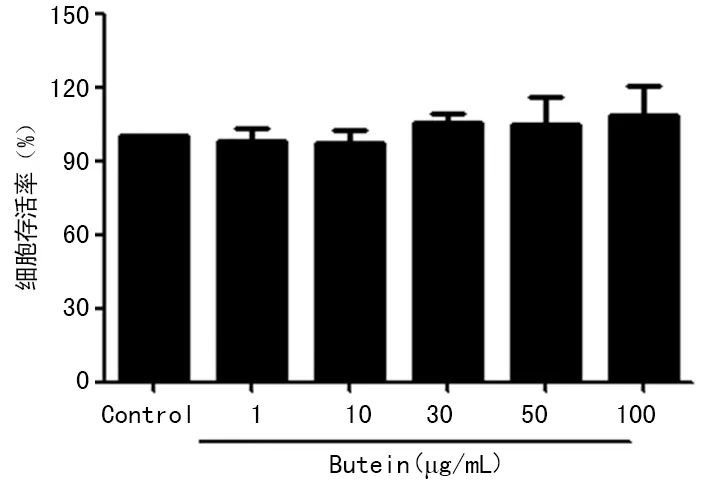
图1 紫铆因对BV2细胞存活率的影响(n=3)
2.3qPCR检测紫铆因对LPS诱导BV2小胶质细胞活化后炎症因子mRNA表达的影响 与正常组比较,模型组细胞炎症因子IL-1β、IL-6和TNF-α的mRNA表达水平明显上调;而实验组添加紫铆因预处理后,IL-1β、IL-6、TNF-α mRNA的表达显著下调,并呈浓度依赖性,差异具有统计学意义(P<0.05),见图2。
2.4免疫荧光观察紫铆因对LPS诱导BV2小胶质细胞活化后NF-κB p65核转移的影响 正常组细胞中NF-κB p65主要在胞质表达,核内几乎看不到其荧光表达;模型组细胞中NF-κB p65被激活,NF-κB p65从胞质转移至核内;而实验组细胞结果显示,紫铆因能明显抑制NF-κB p65的激活并下调其转录活性,阻止NF-κB p65向核内转移,见图3。
#:P<0.05,与正常组比较;*:P<0.05,与模型组比较
图2紫铆因对LPS诱导BV2小胶质细胞活化后炎症因子mRNA表达的影响(n=3)
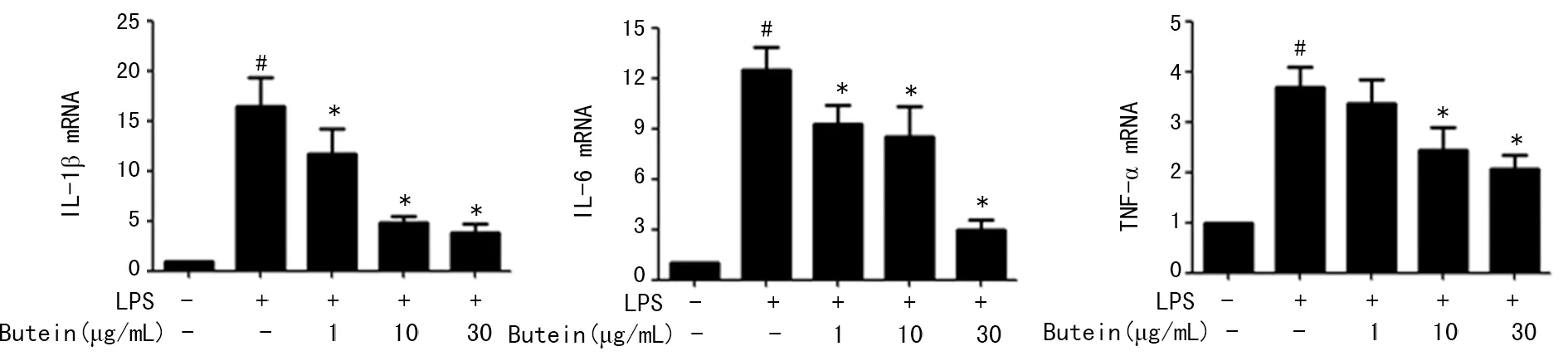
2.5Western blot检测紫铆因对LPS诱导 BV2小胶质细胞活化后NF-κB p65蛋白表达的影响 Western blot结果显示,正常组细胞中NF-κB p65蛋白主要在胞质中表达,细胞核内不表达或表达量很低;模型组细胞内NF-κB p65蛋白发生明显的核转移,由胞质转移至核内,表现为胞质内NF-κB p65蛋白表达明显降低,核内NF-κB p65蛋白表达明显升高;而实验组添加紫铆因预处理后,NF-κB p65在核内表达降低,胞质内表达升高,并呈一定的浓度依赖性,见图4。
图4 紫铆因对LPS诱导 BV2小胶质细胞活化后NF-κB p65蛋白表达的影响(n=3)
2.6Western blot检测紫铆因对LPS诱导 BV2小胶质细胞活化后ERK信号通路相关蛋白表达的影响 Western blot结果显示,与正常组相比,模型组细胞在LPS诱导BV2小胶质细胞活化后,细胞内ERK信号通路蛋白的磷酸化水平明显上调,p-MEK、p-ERK蛋白表达水平显著升高,但是p-Raf表达无明显变化。实验组添加紫铆因预处理后,能明显抑制细胞内p-MEK、p-ERK蛋白表达增强,对p-Raf表达依然无明显作用,Raf、MEK、ERK的表达均无变化,见图5。
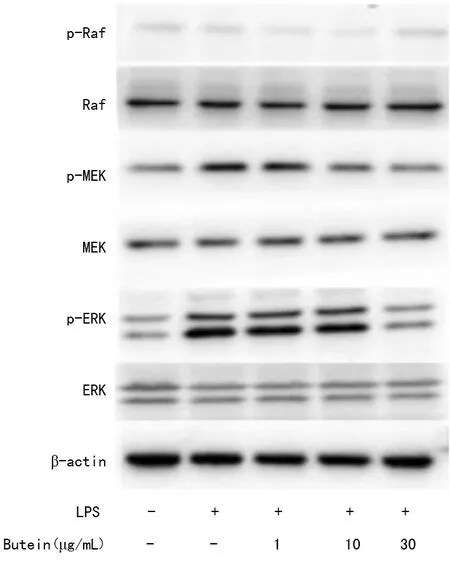
图5 紫铆因对LPS诱导 BV2小胶质细胞活化后ERK信号通路相关蛋白表达的影响(n=3)
3 讨 论
小胶质细胞是脑内主要的免疫效应细胞,对中枢神经系统稳态的改变非常敏感,很容易受外界刺激而激活,小胶质细胞一旦被激活,诱发一系列的慢性炎性反应,释放大量炎症介质、促炎因子和神经毒素,产生过量的氧自由基和亚硝基复合物,长期炎性刺激,导致神经元的突触功能障碍,促使神经元死亡,加速神经退行性疾病的发生发展[7-8]。因此,针对存在慢性神经炎症损伤的中枢神经退行性疾病的治疗中,比如是阿尔茨海默病(Alzheimer′s disease,AD),抑制小胶质细胞的异常激活或许具有潜在的临床应用前景。紫铆因是一种黄酮类化合物,是漆树科植物漆树皮的主要活性成分,具有抗氧化、抗炎症、抗癌等多种生物活性[4]。近来的研究表明,紫铆因对谷氨酸诱导的神经毒性具有抑制作用,可以降低氧化应激及减少氧自由基的产生[9];有研究证实,紫铆因对大鼠急性脊髓损伤模型具有保护作用,但其抗炎作用机制尚不明确。本实验中MTT结果显示,紫铆因本身对细胞活力无明显影响,说明紫铆因对小胶质细胞无细胞毒性。在LPS激活小胶质细胞后,细胞内IL-1β、IL-6、TNF-α的mRNA表达明显升高,而紫铆因干预后,可以显著降低以上炎症因子的表达,说明紫铆因可以抑制小胶质细胞的活化,减少炎症因子的产生。进而,对紫铆因抑制小胶质活化的可能作用机制进行初步探讨。结果发现,LPS活化小胶质细胞后,NF-κB p65被激活,从胞质转移至核内,并且ERK信号通路相关蛋白p-MEK、p-ERK水平升高。紫铆因干预后,明显逆转NF-κB p65的核转移,下调p-MEK、p-ERK的表达,进而减轻炎性反应。由此推断,紫铆因的抗炎作用可能与ERK信号通路相关蛋白的调控有关。
神经炎症的病理过程与炎症因子和炎症介质的产生密切相关,NF-κB(核转录因子κB)和MAPK家族(包括JNK,p38和ERK)在其中起到了关键的调节作用[10]。NF-κB是一种在细胞及组织内广泛存的转录因子,是多种信号转导途径的交叉点,并且是细胞凋亡、增殖及分化的关键位点,参与多种相关基因的转录调控[11]。NF-κB广泛存在于胶质细胞系,属于NF-κB/Rel蛋白家族中的一员,最常见形式是由多肽链P50和P65 2个亚基组成的异源二聚体。细胞处于静息状态时,NF-κB位于胞质中,与抑制蛋白(IκB)单体结合组成复合物,呈非活性形式。当细胞受到外界各种信号刺激时,NF-κB被激活,从复合物结构中游离出来,并移位至细胞核,启动基因转录[12-13]。炎症基因的表达正是受NF-κB的转录调控[14]。本实验结果显示,正常组细胞中NF-κB p65主要在胞质内表达;模型组由于炎症因子的刺激,NF-κB p65被激活,由胞质转移至核内,而添加紫铆因预处理抑制NF-κB p65的激活,降低它的转录活性,阻止其向核内转移,进而下调炎症因子的表达,抑制炎性反应,从而阻止炎性反应对神经元的损伤。MAPKs信号通路是细胞内最重要的信号通路之一,广泛参与细胞的生长、增殖、分化、凋亡等过程。ERK是其中一条途径,Raf、MEK都是ERK的上游分子。正常情况下,细胞中的Raf/MEK/ERK均以非磷酸化的形式存在,呈无活性状态;当受外界刺激时,Raf/MEK/ERK蛋白发生磷酸化,呈功能活性状态,启动相关细胞因子和炎性介质的基因表达[15-16]。本实验结果显示,模型组细胞中p-MEK、p-ERK蛋白表达均明显升高,呈活性功能状态,而添加紫铆因预处理可以显著逆转这一现象,并呈一定的浓度依赖性。说明紫铆因抑制小胶质细胞活化的作用机制可能与调节ERK 信号通路相关蛋白的表达有关。
综上所述,紫铆因可以抑制小胶质细胞的激活,通过下调炎症因子IL-1β、IL-6、TNF-α的表达从而减轻炎性反应,其作用机制可能与紫铆因下调NF-κB p65的转录活性和抑制ERK信号通路相关蛋白的表达有关。本实验通过这一系列的离体实验为紫铆因可能具有抑制慢性神经炎症发展的这一作用,提供了一定的理论依据,也为后续的在体试验打下了坚实的基础。
