足头向穿刺路径对近膈顶肝癌冷冻消融的临床应用
2018-08-29张莉敏王奇奇何春水
刘 源, 李 曦,张莉敏, 王奇奇,刘 洋, 王 科,钟 森, 何春水
热消融已经成为治疗肝癌的重要手段。对于近膈顶病灶,由于受肺组织和膈肌的影响,穿刺难度较大,并发症发生率较高,一直受肝癌消融治疗术者的关注[1-5]。 足头向穿刺路径(foot-head direction puncture pathway,FHDPP)是从肋膈角平面下方向头端进行倾斜穿刺,穿刺针可以避免经过膈肌和肺,有学者采用类似方法进行尝试,显示了一定优势[6-7]。本研究在CT重建的冠状面或矢状面上采用FHDPP对位于近膈顶的小于5 cm的肝癌进行穿刺和冷冻消融,探讨这种方法的临床应用价值。
1 材料与方法
1.1 材料
1.1.1 临床资料 纳入标准:经病理或临床诊断为肝癌患者,无论是否接受过外科切除或介入栓塞治疗;单发结节肿瘤直径≤5 cm,多发结节肿瘤数≤3个且最大直径≤3 cm;肝功能Child-Pugh分级A级或B级;无门脉癌栓或其他部位转移。排除标准:①肿瘤边缘距离胆囊、膈肌、胆总管、第2肝门、下腔静脉等重要结构小于5 mm;②肿瘤位于肝脏表面或侵犯间位结肠等空腔脏器;③肝功能Child-Pugh C级;④无法纠正的凝血功能障碍;⑤合并活动性感染,尤其是胆系感染等;⑥顽固性大量腹水、恶液质;⑦心、脑、肺、肾等重要脏器衰竭;⑧ECOG分级>2级;⑨意识障碍或不能配合治疗。
1.1.2 仪器设备与参数 采用国产靶向刀(AT-2008-Ⅱ,上海导向)为冷冻消融设备,消融冷刀规格:16 G*17 cm,氩气及氮气工作压力8268-10335 kPa(1 200~1 500 psi)。 采用西门子 sensational 16 排螺旋CT为影像引导设备。
1.2 方法
1.2.1 术中穿刺操作 ①心电监护、吸氧、右美托咪啶(江苏恒瑞公司)持续泵入镇静。②在平静呼吸情况下,进行螺旋CT扫描,在工作站用1.5 mm薄层图像行冠状面或矢状面重建,并按计划选取相应层面并再次确认具体足头向穿刺路径,并在体表确定进针点。③消毒、铺巾、局麻,以16 G冷刀(AT-2008-Ⅱ,上海导向)经预定穿刺点、沿计划穿刺通路和角度进针。④一般先进针3~5 cm,再次行CT扫描和冠状面或矢状面重建,观察冷刀的角度、位置,进行相应调整和进针,然后再进行扫描和重建图像。如此不断重复,直到冷刀进入瘤体内部预定位置。
1.2.2 冷冻消融治疗 CT显示冷刀在瘤体内分布满意后,进行冷冻消融,冷冻至-140℃~-160℃,持续14~16 min,然后开启电复温模式,复温至30℃,为第1冷冻循环。然后进行第2循环,方法同前[8]。可根据冷刀与瘤体位置关系,在复温后沿原穿刺方向前进或后退冷刀1~3 cm,再次消融。要求低密度冷冻区域超出病灶边缘5 mm。所有病灶一次布针完成后进行消融,术中不再调整进针角度重新穿刺、消融。术毕,撤出冷刀。
1.2.3 术后处理 术后卧床休息,心电监护,吸氧,禁食6 h,监测体温,观察疼痛情况。术后常规保肝、止血、对症、预防感染治疗。术后3~4 d复查肝功能、血常规。
1.3 评价指标
1.3.1 穿刺技术相关评价
1.3.1.1 穿刺技术成功率:消融冷刀能够按计划达到满意分布的病灶数量/总的病灶数量,也即是“实现技术成功的病灶数量”/总的病灶数量。
本研究规定满意分布定义为穿刺操作结束时,根据冷刀的位置、输出功率、冷冻能力,推测冰球三维径线长度,判定消融结束后消融区域能够覆盖整个瘤体。
1.3.1.2 穿刺相关技术参数:记录穿刺过程中的CT扫描次数、穿刺操作时间和穿刺路径长度。CT扫描次数定义为每个病灶,从第1次扫描开始至准备对该病灶进行冷冻消融治疗时,CT扫描的次数。穿刺操作时间定义为每个病灶从穿刺开设至准备对该病灶进行冷冻消融时的时间。穿刺路径长度为经皮肤进针点至冷刀尖端的距离,若有2把以上冷刀,则取平均值。
1.3.2 手术安全性评价
1.3.2.1 穿刺安全性评价:观察患者有无出血、气胸、空腔脏器损伤等穿刺所致并发症。
1.3.2.2 消融安全性评价:观察患者术中、术后疼痛情况,发热、膈肌损伤、破裂、出血、空腔脏器损伤等消融所致情况。观察有无冷休克(cryoshock)和过冷反应(cryoreaction)出现。冷休克和过冷反应为与冷冻消融相关的特殊并发症,前者主要表现为多脏器功能衰竭、严重凝血障碍、血管内播散凝血等,后者主要为寒战、发热、心动过速、一过性肌酐升高。
1.3.3 疗效评价及术后随访 术后1个月复查增强CT或增强MRI,评价目标病灶是否实现完全消融。术后每3~4个月复查增强CT或MRI,观察目标病灶是否出现复发。
2 结果
2.1 一般资料
自2015年10月至2016年12月,共有33例经病理确诊或符合临床诊断标准[1]的肝癌患者,且瘤体直径和数目符合纳入标准。全部符合标准的33例患者中,病理诊断9例,临床诊断24例。男24例,女9例,年龄41~74岁(中位年龄59岁),75.75%(25/33)合并乙肝病毒感染。7例AFP阴性(≤400 ng/mL);26 例 AFP 阳性(>400 ng/mL),肝功能 Child-Pugh A、B级者分别为26、7例。全部33例患者,病灶总数37个,29个患者有1个病灶,其余4例患者有2个病灶,平均直径(3.3±0.41)cm。按原发性肝癌临床分期[1],Ⅰa期 29 例,Ⅰb 期 4 例。
2.2 FHDPP相关技术指标、疗效、并发症
消融术中,CT扫描显示消融区域为形状规则的椭圆形低密度区域,边界清楚,消融范围与周边有无临近的大血管相关,通常单把冷刀消融范围的长×宽×高为4.5 cm×3.0 cm×3.0 cm,2把或多把刀联合应用,消融的病灶体积可进一步扩大。全部37个病灶中,34个成功行FHDPP和治疗,穿刺技术成功率91.9%(34/37)。有2例患者2个病灶因为紧张和呼吸不能配合在穿刺中途放弃手术,1例患者1个病灶因为术中采用俯卧位后发现穿刺距离过远,多次尝试后,消融冷刀仍呈较大角度偏离瘤体,未能成功。扫描次数中位数14.0,平均穿刺操作时间35.2 min,平均穿刺路径长度10.97 cm。(图1)
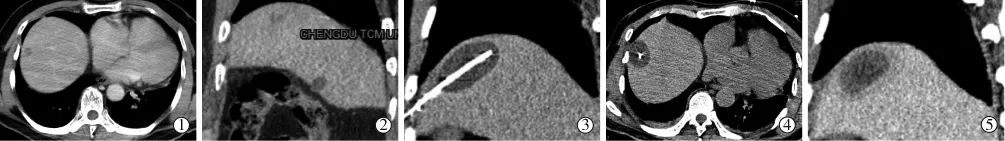
图1 男性,74岁,右肝Ⅷ段膈肌下方肝癌
2例患者因消融冷刀误入胸腔而出现少量气胸。术中有1例出现轻微疼痛,未予以进一步处理。其余患者均未诉疼痛不适。术中、术后无冷休克、膈肌损伤、死亡等严重并发症出现。
术后1个月影像学复查,82.4%(28/34)病灶实现完全消融,表现为消融区域在动脉期、门静脉期均无强化,同时未见肿瘤组织残留。术后25例患者行增强CT或MRI随访了12~24个月,27个目标病灶中有23个病灶(85.2%)未见复发,消融区域进一步缩小、塌陷,4个病灶(14.8%)局部出现复发,9例患者失访。
3 讨论
近膈顶部的肝癌病灶,一方面由于病灶邻近膈肌、肺组织,加上膈肌血供丰富,容易出现肺损伤、出血、膈肌破裂等严重并发症,另一方面穿刺路径受到肋骨、肋膈角、肺组织等限制,不容易实现满意布针。因此被认为是消融难度最大、最具有挑战的区域。张玉杰等[5]发现若病灶距离膈肌小于5 mm,并发症发生率17.4%,明显高于距离大于5 mm的病灶。其他学者报告并发症发生率0.8%~2.1%,包括气胸、胸腔积液、出血等,处理不恰当可以导致死亡[9-11]。
前人对近膈顶部肝癌消融穿刺途径的探索包括:①常规穿刺途径结合其它增加消融安全性的措施,主要有胸腔镜引导、人工胸(腹)水[12-15]。 对于老年、心肺功能不佳者,风险较大。如果在CT引导下消融,多数医院的CT室不具备实施全麻条件,实用性和可操作性不强。②采用特殊的穿刺途径。直接经皮、肺穿刺病灶,但血胸、气胸的发生率高达28.6%,对于肿瘤直径大、预计穿刺次数多,或肺功能差的患者,不能采用[16]。术中可能损伤膈肌,导致膈肌刺激症状,甚至膈疝[17]。吴宇旋等[6]探讨了跨横断面的穿刺技术,但该路径需要复杂的几何模型和数据运算,较为烦琐和抽象,需要术者良好的空间构想能力,效率不高。李智等[7]应用电磁导航影像引导系统,采取斜行穿刺,但需要另外购置软件和设备。
FHDPP的实质是经腹腔由肋膈角下方平面从足端向头端穿刺,故本研究命名为足头向穿刺路径。穿刺术中,术者在CT扫描设备上即时重建的矢状面或冠状面图像引导下进针,通过进针→CT扫描→重建冠(矢)状面图像→评价穿刺针位置→再进针的穿刺过程,将消融针穿刺到瘤体内理想的位置。优点在于重建图像直观显示了消融针、病灶的位置,同时省略了复杂的计算,不需要购买新的设备。由于CT设备的进步,大多数医院都有条件在16层及以上的螺旋CT上进行穿刺引导和消融。因此,术中CT进行多平面重组并给出冠、矢状面图像的速度很快,不会延长穿刺、消融的手术时间。也为采用该方法穿刺提供了设备保障。
由于FHDPP穿刺路径不经过膈肌并与膈肌平行或大致平行,因此消融区域长轴也与膈肌平行或大致平行。这种情况下,消融区域如果与膈肌接触,由于冰球的体积膨胀,会将膈肌向外轻微推移,冰球不会穿透膈肌,也不会影响到肺组织。这种穿刺方式的另一个优点是不会出现穿刺冷刀贯穿膈肌,造成冷刀工作区域横跨膈肌,消融后出现膈肌破裂、大出血的严重并发症的情况。所以足头向组除了2例穿刺造成气胸外,没有严重的穿刺、消融相关并发症出现。张玉杰等[5]报道的在该部位消融后膈肌损伤、出血、胸水等并发症发生率在11.8~17.4%,Toyoda等[16]采用经胸经肺途径行射频消融,血胸、气胸的发生率高达28.6%。本组的并发症发生率处于较低水平,体现了该穿刺入路的优点。
李智等[7]应用电磁导航的影像引导系统,采取经皮经肝的斜行穿刺途径,对19个位于膈肌下方平均直径32±10 mm的肝癌病灶进行消融治疗,16个(84.2%)病灶实现完全消融,3个(15.8%)病灶不完全消融。刘丽莉等[18]采用“立方体模型”对近膈顶平均直径24 mm的59个病灶进行射频消融,治疗成功率94.92%,完全消融率84.75%。
本组患者穿刺技术成功率为91.9%,术后1个月影像学复查,82.4%病灶实现完全消融,与前人研究相当。说明多数病灶能实现较为满意的穿刺布针,并能成功消融。对于穿刺成功了的病灶,仍有17.6%病灶没有实现消融区域完全覆盖,主要原因在于本研究纳入的病灶平均直径为3.3 cm,相对其它研究的病灶稍大。其次由于“热沉淀”效应影响和担心损伤临近重要结构,没有在术中进一步增加消融时间和强度。同时由于冷冻后病灶变硬,为规避出血风险,没有再次调整角度进针和消融。
术后对完全消融的病灶进行了12~24个月的连续复查,仍有一定比例(14.8%)的病灶出现局部复发,有可能是消融的边界仍未能完全覆盖肿瘤,或消融区域超出肿瘤边界仍不够大。Hinshaw等[19]与Li等[20]报道低密度冷冻区边缘温度为0摄氏度,该区域有肿瘤存活。边缘内5 mm为-20℃~-50℃,仍有可能有肿瘤存活,因此建议将低密度冷冻区域展到瘤体外1 cm。也有学者提出在原有2个循环的基础上,再增加1个循环,以彻底灭活肿瘤[21]。由于本研究的病灶靠近膈肌,如果增加消融范围和时间,将导致相关并发症发生率的增加,因此需要手术医生术中进行利弊权衡。同时对于影像学评价为完全消融的病灶,术后仍应注意长期密切随访,警惕消融区域内出现复发。
