基底动脉尖区动脉瘤合并基底动脉尖综合征介入术相关性分析及治疗进展
2018-08-29杨净松黄建强
杨净松, 赵 卫, 黄建强
血管内治疗后循环动脉瘤较手术更安全[1-3],其中基底动脉尖区(tip of basilar artery,TBA)动脉瘤占多数[4-6]。由于以上动脉存在诸多穿支,介入手术相关的穿支动脉损伤、闭塞可能导致基底动脉尖综合征(top of the basilar syndrome,TOBS),出现严重的并发症导致患者重残、死亡。TOBS是基底动脉尖及分支闭塞而产生一系列临床综合征,以丘脑、中脑、颞枕叶等损害为主[7],本文主要对基底动脉尖及其各分支动脉动脉瘤介入术后发生TOBS相关解剖学基础、影像特点、介入手术中可能引起TOBS的操作及栓塞技术等潜在危险因素进行分析,并结合近来介入技术的进展,对术中、术后TOBS的预防及处理进行讨论。
1 TBA动脉瘤栓塞治疗后发生TOBS
1.1 TBA各穿支分布及穿支闭塞后相关临床症状
基底动脉顶端穿支血管闭塞可能引起中脑顶盖区至动眼神经核等缺血,导致同侧动眼神经麻痹、凝视麻痹、复视、瞳孔散大[8]。
大脑后动脉(posterior-cerebral artery,PCA)动脉瘤并发夹层、巨大动脉瘤可能性较大,P1段+P2段动脉瘤约占全部PCA动脉瘤的70%[9],大多数的穿通支闭塞损伤等严重的术后并发症发生于此,而P3、P4段由于距离远,微导管难以到位,常选择闭塞载瘤动脉,且一般无严重的并发症。PCA近端发出穿支动脉包括:①丘脑穿动脉(thalamo perforating arteries,TPA):是P1段较为恒定的穿支动脉,约3.1支/侧,TPA由1支或多支主干发出往往提示动脉干周围小穿支动脉发出的减少甚至缺失[10],闭塞可能引起对侧偏瘫、共济失调、意识障碍、认知功能障碍、眼球运动障碍(动眼神经麻痹)以及对侧半身舞蹈(红核综合征)等[10-12];Percheron 动脉(artery of Percheron,AOP)是一种解剖变异,表现为TPA双侧共干并发出分支供应双侧丘脑旁正中及中脑嘴部,主干血管起源更加靠近分叉处,阻塞引起供血区域梗死,可累及丘脑上行性网状激活系统和丘脑边缘系统等,出现三联症:垂直凝视麻痹、意识障碍、记忆障碍。由于AOP管径小,CTA、MRA等很难发现,判断梗死主要通过临床表现和典型的MR表现,即双侧丘脑腹内侧DWI高信号合并或不合并中脑嘴部“V”型高信号[13-14];②旋支(circumflex branches):根据其终止位置分为短旋动脉(short circumflex arteries,SCxA)和长旋动脉(long circumflex arteries,LCxA),闭塞可能导致后连合、Darkschewitsch核、Cajal核等区域缺血梗死,引起眼球垂直运动障碍[11-12]。③脉络膜后内侧动脉(medial posterior choroidal arteries,MPChA):缺血可能出现情绪反应异常、低落、偶见短暂的记忆减退[15]。其余PCA穿支如丘脑膝状体动脉(thalamogeniculate arteries,TG arteries)、大脑脚穿动脉(peduncular perforating arteries)、脉络膜后外侧动脉(lateral posterior choroidal arteries,LPChA)等闭塞可能引起典型的丘脑症候群(Dejerine-Roussy综合征)发生对侧偏身感觉异常、丘脑痛、对侧痉挛性偏瘫、动眼神经麻痹、对侧面瘫、震颤、共济失调等。
小脑上动脉(superior cerebellar artery,SCA)穿支闭塞可能引起恶心、呕吐、眩晕、意向性震颤、肌张力降低等,靠近基底动脉的穿支闭塞可能引起脑干症状[16]。
1.2 术中、术后出血,炎症刺激引起血管痉挛
术中血管痉挛主要由于操作不得当如导丝反复置入刺激血管壁、弹簧圈反复调整位置时刺激血管、未及时使用扩张血管药物及术前抗血管痉挛药物应用不及时等[17];术后血管痉挛主要由于蛛网膜下腔出血吸收过程中红细胞破坏引起炎性反应导致脑水肿导致血管受到炎性刺激导致痉挛。张健等[18]认为尽早进行脑脊液外引流可以有效缓解蛛网膜下腔出血后的血管痉挛,但脑脊液外引流也存在增加脑脊液通路发生医院感染等风险。
1.3 基底动脉顶端动脉瘤栓塞后弹簧圈移位及栓塞后占位效应
基底动脉顶端至PCA分叉部由于其特殊的血流动力学及血流切应力等因素,是TBA动脉瘤最常见部位,此处发生动脉瘤有形态不规则、宽瘤颈、常累及周围血管的特点,特殊的血流及解剖学特点,使得此处动脉瘤的栓塞难度大,发生并发症更严重,即使采用支架辅助栓塞,也可能出现弹簧圈团由于压力过大导致支架塌陷而出现严重后果(图1);基底动脉顶端处周围有视神经、动眼神经等重要脑神经毗邻,动脉瘤栓塞后可以形成类似肿瘤的“占位效应”而导致患者出现偏盲、上睑下垂、双侧瞳孔不等大等症状,但相较动脉瘤搏动时引起的压迫症状缓解,且一般在术后6个月~2年内症状可以得到缓解。
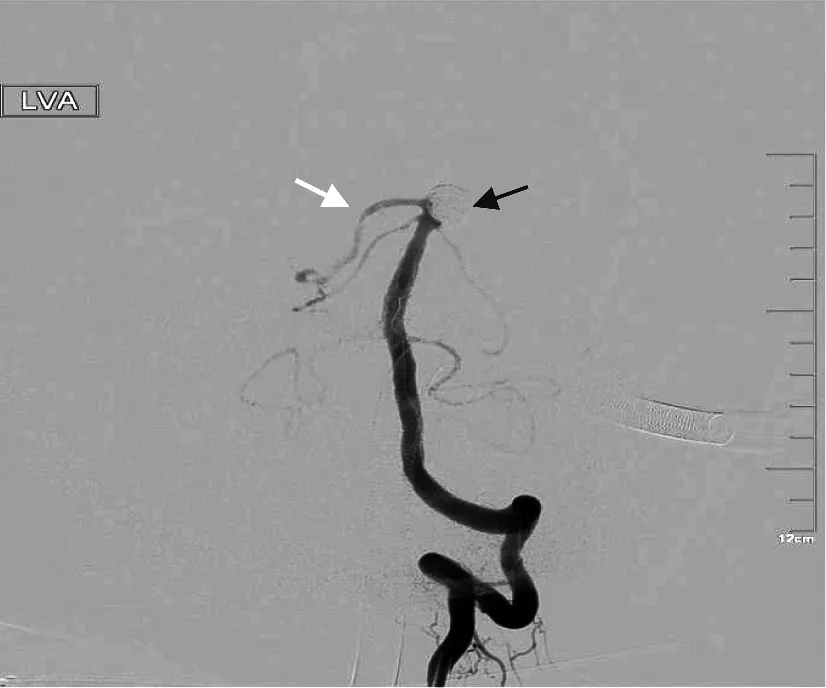
图1 基底动脉顶端宽颈动脉瘤栓塞并弹簧圈移位
综上,据临床病例分析及相关文献所载,介入术后发生TOBS原因主要有:基底动脉顶端及PCA重要穿支血管术中闭塞、损伤;蛛网膜下腔出血导致迟发脑水肿、炎性反应等引起血管痉挛,基底动脉尖供血区域缺血梗死;栓塞器材如弹簧圈在基底动脉尖区域中产生占位效应,压迫周围神经、血管,导致相应症状。
2 基底动脉顶端及分支血管动脉瘤血管内治疗进展
2.1 TBA动脉瘤的治疗进展和思考
文献指出造影发现70%瘤顶朝上,10%~15%瘤顶向前,余向后,动脉瘤栓塞引起的穿动脉闭塞是导致该段出现TOBS的主要原因,在治疗时应结合3D-DSA对瘤顶解剖特点进行观察。
单纯弹簧圈栓塞可能并发弹簧圈突出、脱出、解旋等,引起PCA、SCA穿支闭塞,尽管弹簧圈新技术如Medina®装置[19]等具有瓣膜覆盖瘤颈和阻断动脉瘤血流快速形成血栓的特点,仍可因瘤腔大小不匹配等原因导致压缩和不完全栓塞,且常需要其他型弹簧圈同用而出现相同问题,对于这种动脉瘤常使用球囊或支架辅助栓塞,席春江等[6]使用超顺应性Hyperform分叉球囊进行TBA宽颈动脉瘤栓塞,取得不错效果,但球囊辅助栓塞可能需要暂时闭塞一侧甚至双侧的后循环血流,可能引起后循环缺血甚至脑梗死、穿通支动脉闭塞,且在球囊辅助成型后,弹簧圈再移位的可能[20];随着支架辅助弹簧圈栓塞技术的进展,对于多数宽颈动脉瘤,支架辅助栓塞已经成为首选的血管内治疗方法,在长期疗效、安全性、防止动脉瘤复发等方面也得到肯定[20-21]。对于 TBA 宽颈动脉瘤,可使用“Y”型支架技术[20-21],将开环和/或闭环支架(虽然选择开环或闭环支架对动脉瘤栓塞效果及并发症发生等无显著关系[22],但根据报道[23],Enterprise支架具有更好的顺应性和可操作性且配套微导管相对细,使得支架更易到位并释放,支架尾端可平行放置也可以交叉“kissing”,也有学者认为可以使用Livis支架,但穿网眼相对困难)同时或分别置入两侧PCA,支架辅助可防止弹簧圈解旋,使弹簧圈盘绕得更密,具有血流动力学重建和保护重要分支及穿通支血管的作用[23],改变动脉瘤口部的血流动力学特点,降低动脉瘤复发出血的风险,多支架的应用,在严格规范的抗血小板凝集治疗下并不会增加血栓事件的发生率[22,24]。 TBA 动脉瘤瘤口常累及分支动脉,为了维持分支动脉血流,在支架辅助栓塞时,常不得不采用成篮技术疏松填塞动脉瘤腔而出现动脉瘤栓塞不完全、复发,且Y型支架的特点使得对于复发的动脉瘤再次介入治疗难度非常高[24]。
TBA动脉瘤的Y型支架辅助弹簧圈栓塞的重要意义不在于使栓塞更致密、更完全,而在其支撑、保护分支血管成型和顶端血流重建作用,避免弹簧圈突入分支导致严重的TOBS。PulseRider装置(Pulsar Vascular)作为一种新型的分叉部动脉瘤辅助栓塞器材,设计理念印证了这一想法,PulseRider技术比Y型支架具有放置过程相对简单、仅顶端动脉瘤瘤颈支撑部覆盖金属、可回收重新放置、对分支血管内膜刺激小的特点,其治疗的安全性及有效性也得到肯定[25-26]。
即使有保护装置,也不代表可以无顾忌地追求动脉瘤完全栓塞,追求完美而进行致密填塞可能会出现过度栓塞、瘤颈处压力过大,甚至出现弹簧圈整团或部分移位导致支架塌陷、弹簧圈进入支架,造成分支狭窄、血栓形成甚至闭塞(图1),在动脉瘤顶栓塞后若由于栓塞效果未达到相对满意,应在之后每次弹簧圈填塞后造影,若出现血管闭塞等并发症立即抢救,这种情况可以采用球囊预保护。Guenego等[27]就报道将新型同轴双腔球囊导管(COP2L)应用于介入栓塞术中发生的穿支动脉闭塞与血栓形成的抢救,这种导管可以兼容多种支架输送系统,可以作为血栓栓塞或出血事件的预保护措施。
有学者报道将pCONus、pCANvas等应用于分叉部动脉瘤辅助栓塞取得不错效果[28-29],pCONus支架基于Solitaire AB,远端由两股交叉尼龙纤维构成,周围有4个类似花瓣样结构,这些瓣在输送至动脉瘤腔内部后部分分布在瘤颈,起到固定和辅助栓塞的作用,pCANvas支架是在pCONus的远端瓣上覆膜,以达到阻断动脉瘤内血流的作用,Perez等[30]通过测量动脉瘤的平均流的振幅比(MAFA)发现pCANvas相比于pCONus可以明显减少动脉瘤腔内的血流。其他的分叉部宽颈动脉瘤栓塞装置如WEB动脉瘤囊内栓塞装置,在诸多外文报道中发现其在随访过程中出现变形压缩、瘤颈残留,对分叉部动脉瘤的栓塞中长期效果不佳[31-32]。
2.2 PCA动脉瘤的治疗进展和思考
在P1段宽颈、夹层动脉瘤,多采用支架辅助栓塞,由于P1段存在诸多穿支动脉,且半数以上的丘脑穿动脉为双侧性分布,故单支穿通支闭塞引起TOBS的发病率和病损程度由于代偿而降低,支架辅助栓塞导致TPA闭塞引起临床症状一般不严重,但AOP等存在双侧供血特点,应特别注意动脉瘤瘤颈附近有无Perchreon动脉存在,在进行栓塞时若存在单支AOP发出诸多小穿支或对侧TPA的血供不明确时,不能闭塞该动脉,否则会引起严重的TOBS甚至致死,Perchreon动脉较其他穿支粗,可采用导管、导丝保护技术,将微导管/导丝在栓塞前预先置于穿动脉内,再行动脉瘤瘤顶的疏松栓塞,注意成篮方向不要朝穿动脉发出方向,再使用单或多支架覆盖瘤颈,这样既保存穿动脉血供,又降低动脉瘤复发出血的可能性。支架微导管存在顺应性差、不易到位等缺点,LVIS Jr支架可以用于管径更小的微导管,使得远端血管的到位及支架放置难度大大降低[33],在发现动脉瘤瘤颈周围存在穿支血管时,还可以通过“灯笼”和/或“压缩”技术,调整支架对于瘤颈及周围血管的金属覆盖率,重塑瘤颈形态以达到保护穿通支及动脉瘤栓塞的目的,可以应用于P1段及P2段宽颈、夹层动脉瘤,但应注意PCA血管直径较小,应注意选择适宜支架,LVIS支架在小血管中会被拉长,改变金属覆盖率后可能导致血栓事件及周围穿支闭塞可能[34],这更强调了术后严格抗血小板凝集的重要性,美国食品药品监督管理局(FDA)2010年曾声明:氯吡格雷代谢减低者,抗血小板治疗效益降低[35],故对于颅内支架辅助栓塞的患者,应常规行CYP2C19基因检测,对于携带功能减少类型基因者,可加量使用氯吡格雷或更换其他抗血小板凝集类型药物如替格瑞洛[36]。
大部分P2段分支及穿支有丰富的侧支循环,闭塞后少有严重的缺血症状,在微导管无法超选择或诊断为假性动脉瘤时,通常选择载瘤动脉闭塞[36-37],但相关文献并未报道闭塞血管的具体位置(P2A或P2P),根据相关解剖文献,丘脑膝状体动脉多从P2段中后发出且存在诸多侧支,当存在胚胎型大脑后动脉时,原P1段的穿通动脉由何处发出,是否存在穿通支发出位置变异等尚无相关解剖学研究,Xu等[38]认为存在胚胎型大脑后动脉时进行闭塞载瘤动脉是非常危险的,应在术前行闭合试验及造影观察周围血管侧支及软脑膜动脉对载瘤动脉供血区域代偿等,但闭合试验也存在假阳性、患者烦躁不配合,有学者在栓塞术前行P2段远端的搭桥术,但患者依然有可能因供血动脉流量过小而导致脑卒中[39]。有报道在PCA的P2段及远端PCA使用导管栓塞装置(pinpeline embolization device,PED),PED装置对于梭形动脉瘤等是安全有效的,伴较低的分支动脉闭塞率,缺点是其管径最小2.5 mm,放置后小的血栓形成可能导致严重的血栓事件,有报道PED用于伴有胚胎型大脑后动脉的动脉瘤栓塞时,动脉瘤栓塞效果不佳[40]。
2.3 小脑上动脉
由于小脑上动脉与其他小脑供血动脉及基底动脉等存在丰富的侧支循环,出现远端超选择插管困难等导致无法精确栓塞动脉瘤时,可以行小脑上动脉闭塞,但大多数SCA动脉瘤位于基底动脉-小脑上动脉起始部,甚至可见SCA发自动脉瘤瘤颈,故多使用支架辅助弹簧圈后释放技术栓塞动脉瘤,在栓塞中应注意动脉瘤成篮方向,尽量避免栓塞SCA引起严重的脑干症状。
TOBS作为TBA及其分支血管动脉瘤血管内治疗及手术治疗的严重并发症,在诸多文献中提及,供应丘脑、脑干、中脑的穿通支血管闭塞是引起严重致残、致死事件的主要原因,术中通过造影(3DDSA等)识别穿动脉并预估穿通动脉损伤和支架辅助栓塞后的抗凝治疗十分重要。随着颅内介入手术技术的发展和成熟,穿动脉保护愈来愈受到术者重视,对于TBA解剖研究的深入以及介入方法、器材的进步,可以有效减少甚至避免TOBS的发生,尤其是特殊类型如胚胎型大脑后动脉动脉瘤的介入治疗及TOBS的介入治疗有望得到解决。
