基因组改组选育的益生性乳杆菌对小鼠肠道菌群的影响
2018-08-29赵玉娟段翠翠高磊牛春华于雪李盛钰
赵玉娟,段翠翠,高磊,牛春华,于雪,李盛钰
(吉林省农业科学院农产品加工研究所,长春 130033)
0 引 言
粘附是乳杆菌细胞表面结构与宿主肠上皮细胞和黏膜表面受体的相互作用,是乳杆菌定植的第一步,是乳杆菌得以在宿主体内生长繁殖并发挥其益生作用的前提。本课题组自内蒙古奶豆腐中分离、鉴定得到植物乳杆菌C 88,大量的研究结果表明,该菌株具有良好的益生特性(耐酸、耐胆盐等)、功能特性(抗氧化[1]、降胆固醇[2]等)和发酵特性[3],具有作为益生菌开发的潜力。为了进一步提高该菌株的粘附能力,本课题利用基因组选育技术获得四株粘附能力增强的重组菌株[4]。为了验证重组菌株在宿主肠道的粘附情况和对肠道菌群的影响,本研究以昆明小鼠构建动物模型,通过观察野生菌株和重组菌株在小鼠肠道内的定植能力、粘附能力和对肠道内微生物菌群的调节能力,来评价重组菌株的益生功效,为重组菌株后续的应用和产品开发提供理论基础。
1 材料与方法
1.1 试验材料
野生菌株(植物乳杆菌C 88)和基因重组菌株(植物乳杆菌F3-1、F3-2、F3-3和 F3-4)为本试验室保藏,菌株在含体积分数为30%甘油的M RS培养基中,-80℃冻存。使用前接种于MRS液体培养基,37℃活化2次。将活化好的植物乳杆菌培养至稳定期,6000×g,4℃,离心10 min,收集菌泥,用无菌PBS溶液重悬,平板计数测定菌数,将菌悬液浓度调整至1×109cfu/m L备用。
昆明小鼠(4周龄,雄性,18~22 g),小鼠常规饲料,购自长春市高新医学动物中心。
异硫氰酸荧光素(fluorescein isothiocyanate,FITC),Biotium Inc.公司,购自上海开放生物有限公司。
1.2 培养基
乳杆菌培养基(LBS)、双歧杆菌培养基(MRS+NNLP)、肠道菌培养基(VRBDA)、肠球菌培养基(BEA)、产气荚膜梭菌培养基(TSC),参照文献方法[5]配制.
1.3 实验动物饲养
动物室温度22℃,相对湿度55%,每天更换垫料,控制每日日光12 h,黑暗12 h。喂普通饲料,蒸馏水。适应性饲养3 d后,每天定点灌胃乳杆菌菌液。
1.4 菌株在小鼠肠道内的定植研究
将小鼠随机分为6组,每组10只,分别为空白对照组、C 88组、F3-1组、F3-2组、F3-3组和F3-4组。空白对照组小鼠每次灌胃0.4 m L无菌PBS,实验组分别灌胃0.4 m L C 88、F3-1、F3-2、F3-3和F3-4菌液,连续灌胃7 d。分别于0、7 d和实验结束后第7 d,断颈处死小鼠(每次实验取2只小鼠),无菌取小鼠空肠、回肠和盲肠内容物进行乳杆菌总数测定。
1.5 菌株在小鼠肠道内的粘附性研究
(1)细菌荧光标记
采用FITC荧光染色方法标记细菌[6],调整菌株终浓度为2×109cfu/m L。
(2)冰冻组织切片
实验小鼠灌胃0.4 m L菌液,连续灌胃3 d。在处理的前一天,实验小鼠禁食不禁水,实验结束当天,断颈处死小鼠后无菌取出小鼠空肠,将组织平放于无菌锡纸上,加入适量的OTC包埋剂,浸没组织,缓慢放入盛有液氮的小烧杯中,液氮冷冻成型,-80℃保存[7]。采用Leica冷冻切片机CM 1900制作切片,使用O lympus激光共聚焦显微镜进行荧光检测。
1.6 菌株对小鼠肠道微生物菌群的影响
将小鼠随机分为6组,每组10只,分别为空白对照组、C 88组、F3-1组、F3-2组、F3-3组、F3-4组,空白对照组小鼠每次灌胃0.4m L无菌PBS,实验组分别灌胃0.4m L C 88、F3-1、F3-2、F3-3、F3-4、菌液,连续灌胃7 d。分别于0、7 d和实验结束后第7 d,断颈处死小鼠(每次实验取3只小鼠),无菌取小鼠粪便,测定粪便中主要菌群。
宏基因组分析:选择野生菌株C 88组、粘附性较强的重组菌株F3-3、F3-4进行小鼠肠道菌群宏基因组分析。分别于0、7 d和实验结束后第7 d,断颈处死小鼠,无菌取小鼠粪便,利用试剂盒提取小鼠粪便中的基因组,送至上海派森诺生物科技有限公司利用宏基因组16SV1-V3区检测小鼠肠道微生物的差异。
2 结果与分析
2.1 菌株在小鼠肠道内的定植能力分析
乳杆菌在小鼠肠道内的定植主要集中在小肠末端和大肠中部,所以本研究选择小鼠的回肠、盲肠和空肠来研究野生菌株和重组菌株在小鼠肠道的定植情况,结果见表1。实验期间,对照组小鼠盲肠、回肠和空肠内容物中乳杆菌的数量没有明显区别,基本保持稳定。实验组小鼠灌胃野生菌株C 88、重组菌株F3-1、F3-2、F3-3、F3-4后,小鼠肠道不同部位内容物的乳杆菌数量明显上升,其中盲肠定植的数量最高,其次是结肠,回肠中最少,在灌胃第7 d数量达到最高,灌胃C 88组盲肠中乳杆菌的活菌数达到8.15 log CFU/g,灌胃重组菌株实验组活菌数达到8.23~8.52 log CFU/g,结果表明重组菌株的定植能力高于野生菌株。停止灌胃7天后,各肠道内容物的乳杆菌数量与灌胃期间相比有所下降。实验结果表明,菌株在小鼠肠道内的定植时间小于7 d。徐致远[8]对植物乳杆菌ST-III在小鼠肠道内定植情况进行研究,结果表明定植主要集中在小肠末端和大肠中部,各部位肠道定植的数量也不同,结肠内定植最多,回肠内其次,在各部位定植的时间也不同,在结肠内定植时间最长。
2.2 乳杆菌在小鼠肠道内的粘附
免疫组化激光共聚焦成像方法观察野生菌株和重组菌株在小鼠肠道内黏附的情况,具体结果如图1所示。与植物乳杆菌C 88相比,重组菌株的粘附增强不同,重组菌株F3-3和F3-4表现出比F3-1和F3-2更强的粘附率。此外,重组菌株F3-4的粘附性稍微高于重组菌株F3-3。实验证明,乳杆菌能够粘附在小鼠体内,且重组菌株的粘附能力较野生菌株明显提高。
2.3 菌株对小鼠肠道内微生物菌群的影响
2.3.1 菌株对小鼠肠道菌群的影响
实验小鼠灌胃野生菌株和重组菌株后,检测小鼠肠道内的乳杆菌、双歧杆菌、肠杆菌、肠球菌和产气荚膜梭菌的数量,具体结果见图2。
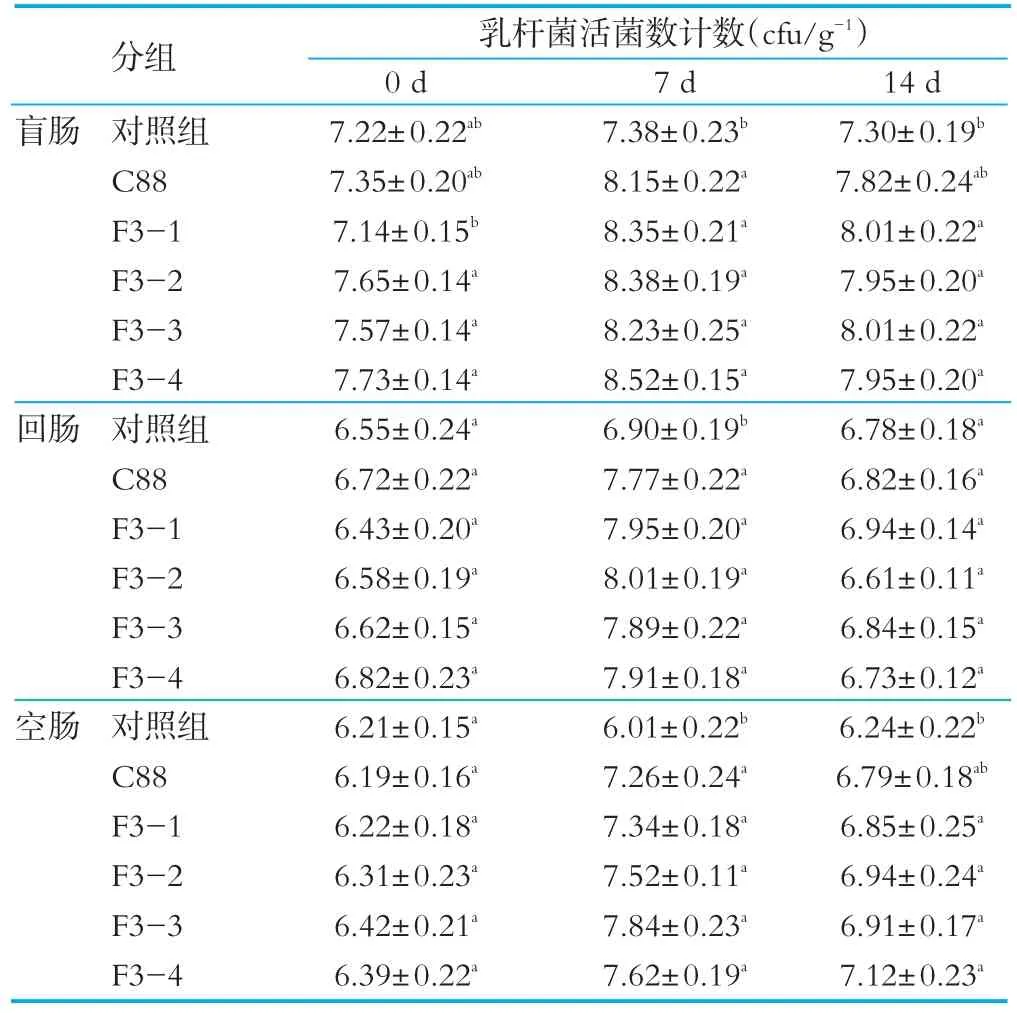
表1 小鼠肠道乳杆菌活菌数量计数
实验期间对照组小鼠肠道内益生菌和有害微生物的数量变化不显著,而灌胃野生菌株C 88和重组菌株F3-1、F3-2、F3-3、F3-4后,小鼠肠道微生物在灌胃7 d后发生明显的改变,具体如图2 A-E所示。小鼠肠道内益生菌的数量明显增加,与对照组相比差异显著(P<0.05),灌胃野生菌株C 88后,肠道内乳杆菌(图2 A)的数量为3.1×108cfu/g,双歧杆菌(图2B)的数量为2.5×108cfu/g,而灌胃重组菌株后肠道益生菌的数量更多,其中灌胃重组菌株F3-4后乳杆菌(图2A)的数量达到3.2×109cfu/g,双歧杆菌(图2B)达到8.4×108cfu/g,分别是野生菌株的10倍和3.3倍,因此重组菌株更有利于增加小鼠肠道内益生菌的数量。另外,灌胃野生菌株和重组菌株可以抑制小鼠肠道有害微生物的黏附,如灌胃重组菌株后显著降低小鼠肠道内肠球菌(图2 D)的数量(P<0.05),灌胃野生菌株C 88后,小鼠肠道内肠球菌的数量由2.6×107cfu/g降低至2.05×107cfu/g,而灌胃重组菌株F3-4则由2.1×107cfu/g降低至6.6×106cfu/g,说明重组菌株对有害微生物的竞争性抑制作用更强。石超[9]通过给高脂饲喂模型大鼠灌胃植物乳杆菌Lp3后,大鼠类便中乳杆菌数略高于对照组,大肠杆菌和双歧杆菌数量和对照组大鼠的基本一致,与本研究结果相一致。
通过以上实验可以得出结论,小鼠喂饲野生菌株和重组菌株一段时间,可以显著提高小鼠粪便中乳杆菌的数量,降低肠球菌数量(P<0.05),对双歧杆菌、肠杆菌和产气荚膜梭菌数量无显著影响(P>0.05),说明植物乳杆菌C 88和重组菌株对小鼠肠道菌群具有明显的调节作用,且重组菌株的调节能力高于野生菌株。
2.3.2 宏基因组分析小鼠肠道内微生物菌群的情况
2.3.2.1 基于多元统计方法样品中细菌群落结构的比较分析
从图3可以看出,灌胃重组菌株F3-3、F3-4组与空白对照组相比完全是分离的,不存在交叠现象。而灌胃植物乳杆菌C 88组与灌胃重组菌株F3-3、F3-4组有样品交叠的趋势,说明有些分类操作单元在灌胃野生菌株与灌胃重组菌株的样品中同时存在,只是乳杆菌的数量存在差异。

图1 小鼠空肠组织切片观察乳杆菌的粘附情况
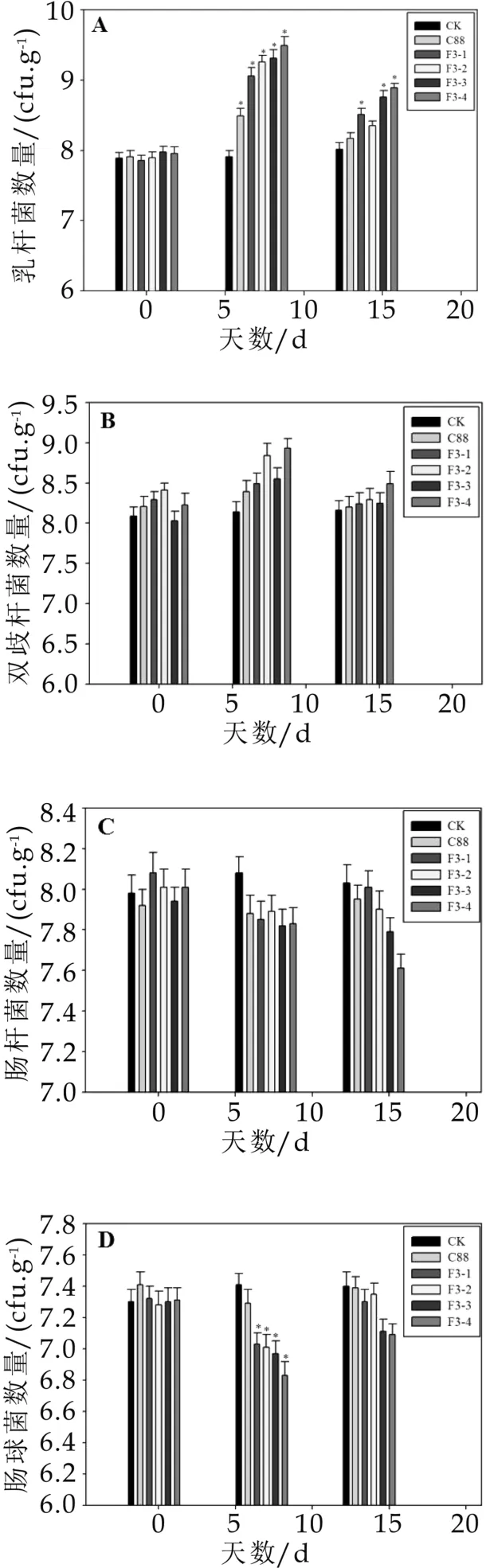
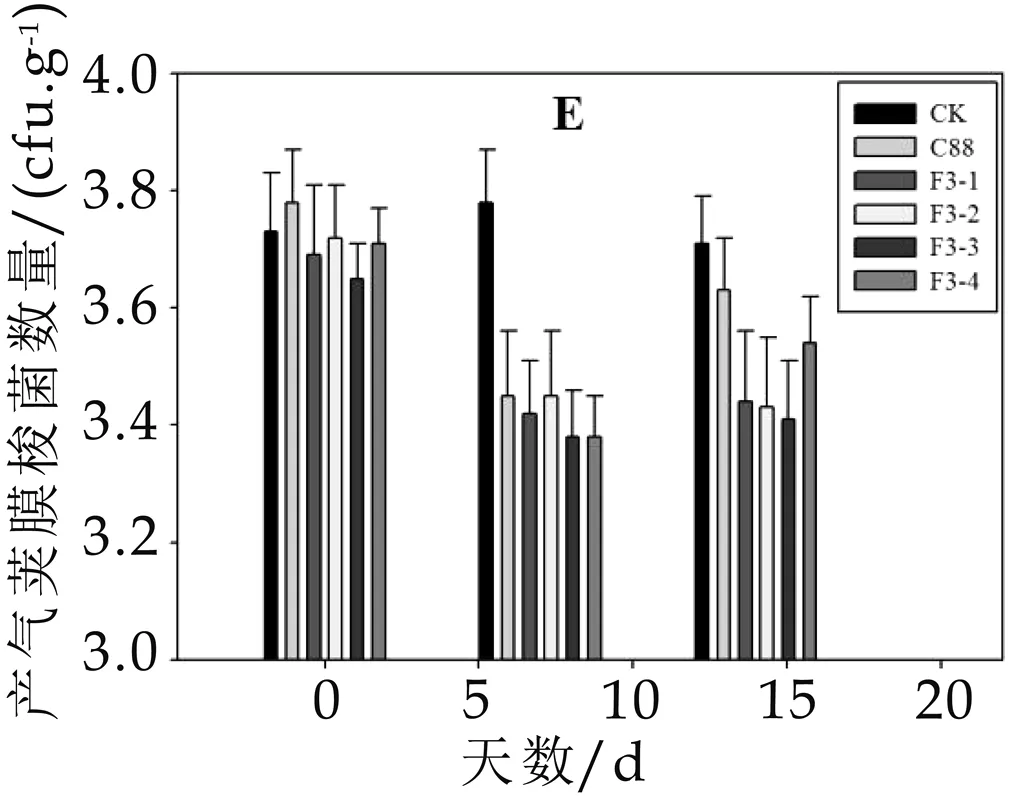
图2 灌胃菌株对小鼠粪便中微生物菌群数量的影响
2.3.2.2 基于属水平不同样品肠道菌群分析
在属水平上,我们对各样品中丰度>1%的属进行了统计,所有小鼠粪便样品中相对丰度较高的属共检测到14个。分别为拟杆菌门的拟杆菌纲拟杆菌科(Bacteroidaceae)的Bacteroides,普雷沃氏菌科(Prevotellaceae)的Prevotella,理研菌科(Rikenellaceae)、紫单胞菌科(Porphyromonadaceae)的Parabacteroides,帕拉普雷沃氏菌科(Paraprevotellaceae)的Prevotella。厚壁菌门的毛罗菌科(Lachnospiraceae),瘤胃菌科(Ruminococcaceae)的Oscillospira及Ruminococcus。变形菌门的立克次氏体目(Rickettsiales),产碱杆菌科(A lcaligenaceae),脱硫弧菌科(Desulfovibrionaceae),螺杆菌科(Helicobacteraceae),肠杆菌科(Enterobacteriaceae)。无壁细菌类的支原体科(M ycoplasmataceae)。
基于属水平样品中细菌相对含量(序列所占比例)的比较分析发现,因乳酸菌和双歧杆菌在粪便中不是优势菌群,所以C88和重组菌株对这些益生菌的调节作用结果不显著。但是灌胃植物乳杆菌C 88和重组菌株调节了小鼠粪便中致病菌及其他细菌的含量,如普雷沃氏菌科(Prevotellaceae)、理研菌科(Rikenellaceae)、帕拉普雷沃氏菌科(Paraprevotellaceae)、立克次氏体目(Rickettsiales)、支原体科(M ycoplasmataceae)在对照组小鼠粪便中的含量为19.4%、10.9%、5.9%、3.9%、18.5%,而灌胃C 88 7 d后降低为6.6%、4.7%、1.2%、0.5%、1.0%,灌胃F3-3降低为6.6%、5.1%、0.2%、0.7%、3.6%,灌胃F3-4降低为5.8%、2.6%、0.0%、0.5%、1.5%,结果表明植物乳杆菌C 88和重组菌株F3-3、F3-4显著降低了小鼠粪便中致病菌及其他细菌的含量,且重组菌株F3-3、F3-4的调节能力稍强于野生菌株。
3 讨论
乳酸菌作为肠道中生理性细菌发挥益生功能的前提是能够有效定植于肠道上皮细胞中,而菌株的粘附能力又是定植的保障。本课题组为了提高乳杆菌在体内的粘附能力,采用基因组改组的技术筛选出四株重组菌株,重组菌株各方面性能明显高于野生菌株,尤其是粘附能力是野生菌株的2倍[4]。近年来科研人员常采用荧光标记的方法对乳酸菌在肠道内的粘附能力进行验证,虽然荧光标记染料很多,但FITC是用于乳酸菌示踪较常用的一种。Edelm an等[10]利用FITC标记Lactobacillus crispatusSTl表面蛋白,观察乳酸杆菌粘附植物上皮细胞和人阴道上皮细胞。任鹏飞[11]利用FITC标记L.rhamnosusCICC 6141,观察荧光乳酸菌在斑马鱼肠道内的粘附情况,结果表明标记的L.rhamnosusC ICC 6141可以在斑马鱼的肠道中观察到较强的绿色荧光。本研究为了验证重组菌株与野生菌株在动物体内的粘附能力,利用FITC对不同菌株进行荧光标记后观察菌株对小鼠肠道上皮细胞的粘附能力,结果发现在小鼠的空肠中有大量的绿色荧光,说明菌株已有效的粘附于小鼠肠道内,且重组菌株的数量较野生菌株多。
益生菌粘附于肠道后发挥的主要作用是维持和调节宿主的正常肠道菌群,并以此为基础发挥其益生特性。乳杆菌对肠的粘附能力会对宿主自身菌群的组成造成影响,从而影响它们与宿主细胞和其他菌株之间的相互作用[12-13],形成并维持肠道的动态平衡。尚楠等[14]研究结果显示双歧杆菌RH活菌、菌体破碎物及发酵上清液均可使小鼠肠道内双歧杆菌和乳杆菌数量极显著增加(P<0.01),产气荚膜梭菌和肠球菌数量显著降低(P<0.05和P<0.01),并能使肠杆菌和拟杆菌数量恢复至正常水平。W ang等[15]结果证明实验动物和受试人群粪便中的双歧杆菌和乳杆菌数量显著增加,肠杆菌数量显著降低,这种含有益生菌和益生元的发酵乳制品可以促进肠道健康。M ontesi等[16]利用小鼠模型验证含有益生元(低聚果糖)或益生菌(乳双歧杆菌和嗜热链球菌)的婴儿奶粉潜在的益生作用,与对照组相比,益生菌组小鼠粪便中梭菌和拟杆菌的数量显著下降,总厌氧菌数量显著下降。本研究获得相类似的研究结果,通过给小鼠灌胃野生菌株和重组菌株,小鼠粪便中乳杆菌的数量显著增加(P<0.05),而肠球菌的数量显著降低(P<0.05),同时宏基因组测序结果表明灌胃乳杆菌显著降低了试验小鼠粪便中致病菌和其他细菌的数量,证明所灌胃的重组菌株和野生菌株均具有调节肠道菌群的作用,且重组菌株的调节能力高于野生菌株C 88。以上结果说明经基因组改组选育的重组菌株F3-3和F3-4由于提高了菌株的粘附能力,可有效的定植在小鼠肠道内形成生物占位,抑制了致病菌和其他细菌的定植,因此减少了致病菌和其他细菌的数量。本研究结果为进一步揭示乳杆菌发挥益生作用的分子机制提供数据支撑。
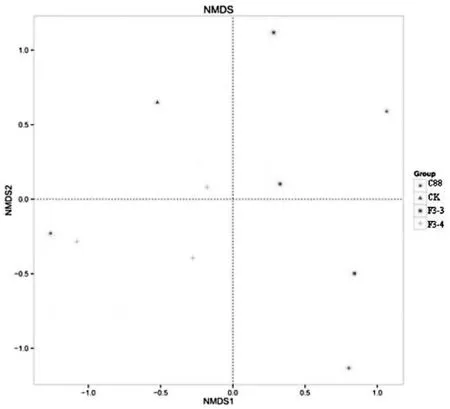
图3 灌胃乳杆菌对受试小鼠肠道菌微生物菌群构成影响的多样性分析图

图4 灌胃不同乳杆菌粪便肠道微生物中相对含量较多的细菌属的热图
