干旱胁迫对红锥生理生化指标的影响
2018-08-29陈文充姜俊马丁奕炜曾燕如
陈文充,姜俊马,王 晖,丁奕炜,曾燕如,梅 丽
干旱胁迫对红锥生理生化指标的影响
陈文充1,姜俊马2,王 晖2,丁奕炜1,曾燕如1,梅 丽1
(1. 浙江农林大学 省部共建亚热带森林培育国家重点实验室,浙江 杭州 311300;2. 浙江省淳安县富溪林场,浙江 淳安 311700)
为了评估红锥的耐旱性,实验以福建10个半同胞家系1.5年生红锥苗为研究对象,采用控制水分盆栽的方式,研究不同基质含水量(含水量分别为15%,30%,50%,75%)持续100 d过程中红锥半同胞家系苗过氧化物酶()、超氧化物歧化酶()、丙二醛()、叶绿素含量、类胡萝卜素含量、电导率()、叶片含水量()的变化。结果表明,整个试验阶段家系间活性及叶绿素a(a)、叶绿素b(b)、总叶绿素(t)、类胡萝卜素(xc)、总色素(tp)含量差异显著(<0.05),干旱主要通过影响叶片色素的变化进而影响红锥的生长;叶绿素中以叶绿素a为主;叶片能够较长时间维持较高的相对含水量,但基质含水量15%持续100 d时6个家系苗木因干旱胁迫全部死亡,而基质含水量50%以上时,红锥细胞膜受损程度要小得多;基质适度干旱有利于高根冠比的形成;半同胞家系3、家系8、家系9在参试半同胞家系中为综合表现较佳的半同胞家系。总的来说红锥是比较抗旱的树种,但需进一步开展试验。
红锥;旱性胁迫;生理生化指标;半同胞家系;盆栽苗
红锥为壳斗科Fagaceae锥属常绿乔木。红锥生长快,主干通直,高可达25 m,胸径可达1.5 m;天然分布于我国广东、广西、云南、海南以及福建南部[1],是南亚热带地区珍贵的乡土阔叶树种[2]。浙江省是其分布的北缘,主要分布于南部的温州、平阳一带。红锥具有适应性强、用途广和效益好等优良特性[3]。其种子富含淀粉,可用作饲料,用于酿酒;种实、壳斗均含单宁,可提制栲胶;枝叶浓密,较耐荫,是与松、杉混交造林的理想伴生树种之一[4],是优良的生态树种。同时,红锥木材坚硬且耐腐性较强,机械加工性能质量等级为优级[5],又是优质珍贵用材树种。
近年来,人们越来越重视混交林、碳汇林的营造及生态公益林的建设;同时城镇平原绿化,对优良阔叶树种的需求也有所增加,对包括红锥在内常绿阔叶树种的研究报道也不断增多。纵观近年来的研究,红锥的研究主要集中在种子发育与萌发[6];育苗基质与幼苗生长[7],施肥与幼林生长[8];不同种源红锥幼林光合特性的日变化[9],光合特性与水分利用[10],不同地点种植的光响应[11];不同光强荧光参数的季节性变化[12]及对红锥光响应的影响[13];红锥人工林碳贮量与碳固定[14];红锥种质资源的遗传多样性分析[15-18]及叶绿体DNA的多样性[19]等。此外,伴随着全球气候变化,浙江省近年来夏季高温及高温持续时间长的现象十分普遍,红锥干旱胁迫下的生理反应及耐受性尚未见报道,而国外有关红锥的研究极少。
本研究以福建的红锥实生苗为实验材料,对干旱胁迫下红锥相关的生理生化指标进行了测定,以期了解红锥在基质不同含水率持续的情况下生理生化指标的动态变化及耐旱性,旨在为今后引种及平原绿化树种的选择与栽培提供理论依据。
2 材料与方法
2.1 材料
红锥种子2011年11月采自红锥主产区福建省武平县梁野山成年健壮大树,地理坐标25°04′ ~ 25°20′ N,116°07′ ~ 116°19′ E。种子在浙江省庆元县林业局实验林场林木良种基地(27°37′ N,119°03′ E)湿沙贮存,第二年春天用于穴盘育苗,基质配比为泥炭:珍珠岩:谷糠(V:V:V)3:1:1,添加缓释肥2.5 kg∙m-3。2013年早春取生长状况优良且大小比较一致的苗木直径33 cm,高22 cm的塑料盆中进行盆栽,基质配比为泥炭:蛭石:珍珠岩(V:V:V)3:1:1。苗木置于浙江省杭州市临安区浙江农林大学国家林业局林木良种繁育基地温室大棚内(30°15′ N,119°43′ E),地理位置上已超过了该树种主要分布区(18°30′ ~ 25° N,95°20′ ~ 118° E)的北缘。
2.2 方法
2.2.1 盆栽苗基质控水处理 实验材料为前期育苗所得的10个半同胞家系1.5年生实生苗。2013年预实验时先采用环刀法[20]得到本试验所采用基质的持水量,再计算得知每个盆栽苗在基质含水量为持水量的15%,30%,50%与75%时的质量。同年6月20日始采用称重法控制基质含水量(人工模拟干旱),采用随机区组实验设计,设置基质含水量为基质持水量的15%,30%,50%,75% 4个梯度(分别以处理1,处理2,处理3,处理4来表示),参照吴丽君等[20]的方法,以基质持水量75%的处理4为对照。每个半同胞家系16盆苗,每个处理4盆苗(4次重复)。
2.2.2 指标测定时间 各处理的苗木在基质控水1个月后于7月20日开始抗旱生理生化指标的测定。测定指标包括叶片相对含水量()、电导率()、光合色素含量(叶绿素a含量a,叶绿素b含量b,总叶绿素含量t,类胡萝卜素含量xc,总色素含量tp)、过氧化物酶()活性、超氧化物歧化酶()活性、丙二醛()活性,每个指标重复测定5次,1次测定在3 d内完成,后一次测定在前一次测定完成后第15天进行。因此,测定时间点1 ~ 5分别代表基质水分处理时间持续30,48,64,82,100 d。实验待各指标出现拐点后停止。
2.2.3 生理生化指标的测定 实验期内按照采样时间先后,自上而下依次苗木第2个分枝采集生长正常且无病斑的成熟红锥叶片4 ~ 5片·次-1,采后立刻放入冰盒带回实验室洗净,去除叶片中脉后剪碎,并按所测指标的需要准确称取相对应的质量。取0.1 g红锥叶片用于的测定。取0.5 g红锥叶片用5 mL pH 7.8的磷酸缓冲液研磨,并用5 mL的缓冲液清洗研钵2次,清洗液连同研磨的样品一并装入10 mL离心管中,并在4℃13 000 r·min-1的条件下离心20 min,然后将上清液转移至5 mL离心管中。以上操作过程均在冰上进行。上清液用于,和3个指标的测定。用打孔器在采集的叶片上随机取直径为1 cm的小圆片20个,用于的测定。
2.2.3.1 含水量的测定 参照杨泱等[21]的方法测定相对含水量()。
2.2.3.2 电导率的测定 采用浸泡法,用电导率测定仪(DDS-307,上海雷磁仪器厂)测定电导,并计算相对电导率()[22-23]。
2.2.3.3 光合色素含量的测定 采用李合生的方法[24],用分光光度计(UV-2550,岛津制作所)测定665,649,470 nm波长条件下的吸光度,并计算包括a,b,t,xc,tp在内的光合色素含量。
2.2.3.4 过氧化物酶的测定 过氧化物酶活性()的测定采用愈创木酚法[25-27]。
2.2.3.5 丙二醛的测定 丙二醛含量()的测定采用硫代巴比妥酸(TBA)法[28]。
2.2.3.6 超氧化物歧化酶测定 超氧化物歧化酶活性()测定采用基于羟胺法的总试剂盒(南京建成生物工程研究所)。
2.2.3.7 生物量测定及根冠比计算 在抗旱试验各生理生化指标测定完成后,分别将所有实验幼苗根系及地上部分干枝叶两部分带回实验室,用水将每个处理红锥幼苗根系洗净,采用烘干称重法测定根系及地上部分的生物量,并根据地上部生物量和根干质量计算根冠比(rc)。
以上各指标除生物量指标外,每株苗重复5次。
2.2.4 数据分析 数据采用软件SPSS 18.0进行方差分析;方差分析之前对以百分数表示的,以及rc进行反正弦变换。在方差分析的基础上,采用LSD法(最小显著性差异法)进行多重比较。将不同含水量基质红锥苗木各测定指标不同测定时间点(延续时间长短不同)的值取平均值,以各时间点为横坐标,各指标值为纵坐标作图,分析不同基质含水量各指标的变化趋势。
3 结果与分析
3.1 干旱胁迫下红锥各家系的生长情况
在不同控水处理的情况下,随着时间的推移,红锥幼苗生长受到一定程度的影响,其中处理1在第5次测定,也即处理1持续100 d时6个半同胞家系苗木因干旱胁迫全部死亡。处理2的苗木在实验阶段末期生长稍优于处理1,但有小部分苗木因缺水即将死亡。处理3与处理4生长情况较好,没有出现苗木死亡的情况。
3.2 各指标的方差分析与多重比较
对整个实验阶段干旱胁迫下红锥幼苗各生理生化指标进行家系和处理的双因素方差分析,结果表明,,,,rc家系间差异不显著,其余各指标家系间均差异显著,且多数为差异极显著;各指标处理间差异极显著;各指标家系与处理的交互作用差异不显著,见表1。
由表1方差分析结果表明,半同胞家系间差异显著的指标除外,其余5个指标均为色素指标,说明基质含水量对红锥幼苗的影响主要体现在叶片色素上。
对整个实验阶段所有处理及色素指标在半同胞家系水平进行多重比较,结果见表2。由表2表明,指标最高的是半同胞家系9(3.23 U∙min-1·g-1),最低的是半同胞家系6(2.41 U∙min-1·g-1);a指标最高的是半同胞家系3(27.2 mg·L-1),最低的是半同胞家系2(20.58 mg·L-1);b指标最高的是半同胞家系8(11.97 mg·L-1),最低的是半同胞家系2(7.94 mg·L-1);t指标最高的是半同胞家系3(38.80 mg·L-1),最低的是半同胞家系2(27.51 mg∙L-1);xc指标最高的是半同胞家系8(6.21 mg·L-1),最低的是半同胞家系2(4.57 mg·L-1);tp指标最高的是半同胞家系8(3.65 mg·g-1),最低的是半同胞家系2(2.56 mg·g-1),各指标最大值与最低值之间存在变异。半同胞家系2在各色素指标上均处于最低水平,而半同胞家系3,半同胞家系8则在不同指标上处于最高水平。各指标处理间极显著的差异主要与基质含水量不同的影响有关,基质含水量为15%的处理第5次测定时10个半同胞家系中有6个半同胞家系苗木因干旱胁迫全部死亡也说明了这一点,尽管供试苗木分属于10个半同胞家系,半同胞家系间有所不同,但因半同胞家系与处理的交互作用差异不显著,且供试的苗木是同龄的,因此处理间各指标的比较在此省略。

表1 不同基质含水量10个红锥半同胞家系各生理生化指标方差分析结果
注:**表示差异极显著(<0.01);*表示平差异显著(<0.05)。

表 2 不同基质含水量10个红锥半同胞家系各生理生化指标的多重比较
注:相同小写字母表示没有显著差异(P>0.05);相同大写字母表示没有极显著差异(P>0.01)。
3.3 不同基质含水量对红锥各生理生化指标的影响
从不同处理整个实验阶段生理生化指标的动态变化来看,尽管不同处理间差异显著,不同基质含水量持续至第48天时,处理3和处理4的电导率一直要高于处理1和处理2;随后不同处理叶片的除处理2第3个时间点及处理4第5个时间点变化比较大外,其余变化不大(图1-a)。随着持续时间的延长,不同处理叶片相对含水量均维持在60%以上,处理1和处理2的含水量在持续100 d时才略低于60%,且低于处理4。各处理持续30 d时相对含水量差别不大,但处理1在持续48 d后相对含水量明显与另3个处理不同,特别高,提前出现峰值;当各处理持续时间达64 d时,处理1和2的相对含水量要低于处理3和4,尽管各处理的变化趋势类似。由此可见,红锥叶片能够较长时间维持较高的相对含水量(图1-b)。
5色素指标不同含水量基质的变化趋势基本一致,均为下降-上升-下降,但处理1的值持续30 d时仅略低于其余处理,但随着持续时间的推移,其值明显低于其余处理(图2a-e)。由此可见,严重干旱对红锥各色素还是有影响的;此外,处理1持续时间长,不利于红锥叶片中各种色素的形成。叶绿素中以叶绿素a为主,类胡萝卜素含量比叶绿素含量低(图2a-d)。基质含水量30%以上(处理2~4)且持续一定的时间对叶片各色素含量影响不大,但高基质含水量(处理4)有利于叶绿素b的形成(图2b),适度干旱(处理2)有利类胡萝卜素的形成,但类胡萝卜素含量总的来说不是很高(图2d)。

图1 不同含水量基质红锥Rcond(a)及RWC(b)随干旱胁迫时间的动态变化趋势
Figure 1 Dynamic change ofrelative conductivityand leaf water content during drought stress under different medium moisture content
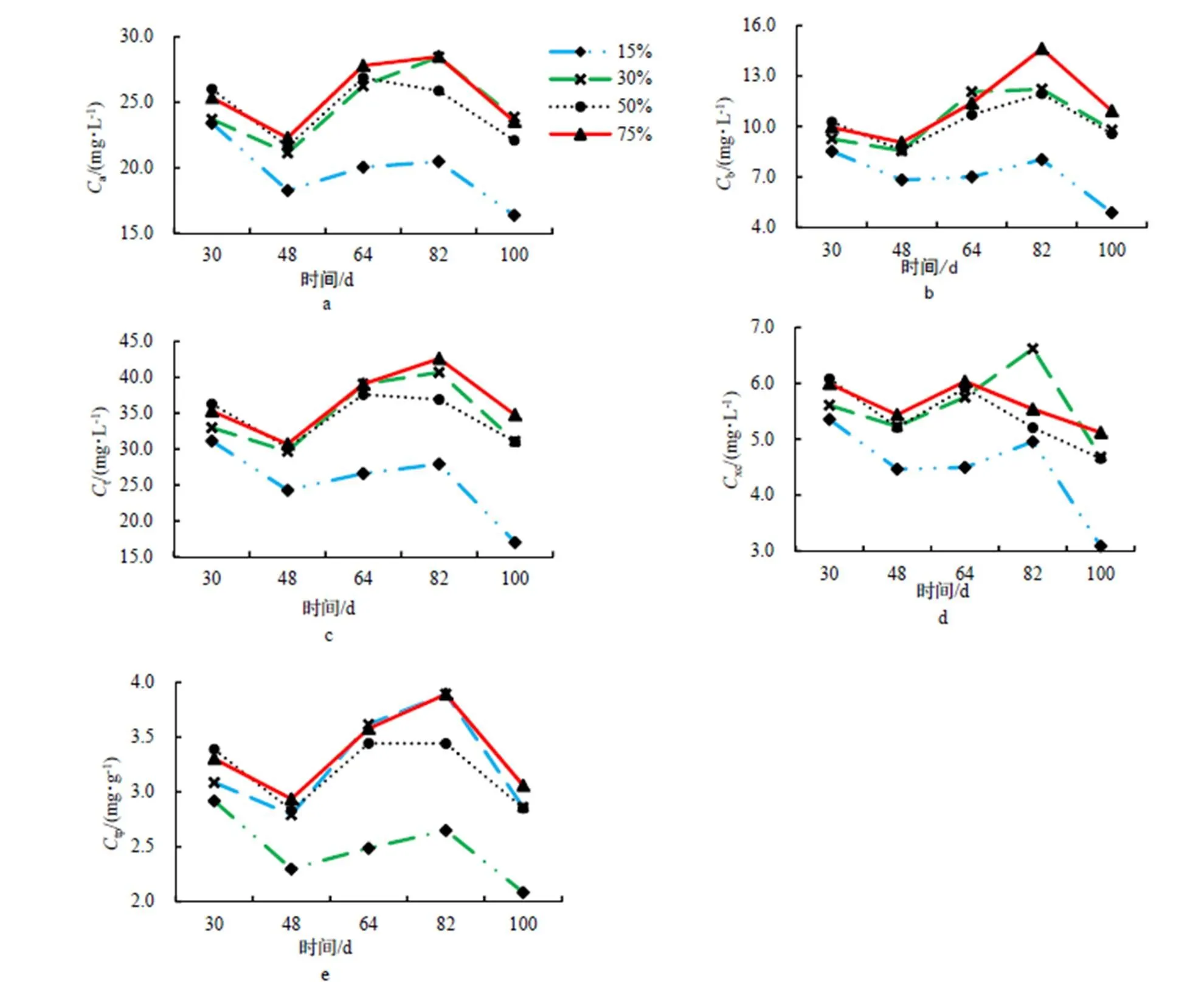
图2 各处理叶片色素含量随各基质处理时间动态变化
Figure 2 Dynamic change of leaf pigment content during drought stress under different medium moisture content
由图3可知,基质含水量不同且持续时间不同,各处理变化趋势相近,但处理1的值在持续48 d时就达到了峰值,且峰值明显偏低;处理2持续48 d后值也达到了峰值,但要高于其它处理;处理3和处理4峰值持续64 d才达峰值,且其峰值与处理2的相近,而处理4则在持续100 d后不同于其它处理,值处于上升状态(图3-a)。不同于及,后2个指标第1次测定时的值比较接近,而各干旱处理第1次测定时就有所不同;其变化趋势处理1不同于其它处理,胁迫持续30 d时值最低,随着干旱的持续,反应就比较强烈,呈上升趋势,尽管第2次测定以后与其它处理总的变化趋势类似,而处理2的变化幅度则不同于处理3和处理4,其最低值在持续64 d后才出现(图3b)。各处理变化趋势相近且变化不大,但各处理持续近82 d时,处理1和22个处理值呈上升趋势,而在处理3和处理4则呈下降趋势,说明基质含水量50%以上时,红锥细胞膜受损程度要小得多(图3c)。

图3 各处理叶片POD(a),SOD(b),MDA(c)的动态变化
Figure 3 Dynamic change of,andduring drought stress under different medium moisture content
3.4 不同基质含水量对红锥苗根冠比的影响
在处理1的情况下,10个半同胞家系的平均根冠比最小,为0.627 5,其中半同胞家系6的根冠比最大(0.987 1),而半同胞家系8的最小(0.294 8);在处理2的情况下,10个半同胞家系的平均根冠比为0.989 0,其中半同胞家系2最大,为3.3675,而半同胞家系7最小,为0.365 5;当在处理3的条件下,10个半同胞家系的平均根冠比达到最大,为1.406 2,变幅为0.575 0(半同胞家系9)-2.351 1(半同胞家系2);而在处理4,10个半同胞家系的平均根冠比又降回0.704 0,变幅为0.324 8(半同胞家系7)-1.126 7(半同胞家系10)(表3)。因此,基质适度干旱有利于高根冠比的形成,而两个极端并不利于高根冠比的形成。

表3 不同基质含水量10个红锥半同胞家系根冠比
4 讨论与结论
在植物遭到干旱胁迫时,随着土壤水分胁迫程度的加剧与时间的延长,植物叶片中的各种光合色素含量会降低[29-31]。不同半同胞家系间的主要差异反映在各色素指标上,如以总的叶绿素含量对10半同胞家系进行排序,则半同胞家系3和半同胞家系8含量最高,随后由大到小依次是半同胞家系9、半同胞家系4、半同胞家系10、半同胞家系5、半同胞家系7、半同胞家系6、半同胞家系1、半同胞家系2含量最低,该排序基本与叶绿素a含量10半同胞家系的排序一致,尽管半同胞家系6、半同胞家系7在排序上略有出入,但这2个半同胞家系叶绿素a,叶绿素b含量及总的叶绿素含量十分接近(表2)。本试验中,光合色素含量呈现下降-上升-下降的趋势,半同胞家系3,半同胞家系8,半同胞家系9的叶绿素a,叶绿素b含量及总的叶绿素含量在10个半同胞家系中名列前3,说明它们具有良好的光合能力来维持植株的生长。另一方面,叶绿素a的含量比叶绿素b的含量高,说明红锥总的叶绿素含量主要由叶绿素a决定,可以在阳性条件下生长[32-34]。
除色素以外,不同半同胞家系在指标上存在显著差异,其活性在水分胁迫过程中增强,但各处理持续64 d后,红锥呈下降趋势。在干旱比较严重(处理1)的情况下,的保护作用有限,也即干旱对的作用有影响。处理2在持续64 d时达到顶点,说明该处理苗木内部的拮抗反应强烈;而另2种处理处理后82 d左右的变化趋势及值都差不多,且处理4基本上反映土壤正常含水量的情况,因此可以说红锥苗木在基质含水量为50%(处理3)时基本上可以维持正常的生长。在本研究中,除了处理1以外,其它处理随着处理时间的推移,的活性呈下降趋势,尽管后续有所增加,说明前期(48 d)主要是在起保护作用。含量高低是膜脂过氧化作用强弱的一个重要指标[35]。本试验在处理3和4时,红锥的含量在持续82 d左右时达到最大值;处理1和2的含量则一直增大,说明持续干旱最终对膜脂系统还是有不利的影响。这与其亲缘种赤皮青冈在干旱胁迫下含量的变化趋势[20]基本相同。
在干旱胁迫下,植物会将干物质优先供应于植物的根系,从而促进根的发育,提高或维持根的活性,以吸收更多的水分,减少水分不足对整个植株的损害,这就会致使根冠比的增大[36-37]。本试验表明,红锥的根冠比随着干旱胁迫程度的增强呈现上升-下降的变化趋势,在处理3时为最大,且处理2时大于处理4,但各半同胞家系生长量之间还是有差异。
就本实验结果来看,红锥自身控水能力较强,在不同基质含水量处理及持续的情况下,叶片失水较慢,相对含水率可以维持在较高的水平上,以确保细胞具有一定的膨压,维持生命活动的持续,这也从一个侧面反映红锥具有一定的能力维持叶片膜系统的相对完整性;且各家系间相,指标无显著差异。尽管如此,基质含水率偏低(如处理1)且持续时间长,不利于叶片各种色素的形成,对光合作用会产生影响,进而影响苗木的生长。总的来说红锥是比较抗旱的,且在处理3时基本可以正常生长。因此,红锥是潜在可供选择的引种及平原绿化树种之一。
[1] 《广东森林》编辑委员会. 广东森林[M]. 广州:广东科技出版社,1990:270-272.
[2] 郑哲民,蒋国芳. 广西南部地区蚱总科一新属和七新种[J]. 动物学研究,2002,23(5):409-416.
[3] 丘小军,朱积余. 红锥的天然分布与适生条件研究[J]. 广西农业生物科学,2006,25(2):175-179.
[4] 唐玉贵,龙定建. 红锥速生丰产栽培技术[J]. 广西林业科学,2000,29(1):39-40.
[5] 江京辉,吕建雄. 红锥和西南桦人工林木材的机械加工性能[J]. 林业科学,2008,44(10):120-126.
[6] 郑郁善. ABA对红锥、苦槠种子发育和萌发的效应研究[J]. 西北植物学报,2001,21(1):81-88.
[7] 周新菊,洪维,黄明智,等. 不同育苗基质对红锥幼苗生长的影响[J]. 广东林业科技,2008,24(4):47-50.
[8] 黄招. 不同施肥处理与红锥幼林生长相关性的研究[J]. 林业勘察设计(福建),2013(1):113-115.
[9] 蒋燚,李志辉,朱积余,等. 不同红锥种源幼林光合特性日变化测定与分析[J]. 中南林业科技大学学报,2013,33(6):43-47.
[10] 张凤良,张方秋,段安安,等. 不同种源红锥光合特性与水分利用效率变异分析[J]. 西南林业大学学报,2012,32(4):12-16.
[11] 蒋燚,朱积余,黄荣林,等. 10个红锥种源不同种植点的光响应[J]. 广西林业科学,2013,42(3):213-217.
[12] 姜英,黄志玲,郝海坤. 不同光照强度下红锥幼苗叶绿素荧光参数的季节变化[J]. 西南林业大学学报,2014,34(2):8-12.
[13] 黄志玲,姜英,郝海坤,等. 不同光照强度对红锥光响应曲线的影响[J]. 中南林业科技大学学报,2014,34(8):30-33.
[14] 刘恩,王晖,刘世荣. 南亚热带不同林龄红锥人工林碳贮量与碳固定特征[J]. 应用生态学报,2012,23(2):335-340.
[15] 王蕾,叶志云,蒋燚,等. 利用ISSR技术对优质红锥种质资源遗传多样性的分析[J]. 厦门大学学报:自然科学版,2006(45):91-94.
[16] 王鸣刚,肖岸容,赵宏,等. 利用rbcL基因序列比对分析广西优质红锥种质资源的遗传多样性[J]. 甘肃农业大学学报,2008,43(6):106-109.
[17] 王鸣刚,赵宏,陈晓前,等. 优良红锥种质资源遗传多样性的ISSR分析与聚类[J]. 甘肃农业大学学报,2009,44(2):110-115.
[18] 王鸣刚,涂智杰,丘小军,等. 优质红锥种源遗传多样性的RAPD分析[J]. 厦门大学学报:自然科学版,2006,45(4):570-574.
[19] Li J,Ge X J,Cao H L,Chloroplast DNA diversity inpopulations in south China[J]. For Ecol Manag,2007(243):94-101.
[20] 吴丽君,李志辉,戴玲,等. 土壤水分胁迫下不同赤皮青冈种源生理特性的研究[J]. 中南林业科技大学学报,2014(2):12-15.
[21] 杨泱,冷平生,张博,等. 3种边坡绿化植物抗寒性研究[J]. 中国农学通报,2010,26(13):272-278.
[22] 陈建勋,王晓峰. 植物生理学实验指导:第二版[M]. 广州:华南理工大学出版社,2006:64-66.
[23] 刘宁,高玉葆,贾彩霞,等. 渗透胁迫下多花黑麦草叶内过氧化物酶活性和脯氨酸含量以及质膜相对头型的变化[J]. 植物生理学通讯,2000,36(1):11-14.
[24] 李和生. 植物生理生化试验原理和技术[M]. 北京:高等教育出版社,2003:144-155.
[25] 李海林,殷绪明,龙小军. 低温胁迫对水稻幼苗耐寒性生理生化指标的影响[J]. 安徽农学报,2006,12(11):50-53.
[26] 朱广廉. 植物生理学试验[M]. 北京:北京大学出版社,1990:245-248.
[27] 武维华. 植物生理学[M]. 北京:科学出版社,2003:427-429.
[28] 康志刚. 氧乐果对油松幼苗保护酶活性及膜脂过氧化的影响[J]. 科学之友,2011(9):162-163.
[29] 蒲光兰,胡学华,周兰英,等. 水分胁迫下乌桕离体叶片的生理生化特性[J]. 经济林研究,2004,22(2):20-23.
[30] 贾利强,李吉跃,郎南军,等. 水分胁迫对黄连木、清香木幼苗的影响[J]. 北京林业大学学报,2003,25(3):55-59.
[31] 陈卫元,曹晶,姜卫兵. 干旱胁迫对红叶石楠叶片光合生理特性的影响[J]. 中国农学通报,2007,23(8):217-220.
[32] Chandra A,Bhatt R K,Misra LP. Effect of water stress on biochemical and physiological characteristics in oat genotypes[J]. J Agron Crop Sci,1998(181):45-48.
[33] Sairam R K,Deshmukh P S,Deshmukh D C. Role of antioxidant systems in wheat genotypes tolerance to water stress[J]. Biol Plant,1998(41):387-394.
[34] Zhang Z,Kirkham M B. Drought stress induced changes in activities of superoxide dismutase,catalase and peroxidase in wheat species[J]. Plant Cell Physiol,1994(35):785-791.
[35] 陈少裕. 膜脂过氧化与植物逆境胁迫[J]. 植物学通报,1989,6(4):211-217.
[36] Bradbury M. The effect of water stress on growth and dry matter distribution in juvenileness banand acaciawi lotica[J]. J Arid Environ,1990(18):325-333.
[37] 张大勇,姜新华. 对于作物生产的生态学思考[J]. 植物生态学报,2000(3):383-384.
Effects of Drought Stress on Physiological and Biochemical Properties in
CHEN Wen-chong1,JIANG Jun-ma2,WANG Hui2,DING Yi-wei1,ZENG Yan-ru1,MEI Li1
(1. The State Key Laboratory of Subtropical Silviculture, Zhejiang A & F University, Hangzhou 311300, China; 2. Chun’an Fuxi Forest Farm of Zhejiang, Chun’an 311700, China)
Experiments were conducted on different water contents (15%, 30%, 50% and 75%) of media for potted cultivation of 10 half-sib families ofseedlings from Fujian Province for 100 days. Changes in,,, chlorophyll content, carotenoid content, electric conductivity, and leaf moisture content were measured in order to evaluate drought tolerance. The results showed that there were significant differences among tested half-sib families inactivity and contents of chlorophyll a and chlorophyll b (aandb), total chlorophyll (t), carotenoids (xc) and total pigment (tp), and drought stress had an effect on growth by influencing leaf pigments. Chlorophyll a had a higher content than chlorophyll b. Seedlings of six families treated with a medium moisture content of 15% died 100 days later. The experiment indicated that testedfamilies were resistant to drought stress.
; drought stress; physiological and biochemical parameters; semi-sib family; potted seedling
10.3969/j.issn.1001-3776.2018.03.003
S664.2
A
1001-3776(2018)03-0016-08
2017-10-07;
2018-03-05
浙江省科技重大项目“优质用材树种高效育种关键共性技术研究及应用(2045210008)”
陈文充,硕士研究生,从事森林培育研究;E-mail:506396307@qq.com。
曾燕如,教授,从事森林培育研究;E-mail:yrzeng@zafu.edu.cn。
