‘涌金’丛生芽的增殖优化研究
2018-08-29张椿芳何月秋王建军郑国强
张椿芳,付 涛,何月秋,王建军,王 豪,郑国强
‘涌金’丛生芽的增殖优化研究
张椿芳1,付 涛1,何月秋1,王建军2,王 豪2,郑国强3
(1. 宁波城市职业技术学院,浙江 宁波 315100;2. 宁波林业局林特种苗繁育中心,浙江 宁波 315012;3. 江苏碧云天农林科技有限公司,江苏 丹阳 212300)
为了提高‘涌金’‘Yongjin’丛生芽的增殖效率及生长状况,以其尚未萌发的腋芽新梢作为实验材料,通过植物组织培养技术对不同培养基、不同激素、不同蔗糖浓度、不同pH值、不同继代方式以及不同继代周期进行了系统研究。结果表明,‘涌金’丛生芽增殖优化的最优方案为MS+NaH2PO4(50 mg·L-1)+6-BA(2 mg·L-1)+IBA(0.02 mg·L-1),蔗糖浓度在20 ~ 30 g·L-1之间,pH值5.8 ~ 6.2,继代方式为①-③-①[①: MS+NaH2PO4(50 mg·L-1)+6-BA(3 mg·L-1)+IBA(0.02 mg·L-1);③:MS+NaH2PO4(50 mg·L-1)+6-BA(1 mg·L-1)+IBA(0.02 mg·L-1)],继代周期在25 ~ 30 d之间。本研究有效改善了‘涌金’继代培养过程中丛生芽长势衰弱、黄叶、褐化等问题,提高了增殖效率。
‘涌金’;丛生芽;组织培养;增殖
樟广泛分布于我国亚热带地区,为樟科Lauraceae樟属的常绿阔叶乔木,不仅是经济植物(芳香油类植物),也是重要的绿化和景观树种,公园、学校以及道路绿化区域被广泛种植,具有诸多优点,例如其叶形秀丽、枝繁叶茂、四季常绿、生长迅速且散发出浓郁的香味等[1-2]。‘涌金’‘Yongjin’为樟实生苗选育出的优良品种,与母本相比,具有诸多优良特性,如其新叶和花均为金黄色,枝干呈现出鲜红色,果皮为黄色,并且叶、果和枝干还具有季相变化,可作为一种高大的彩叶乔木予以应用,具有较高的园林观赏及推广应用价值[3]。通过种子的扩大繁殖可满足实际生产需求,但后代会出现严重分离现象,原有的优良性状很难保持;其次,由于母树枝条数量有限,即使通过扦插和嫁接等无性繁殖方式也很难满足实际需求,因此通过传统的繁殖方式,很难对‘涌金’品种进行保存和扩大繁殖[4]。
植物组织培养是一种快速的无性繁殖方式,是保存优良种质资源的重要方法与途径,它既能保持母本原有的优良性状,又能在较短的时间内培育出整齐一致的苗木,而且还能为树种改良、利用以及遗传转化等打下基础,目前已经在100多个科、1 000多种植物中获得广泛应用[5]。目前,有关樟的植物组织培养也已被广泛研究[6-9]。然而植株随着继代次数的增加,丛生芽繁殖系数降低,出现生长势衰弱、黄叶、褐化等现象,增殖效率大大降低,无法稳定高效地获取丛生芽,进而难以实现快速繁殖的目的。为提高‘涌金’丛生芽的增殖效率及生长状况,本研究通过植物组织培养技术对不同培养基、不同激素、不同蔗糖浓度、不同pH值、不同继代方式以及不同继代周期进行了系统研究,旨在为实现‘涌金’试管苗的工厂化生产奠定一定的基础。
1 材料和方法
1.1 材料
‘涌金’(带芽茎段)采集于宁波市林业局种苗中心邱隘基地,该基地位于宁波鄞州区,29°51″ N,121°38″24′ E,属亚热带季风性湿润气候,春秋两季雨量均衡,夏季高温高湿。母树14年生,于2015年3月初剪取腋芽尚未萌发的新梢带回实验室,经过无菌处理后用于后续试验。
1.2 试验设计
1.2.1 不同培养基、不同植物生长调节剂及其不同浓度对丛生芽增殖的影响 为筛选出适合‘涌金’丛生芽不断增殖的培养基,选择3种不同的基本培养基,分别为MS,MS+NaH2PO4(50 mg·L-1)和1/2MS;选择3种植物生长调节剂,分别为6-BA,IBA和GA3(赤霉素),均为3个浓度梯度,其中6-BA为0.5,1.0和3.0 mg·L-1;IBA为0,0.02和0.04 mg·L-1;GA3为0,0.05和0.10 mg·L-1。采用L9(43)正交实验设计方案进行优化实验,试验设计见表1。此外,其它限制因素均为固定值,如蔗糖浓度为20 g·L-1,琼脂浓度为7 g·L-1,pH值为5.8。

表1 ‘涌金’丛生芽增殖培养基的设计
1.2.2 不同蔗糖浓度对‘涌金’丛生芽增殖效果的影响 在上述试验基础上,研究不同蔗糖浓度对‘涌金’丛生芽增殖效果的影响。蔗糖浓度设置6水平(表2)。培养基为MS + NaH2PO4(50 mg·L-1)+ 6-BA(2 mg·L-1)+ IBA(0.02 mg·L-1),琼脂浓度为7 g·L-1,pH值为5.8。

表2 增殖培养基蔗糖浓度单因子的实验水平
1.2.3 不同pH值对‘涌金’丛生芽增殖效果的影响 pH值影响丛生芽的增殖培养,因此本实验设计6个pH值水平(表3)。培养基MS + NaH2PO4(50 mg·L-1)+ 6-BA(2 mg·L-1)+ IBA(0.02 mg·L-1),蔗糖浓度为20 g·L-1,琼脂浓度为7 g·L-1。
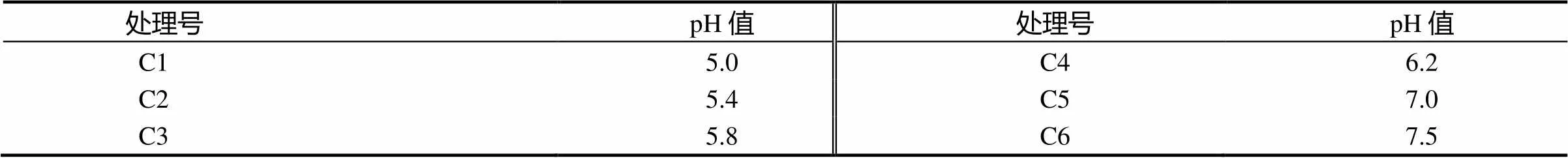
表3 增殖培养基中pH值的实验水平
1.2.4 不同继代方式对‘涌金’丛生芽增殖效果的影响 将5种培养基进行交替培养①MS + NaH2PO4(50 mg·L-1)+ 6-BA(3 mg·L-1)+ IBA(0.02 mg·L-1);②MS + NaH2PO4(50 mg·L-1)+ 6-BA(2 mg·L-1)+ IBA(0.02 mg·L-1);③MS + NaH2PO4(50 mg·L-1)+ 6-BA(1 mg·L-1)+ IBA(0.02 mg·L-1);④MS+NaH2PO4(50 mg·L-1)+6-BA(0.5 mg·L-1)+IBA(0.02 mg·L-1);⑤MS+NaH2PO4(50 mg·L-1)+ IBA(0.02 mg·L-1)。

表4 增殖培养中的不同继代方式
1.2.5 不同继代周期对‘涌金’丛生芽增殖效果的影响 实验中发现继代周期对‘涌金’丛生芽增殖影响较大,故而设计如下实验方案,以筛选出适宜的继代时间,培养基MS+NaH2PO4(50 mg·L-1)+ 6-BA(2 mg·L-1)+ IBA(0.02 mg·L-1),琼脂浓度为7 g·L-1,pH值为5.8。

表5 增殖培养中的不同继代周期
1.3 数据处理
增殖倍数=总芽数(25 d)/接种芽数(高度为1 cm以上为有效芽);数据采用平均值±标准误(SE)表示,采用SPSS 17.0统计软件对数据进行统计,均值比较采用单因子方差分析,不同处理方式显著差异性采用Duncan’s新复极差测验方法(SSR,<0.05)。
2 结果与分析
2.1 不同培养基对‘涌金’丛生芽增殖的影响
由表6和图1可知,A3,A4和A5的增殖倍数显著(<0.05)高于其它处理,其中A3,A5和A4间也差异显著,但A3基部有褐化,A4基部有较多愈伤组织,只有A5不仅增殖倍数高,而且丛生芽生长状况相对最好。此外,在A6中,丛生芽生长状况良好,但增殖倍数却较低,其余培养基不仅增殖倍数较低,丛生芽生长状况也较差。因此,总体而言,培养基A5为正交试验中效果最好的处理,其培养条件为MS+NaH2PO4(50 mg·L-1)+ 6-BA(1.0 mg·L-1)+ IBA(0.04 mg·L-1)+ GA3(0 mg·L-1)。使用统计软件 Design Expert 8.0对数据进行分析,得出最佳优化方案为MS + NaH2PO4(50 mg·L-1)+ 6-BA(2 mg·L-1)+ IBA(0.02 mg·L-1)。

表6 不同培养基对‘涌金’丛生芽增殖的影响
注:同列数据后不同小写字母表示在0.05 水平下差异显著。下同。

图1 不同培养基在‘涌金’丛生芽增殖中的情况
Figure 1 Growth of clump buds of‘Yongjin’ proliferative conditions by different media
2.2 不同蔗糖浓度对‘涌金’丛生芽增殖的影响
在植物组织培养时,由于培养物的光合作用能力较弱,所以需要在培养基中添加一些糖类,一方面作为生长发育所需的碳源和能源,同时也可以维持一定的渗透压。在‘涌金’丛生芽增殖培养中,不同蔗糖量的加入对增殖和生长状态均产生一定的影响。由表7和图2可知,丛生芽在较低浓度的蔗糖培养基B1上表现为叶淡绿、芽细弱,而靠近基部的叶片也出现枯黄;在B3培养基上,苗生长较为旺盛,叶色嫩绿,基本没有枯苗出现;而在较高蔗糖浓度的B4,B5培养基上,苗生长缓慢,分化少,叶黄绿,变粗和老化,基部聚集褐色物质,有枯苗夹杂于芽丛中间。从表7还可知,随着蔗糖浓度的加大,增殖系数呈先升高后降低的趋势,其中,在B2和B3培养基中的增殖倍数最大,分别为2.80和3.38,但因B3增殖系数较高,芽偏细弱,一般生产考虑更多的有效苗,故而培养基中蔗糖浓度选择在20 ~ 30 g·L-1为宜。
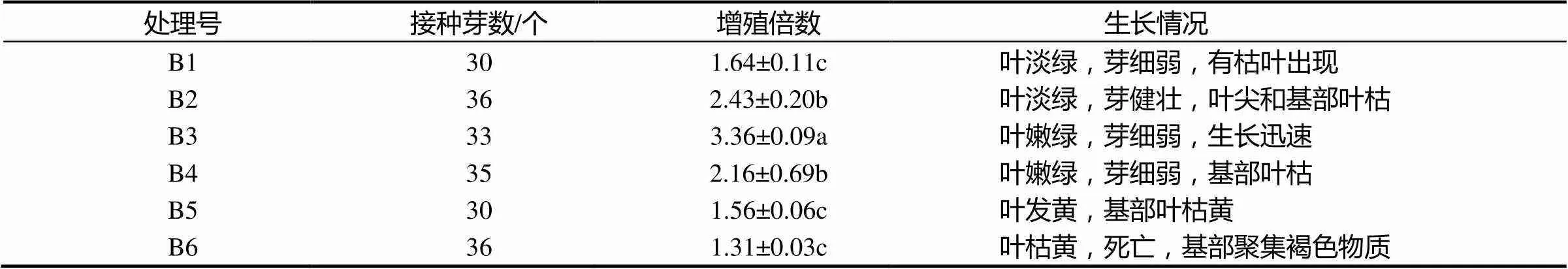
表7 蔗糖浓度对‘涌金’丛生芽增殖的影响
Figure 2 Growth of clump buds of‘Yongjin’ proliferative conditions by different sucrose concentrations
2.3 不同pH值对‘涌金’丛生芽增殖的影响
培养基中pH值也是影响植物组织培养的一个重要因素,pH值的变化影响到一些离子的溶解度进而影响到植物对各元素的吸收,从而发生缺素症状,此外,过高或过低的pH值均会影响到培养基的凝固,过高培养基会发硬,反之则培养基会太软。由表8可知,pH值在5.0时(C1),灭菌后培养基较软,‘涌金’丛生芽叶灰绿,分化的丛生芽有玻璃化趋势且芽生长缓慢;pH值在5.4 ~ 6.2时(C2,C3和 C4),丛生芽均能比较正常的生长,增殖倍数高,有效芽较多;而当pH值高于7.0时(C5,C6),丛生芽叶表现出黄绿状况,且芽生长缓慢,增殖倍数降低。总体而言,‘涌金’丛生芽在pH值在5.8 ~ 6.2时,芽苗能够旺盛生长,且能维持较高的增殖倍数。
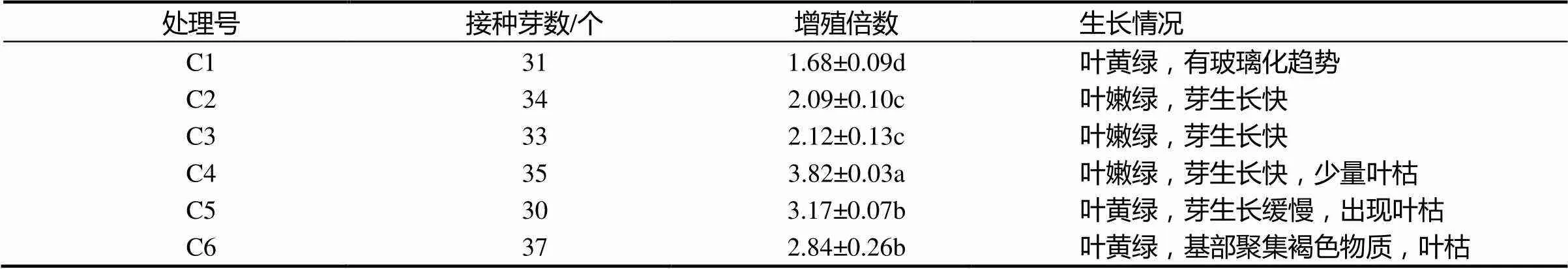
表8 不同pH值对‘涌金’丛生芽增殖的影响
2.4 不同继代方式对‘涌金’丛生芽增殖的影响
组培苗增殖通常是外植体连续继代于含有6-BA增殖培养基中,这种方式常常导致组培苗的玻璃化或生长畸形,因此,比较了不同继代方式对‘涌金’丛生芽增殖和生长的影响。首先将外植体接种于所筛选出的丛生芽的增殖培养基①中,25 d后分别转移至浓度逐渐降低的②,③,④或去掉6-BA培养基⑤中,25 d后再转移至增殖培养基①中。由表9可知,5种继代方式中,D1和D5处理丛生芽生长状况较差,且增殖系数偏低,其中D1处理还易出现玻璃化现象;D2和D3处理丛生芽生长情况最好,其中D3处理最有利于‘涌金’丛生芽的增殖,平均增殖系数最高,且芽生长快速。
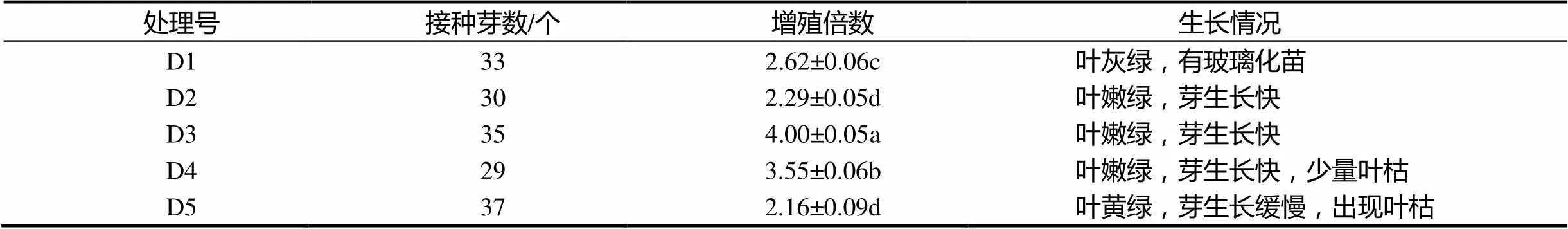
表9 不继代方式对‘涌金’丛生芽增殖的影响
2.5 不同继代周期对‘涌金’丛生芽增殖的影响
培养过程中材料长期不转移会导致丛生芽褐变,严重影响丛生芽的存活率,其中,及时更新培养基是有效降低褐化的重要措施之一。针对‘涌金’丛生芽的增殖特点,比较了不同继代周期对其生长的影响,由表10可知,‘涌金’丛生芽增殖倍数随继代周期的延长出现先增加后降低的趋势,其中培养10 d(E1)转移的增殖倍数最低,且叶灰绿、有玻璃化现象;培养25 d(E2)和30 d(E3)转移的增殖倍数相对最高,与其他处理比较呈显著性差异(<0.05),且丛生芽生长情况良好,但E4中丛生芽生长情况已开始恶化,出现黄叶和死苗的现象,不利于继续培养,因此,建议选择25 ~ 30 d进行继代培养,更有利于丛生芽的发育和增殖。
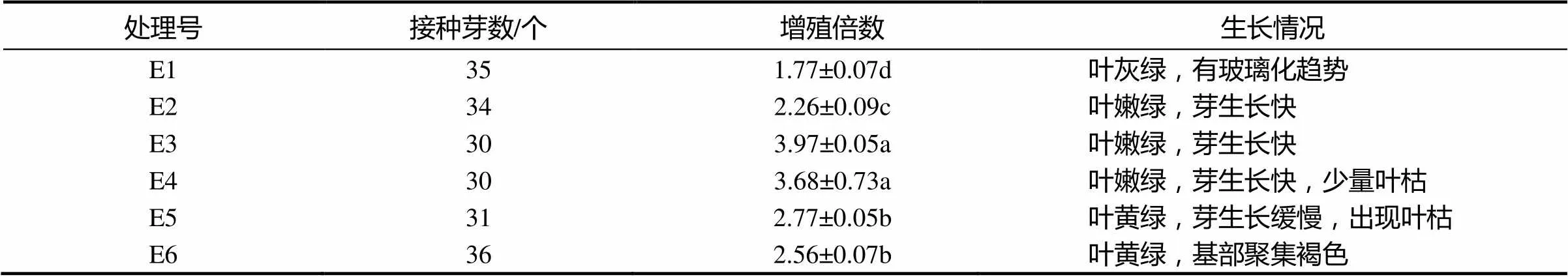
表10 不同继续代周期对‘涌金’丛生芽增殖的影响
3 结论与讨论
植物激素在植物器官、组织和细胞培养中对细胞的脱分化及再分化起着重要的调节作用,在细胞、器官或植株水平上调控着一些特定的过程,因此,在植物组织培养基的各种组成成分中,植物激素所产生的影响最大[10-11]。从理论上说,要知道某一树种分化出苗规律性,首先要了解其具体在芽或根分化时对激素种类及数量的要求,同时还要求测出所接种的外植体当时所含内源激素,那么分化就会顺利进行并按预期得到再分化的芽,对此,目前植物生理学、生物化学等科目的研究尚未有更深入的研究,因此,在分化出芽之前就作出正确的结论几乎不可能。植物组织培养是一个非常复杂的过程,从现有的研究资料看,整个培养脱分化的过程不仅受激素的影响,还受到多种外界因素及培养材料本身的影响。
在实际的组培工作中,根据培养瓶内培养物的表现来调整激素的供给量,是很重要的培养手段。多数木本植物的组织培养研究都需要开展一系列的调整工作以获得分化率高的健壮小芽(每次继代的增殖系数≥3,继代周期≤30 d),以此来满足工厂化育苗的要求[12]。前期研究中,6-BA和IAA的激素用量分别为3 mg·L-1和0.05 mg·L-1,是第一代丛生芽诱导的最佳配比,几乎每个外植体可诱导出大量的丛生芽[4]。然而进入增殖诱导阶段,仍使用该比例的激素浓度,外植体生长缓慢,出现大量愈伤组织,叶片发黄,形成的丛生芽难以继续生长,显然该比例的激素已不再适合继续使用。本试验在增殖诱导阶段使用2 mg·L-1的6-BA和0.02 mg·L-1IBA,增殖效果及丛生芽的质量都较好。
‘涌金’丛生芽增殖研究中目前遇到的困难之一是丛生芽生长缓慢,同时增殖周期不能超过30 d。这不能满足工厂化育苗的要求。GA3对器官的分化有一定的促进作用,在适宜的浓度下有利于芽的快速生长,杨海文等[13]研究也表明适量的GA3能够明显促进云杉和油松高生长。本实验在增殖培养基中添加了不同浓度的GA3,结果表明GA3不能缩短‘涌金’丛生芽的增殖周期,同时随着GA3浓度的增加,诱导形成的丛生芽大量枯死,增殖倍数大大降低,这与云杉等其它植物有很大差异,具体原因有待进一步研究。
在培养基中添加蔗糖不仅为培养物提供了碳源,可为细胞的呼吸代谢提供底物与能源以及提供合成新化合物的碳骨架,而且在维持培养基中的渗透压也起着重要作用[14-15]。一般木本植物器官发生的各个阶段对培养基的要求有所不同,适时调整培养基的组成有益于‘涌金’丛生芽的增殖。由本试验结果可知,较低浓度的蔗糖不能满足‘涌金’丛生芽的生长,形成大量细弱的芽丛,而过高浓度的蔗糖则容易导致丛生芽叶发枯,基部产生褐化,当蔗糖浓度为20 ~ 30 g·L-1时,能形成叶色嫩绿、生长健壮的丛生芽,这与普遍认为的诱导初代芽时的蔗糖用量为3.0%基本一致[16]。
培养基中的物理性质对培养物的影响一般包括培养基的固相、液相、渗透压和pH值等,其中,培养基中的pH值的变化影响到铁离子的溶解度,会使一些溶解度小的铁盐沉淀,直接影响到植物对铁元素的吸收,出现明显的缺铁症状,铁促进细胞分裂与伸长,缺铁时细胞分裂停止,铁还影响叶绿体的结构组成与叶绿素的形成,故培养物缺铁时会出现失绿的症状[17-18]。小植株因缺铁而不伸长,节间缩短,甚至发黄坏死。因此在培养基中选择适宜的pH值对植物组织培养甚为重要,对于‘涌金’丛生芽而言,pH值为5.8 ~ 6.2能够满足丛生芽增殖的要求。一般而言,液体培养方式在进行愈伤组织的悬浮培养应用较为普遍,该种培养方式能够大大提高愈伤组织的生长速度,但在器官发生则运用较少。在本次实验中,‘涌金’丛生芽在震荡培养条件下增殖效率差,这可能与叶芽原基长时间浸泡在液体中有关。
有人通过试验得出过樟茎尖诱导丛生芽的最佳配方为MS + 6-BA 5 mg·L-1+ NAA 0.5 mg·L-1,但仅对不同培养基以及植物生长调节剂(6-BA和NAA)进行了相关研究,对影响樟丛生芽诱导的其它因素均未涉及[19]。本研究较为系统的研究和分析了影响樟丛生芽诱导的各种因素(如蔗糖浓度、pH值、不同继代方式以及不同继代周期等),最终得出了一个解决丛生芽诱导过程中黄叶、褐化以及增殖效率高、长势较好的优良方案。‘涌金’丛生芽的增殖是一个多因素共同协作的过程,而本试验只涉及基本培养基、激素、附加物质、培养条件等因素,对‘涌金’丛生芽在增殖过程中自身内源生长调节物质的变化没有做进一步的分析。这有待于做更多更细致的工作,了解丛生芽在增殖过程中的生理生化变化和各个阶段培养要求,以加快‘涌金’丛生芽松实现工厂育苗的进程。本研究通过对‘涌金’丛生芽的增殖优化研究得出其最优方案MS+NaH2PO4(50 mg·L-1)+ 6-BA(2 mg·L-1)+ IBA(0.02 mg·L-1),蔗糖浓度在20 ~ 30 g·L-1,pH值5.8 ~ 6.2,继代方式为①-③-①[①: MS+NaH2PO4(50 mg·L-1)+ 6-BA(3 mg·L-1)+ IBA(0.02 mg·L-1);③:MS + NaH2PO4(50 mg·L-1)+ 6-BA(1 mg·L-1)+ IBA(0.02 mg·L-1)],继代周期在25 ~ 30 d。
[1] 欧景华. 樟组织培养快繁技术研究[J]. 内蒙古林业调查设计,2012,35(5):44-45.
[2] 辜夕容,黄建国,杨庆. 樟离体培养体系的构建初探[J]. 中国农学通报,2005,21(2):97-100.
[3] 王建军. 樟新品种‘涌金’[J]. 林业科学,2010,46(8):181.
[4] 何月秋,王建军. 樟涌金的组织培养和植株再生[J]. 南方农业学报,2015,46(1):96-100.
[5] 辛全伟. 樟优良无性系繁殖技术的研究[D]. 福州:福建农林大学,2010.
[6] 杜丽,叶要妹,包满珠. 樟未成熟合子胚体胚发生及植株再生研究[J]. 林业科学,2006(6):37-39,145.
[7] 唐国涛,张汉永,朱昔娇,等. 樟树组织培养试验[J]. 福建林业科技,2013,40(2):70-72.
[8] Babu K N,Sajina A,Minoo D,. Micropropagation of camphor tree()[J]. Plant Cell Tissue and Organ Culture,2003,74(2):179-183.
[9] Shi X p,Dai X g,Liu G f ,. Cyclic secondary somatic embryogenesis and efficient plant regeneration in camphor tree (,L.)[J]. In Vitro Cell Dev Biol Plant,2010,46:117-125.
[10] 崔丽华. 植物生长调节物质对组织培养中[J]. 辽宁师范学报,2000,2(2):97-99.
[11] 范国强,蒋建平,贺窑青,等. 悬铃木叶片植株再生系统的建立[J]. 园艺学报,2003,30(2):236-238.
[12] 潘梅,符瑞侃,黄赛,等. 药用裸花紫珠微繁技术增殖培养基筛选研究[J]. 北方园艺,2014(4):96-99.
[13] 杨海文,王宽邦,吕才忠,等. 赤霉素在针叶树育苗中的应用[J]. 青海农林科技,2004(3):77-78
[14] 蔡朝晖,朱丹妮,陶金来,等. 培养基中蔗糖浓度及添加氨基酸对组培暗紫贝母生长的影响[J]. 中国药科大学学报,1996,27(1):1-3.
[15] 王庭辉,马晖玲. 和田苜蓿组织培养中玻璃化现象研究[J]. 草原与草坪,2012,32(5):58-61.
[16] 韩淑兰,王慧梅,张丹. 降低黄芩再生苗玻璃化率及其生根的研究[J]. 植物研究,2016,36(1):90-96.
[17] 李浚明. 植物组织培养教程[M]. 北京:中国农业大学出版社,2002:65-67.
[18] 邓成木,刘进平. 热带亚热带植物繁殖[M] .长沙:湖南科学技术出版社,2001:97-99.
[19] 索长江,蔡斌华. 香樟丛生芽的诱导和快速繁殖研究[J]. 林业科技开发,1997,3:29-30.
Study Experiment on Optimization of Propagation for Clump Buds of‘Yongjin’
ZHANG Chun-fang1,FU Tao1,HE Yue-qiu1,WANG Jian-jun2,WANG Hao2,ZHENG Guo-qiang3
(1. Ningbo City College of Vocational Technology, Ningbo 315100, Zhejiang, China; 2. Seedling Breeding Center of Ningbo Specialty Forest Seedlings, Ningbo Forestry Bureau, Ningbo 315012, Zhejiang, China; 3. Jiangsu Bi Yun Tian Agriculture and Forestry Science and Technology Co., Ltd. of Jiangsu, Danyang 212300, China)
New shoots were collected from 14-year‘Yongjin’ in Ningbo, Zhejiang province in March of 2015 for experiment on propagation of clump buds. In order to improve the proliferation efficiency and growth condition of clump buds in‘Yongjin’, new shoots of axillary buds that have not yet germinated was as experimental materials of the‘Yongjin’in this paper, systematic study was carried out about different medium, hormones, sucrose concentrations, pH values, subculture patterns and succession subculture cycles by means of plant tissue culture techniques was tested on growth of clump buds. The result showed that the optimal scheme propagation of clump buds was as follows: MS+50 mg∙L-1of NaH2PO4+2 mg∙L-1of 6-BA+0.02 mg∙L-1of IBA, about multiplication optimization of clump buds in‘Yongjin’, and sucrose concentration was between 20-30 g·L-1, pH was 5.8-6.2, subculture pattern was ①-③-①(①: MS+50 mg∙L-1of NaH2PO4+3 mg∙L-1of 6-BA+0.02 mg∙L-1of 6- IBA,③: MS+50 mg∙L-1ofNaH2PO4+1 mg∙L-1of 6-BA+0.02 mg∙L-1of IBA, subculture cycle was of 25-30 days. The results of this study can effectively improve growing weakness, yellow, brown of the buds in ‘Yongjin’ subculture, and increase the proliferation efficiency.
‘Yongjin’; clump buds; tissue culture ; proliferation
10.3969/j.issn.1001-3776.2018.03.001
S792.23
A
1001-3776(2018)03-0001-08
2017-12-23;
2018-04-16
国家星火计划项目(2015GA690062);宁波农业重大(重点)项目(2012C10013)
张椿芳,讲师,从事植物组织培养研究工作,E-Mail:zhangchunfang@nbcc.cn;
王建军,教授级高工,从事新品种选育、推广工作,E-mail:13600622469@163.com。
