脑缺血和缺血再灌注大鼠皮层神经元自噬的动态变化*
2018-08-29陶红苗单小云李旭升陈浩浩毛宇飞何忠平
陶红苗, 单小云, 李旭升, 陈浩浩, 毛宇飞, 何忠平
(1. 金华职业技术学院, 2. 金华市中心医院, 3. 金华市食品药品检验检测研究院, 浙江 金华 321000)
缺血性脑卒中是全球主要的致死及致残疾病之一[1],在有效时间窗内恢复缺血脑组织的血液灌注是目前缺血性脑卒中的唯一有效治疗策略。然而,血流再灌却造成脑缺血再灌注损伤,极大地影响缺血性脑卒中的临床治疗。脑缺血损伤的病理机制尚未完全阐明,有证据表明细胞自噬可能在其中发挥了重要的作用[2-5]。细胞自噬是一种细胞通过自噬溶酶体途径降解细胞内容物的过程。正常情况下,细胞内维持着低水平的自噬;当受到营养缺乏、低氧和炎症等刺激后细胞内自噬可被激活[6]。诸多文献报道大鼠局灶性脑缺血再灌注损伤后自噬溶酶体途径被激活,自噬通过降解损伤线粒体、清除炎症物质等机制发挥神经保护作用[7,8];但是,自噬溶酶体途径的过度激活可能将胞浆物质和细胞器“消化”掉,造成细胞内环境紊乱和能量耗竭,引发细胞凋亡程序的启动,导致细胞死亡加重了缺血损伤[9]。自噬在脑缺血损伤过程中究竟发挥了什么样的作用,目前结论不一。有学者认为自噬如同一把双刃剑,脑缺血不同时期的自噬对神经细胞的转归有截然不同的作用[8]。而且有研究表明,在缺血再灌注损伤中施加药物、缺血后处理等调控因素可以有效减轻其损伤程度,而且调节神经细胞自噬水平是主要治疗机制之一,提示自噬是一种潜在的脑缺血损伤治疗靶点[9-14]。因此,了解自噬水平变化规律可以为临床治疗脑缺血再灌注损伤提供可靠的实验依据和理论基础。
本实验通过建立局灶性大鼠脑缺血和脑缺血再灌注模型,在不同时间点分别采用Western印迹法测定大脑皮层脑组织中微管相关蛋白轻链3(microtubule associated protein light chain 3,LC3-Ⅱ)的水平,并进一步通过透射电镜检测大脑皮层神经细胞自噬情况,探讨局灶性脑缺血和缺血再灌注所诱导大鼠脑皮层神经细胞的自噬变化规律。
1 材料与方法
1.1 动物
普通级雄性健康SD大鼠60只,体重(250~280) g,由上海斯莱克实验动物有限责任公司提供。生产许可证号为SCXK(沪)2012-0002,动物合格证号为0267760。
1.2 主要试剂及材料
栓线(北京沙东生物有限公司,2634-A4型);LC3-Ⅱ抗体(ab128025,英国Abcam公司);GAPDH(MAB5465,联科生物)、山羊抗兔Ⅱ抗(GAR0072,联科生物)。TECNAI 10 透射电镜。
1.3 动物分组及模型制备
取健康雄性SD大鼠60只,随机分为假手术(Sham)组(n=10)、脑缺血和缺血/再灌注模型组(n=50)。大鼠称重,腹腔注射10%水合氯醛(350 mg/kg)麻醉大鼠。Sham组仅单纯暴露右侧颈总、颈内和颈外动脉,不做其他任何处理。模型组大鼠采用Longa等[15]改良线栓法制作右侧大脑中动脉栓塞(right middle cerebral artery occlusion,MCAO)模型:颈部正中切口,分离右侧颈总动脉、颈外动脉及颈内动脉;结扎颈外动脉远心端,用血管夹暂时夹闭颈总动脉近心端和颈内动脉;在颈外动脉靠近颈总动脉分叉处剪1小口,插入一特制线栓(其一端用硅胶包被),松开颈内动脉上的血管夹,将线栓轻轻由颈外动脉插入颈内动脉,直至线栓堵塞大脑中动脉的起始部,线栓插入长度一般为18~20 mm,扎紧线栓,再松开颈总动脉上的血管夹。模型组于缺血30 min、2 h和缺血2 h再灌注1 h、6 h、24 h五个时间点分别随机抽取10只大鼠:缺血30 min及2 h大鼠不拔出线栓,直接处死并取材;缺血2 h再灌注1 h、6 h、24 h组大鼠,于缺血2 h后拔出线栓(即开始再灌注),再灌注1 h、6 h和24 h时处死大鼠并取材。各组大鼠模型如未能存活至预计时间点,则重新制作模型补足。大鼠苏醒后,依据Zea longa 5分制标准(无神经功能缺损症状、活动正常者为0分;不能伸展对侧前爪者为1分;爬行时出现向左转圈者为2分;行走时身体向偏瘫侧倾倒者为3分;不能自发行走,意识丧失者为4分),筛选出2分或3分的具有典型脑缺血症状的大鼠模型进入后续实验,剔除其余动物以保证入组动物均造模成功。所有大鼠造模后均无死亡,造模成功率80%。
1.4 标本的采集和保存
每个时间点各组随机抽取4只大鼠,腹腔注射水合氯醛麻醉并处死大鼠,迅速断头取脑组织,去除嗅球、小脑和低位脑干,取右侧大脑半球组织标本,用于脑梗死体积测定。其余6只大鼠处死后迅速用预冷的生理盐水及4%福尔马林溶液(溶于生理盐水)恒压贯序体循环灌流固定,以梗死区脑组织为中心,分别取材并用于以下指标检测:取约2 mm厚的脑组织称湿重后用于含水量检测;另取小块脑组织迅速放入液氮,再转入-80 ℃冰箱保存,用于Western印迹检测;随机选取3只大鼠,于海马位置冠状位切一块脑组织浸入4%甲醛固定,用于病理学检查,并切取1 mm3皮层组织浸入2.5%戊二醛固定,用于透射电镜检查。
1.5 TTC法检测脑梗死体积
沿冠状面将右侧大脑半球切片,片厚约2 mm,迅速将脑片置于2%TTC-PBS中,37 ℃避光孵育30 min,不时翻动脑片使之与染液均匀接触。正常脑组织染成深红色,梗死区为白色(不着色)。染色后弃去染液,将脑片放入4%甲醛中固定24 h,数码相机拍照,将图像输入计算机,用图像分析软件Image-Pro Plus 6.0计算脑梗死体积百分比。为减少由脑水肿产生的误差,采用以下公式计算大脑梗死体积百分比(%)=(缺血对侧半球体积一缺血侧非梗死体积)/缺血对侧半球体积×100%[16]。
1.6 干湿法测定脑组织的含水量
取病变侧约2 mm厚的脑组织称湿重,放入95 ℃烤箱内烘干24 h至恒重后取出恢复到室温,称干重。脑组织含水量(%)=(脑组织湿重-脑组织干重)/脑组织湿重×100%。
1.7 脑组织的病理学观察
将沿海马位置冠状位切取的脑组织浸入4%甲醛溶液中固定,常规石蜡包埋、HE染色制片,观察脑组织病理学变化。
1.8 Western印迹法检测LC3-Ⅱ的蛋白质水平
将脑组织称重后剪碎匀浆,加入细胞裂解液裂解,离心,取上清采用BCA法测定蛋白质浓度,-80 ℃冰箱保存。取适量蛋白质样本按常规方法进行聚丙烯酰胺凝胶电泳,电泳后将凝胶上分离得到的蛋白质条带转印至PVDF膜上,然后分别用非标记I抗(抗LC3-Ⅱ抗体)及Ⅱ抗(山羊抗兔IgG)对其进行孵育、检测。用Image J图像分析软件分析灰度值,以LC3-Ⅱ/LC3-Ⅰ比值为其相对表达水平。
1.9 透射电镜观察脑组织的自噬情况
取1 mm3皮层脑组织,置于2.5%戊二醛溶液中固定过夜。磷酸缓冲液冲洗后,用1%锇酸固定1 h;梯度乙醇、丙酮脱水,纯包埋剂包埋。将超薄(120 nm)切片经铀、铅双染色后上单孔铜网,透射电镜下观察自噬泡并拍照。自噬体和自噬溶酶体的判断标准参考相关指南[17]:自噬体为双层膜结构(至少可见部分双层膜结构),内含结构完整的细胞器;自噬溶酶体为单层膜结构,内含处于不同消化阶段的细胞器或胞质成分。由于有时很难严格区分自噬体和自噬溶酶体,经常将二者统称为自噬泡。
1.10 统计学处理

2 结果
2.1 脑梗死体积的动态变化
缺血30 min大鼠无明显脑梗死,再灌注1 h,6 h,24 h大鼠脑梗死体积随再灌注时间延长呈增加趋势,与Sham组相比,再灌注6 h,24 h大鼠脑梗死体积具有统计学差异(P<0.01,图1、表1)。
2.2 脑组织含水量的动态变化
缺血30 min、2 h,缺血后再灌注1 h、6 h脑组织含水量呈逐渐增加趋势,但与Sham组比较均无统计学差异。再灌注24 h脑组织含水量较Sham组明显增加,差异具有统计学意义(P<0.05,表1)。
Fig.1The representative images of the infarcts stained with TTC in each group were showed
a: Sham group; b: Isch 30 min group; c: Isch 2 h group; d: Repe 1 h group; e: Repe 6 h group; f: Repe 24 h group
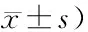

GroupsInfarct size(n=4)Water content(n=6)Sham079.56±4.98Isch 30 min079.66±3.90Isch 2 h2.75±0.4480.49±4.47Repe 1 h4.70±0.5482.78±3.04Repe 6 h9.75±2.81**82.94±6.39Repe 24 h24.78±3.53**86.49±4.35*
*P<0.05,**P<0.01vssham group
2.3 HE染色观察大鼠脑组织病理学的动态改变
Sham组大鼠脑皮层区和海马区结构正常,细胞排列致密规则,无明显水肿、细胞变性及凋亡等改变。缺血30 min、缺血2 h时,大鼠大脑皮层均未见明显病变,海马区见少量神经元细胞核皱缩、深染呈变性凋亡状态。缺血后再灌注1 h、6 h时,大鼠脑皮层未见明显病理改变,海马区见较多神经元细胞核皱缩、深染呈变性凋亡状态。再灌注24 h时,大鼠脑皮层见组织水肿、疏松,部分细胞变性、凋亡,海马区见大量神经元细胞核皱缩、深染呈变性凋亡状(图2)。

Fig.2The dynamic changes of neurons in cortex and hippocampus after ischemia/reperfusion as determined by HE staining(×200)
a: Sham group; b: Isch 30 min group; c: Isch 2 h group; d: Repe 1 h group; e: Repe 6 h group; f: Repe 24 h group. The arrows in the picture refer to nucleus shrinkage, hyperchromatosis and apoptosis. The circle represents tissue edema and loose structure
2.4 Western blot法检测MCAO大鼠大脑皮层LC3蛋白质水平的动态变化
与Sham组比较,缺血30 min大鼠大脑皮层LC3-Ⅱ/Ⅰ比值无明显差异,缺血2 h该比值明显升高,差异有统计学意义(P<0.01)。缺血再灌注1 h、6 h大鼠大脑皮层LC3-Ⅱ/Ⅰ比值虽较缺血2 h有所下降,但仍明显高于Sham组(P<0.05);缺血再灌注24 h大鼠大脑皮层LC3-Ⅱ/Ⅰ达到高峰0.43±0.06,明显高于Sham组(P<0.01,图3和表2)。

Fig.3The dynamic changes in expression level of LC3-Ⅱ protein in the rat brain cortex detected by Western blot
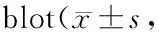

GroupsLC3-Ⅱ/LC3-Ⅰ ratioSham0.20±0.09Isch 30 min0.26±0.02Isch 2 h0.37±0.04**Repe 1 h0.32±0.06*Repe 6 h0.30±0.03*Repe 24 h0.43±0.06**
*P<0.05,**P<0.01vssham group
2.5 透射电镜观察大鼠脑皮层自噬的动态变化
Sham组大鼠神经元细胞核结构正常,染色质分布较均匀,线粒体脊线清晰,神经髓鞘丰富,自噬不明显。与Sham组相比,缺血30 min大鼠皮层神经元染色质有固缩,线粒体有轻度损伤,有1~2个自噬泡;缺血2 h细胞凋亡较明显,可见较多的自噬泡。缺血/再灌注1 h、6 h时,神经细胞凋亡更明显,自噬泡持续增多;缺血/再灌注24 h时,神经细胞边界模糊接近坏死,自噬泡在各组别中最多(图4)。
3 讨论
研究表明,自噬是脑缺血过程中的重要细胞生物学事件,脑缺血过程中伴有细胞自噬发生,且缺血和缺血/再灌注过程中都伴有自噬激活,提示细胞自噬可能与脑缺血过程密切相关[2-5]。尽管自噬在脑缺血过程中的作用仍存在争议,但最近的研究表明,脑缺血/再灌注过程中的细胞自噬通过清除损伤线粒体进而发挥了神经保护作用[8]。不仅如此,通过药理学或者缺血后处理等方法调控缺血/再灌注过程中的细胞自噬,可减轻脑缺血损伤[10,18]。这些结果提示,自噬可能是一种抗脑缺血/再灌注损伤的药物干预新靶点。然而,自噬是一种复杂的细胞生物学过程,脑缺血/再灌注过程中自噬发生的时相特征尚不完全清楚。因此,了解缺血/再灌注过程中自噬的变化规律,对进一步寻找自噬干预时间窗具有十分重要的意义。

Fig.4Observation of autophagy in the rat brain cortex by transmission electron microscopy. a: Sham group; b: Isch 30 min group; c: Isch 2 h group; d: Repe 1 h group; e: Repe 6 h group; f: Repe 24 h group. The arrows in the picture refer to autophagic vesicles, and the circle represents chromatin condensation
本研究采用的大鼠大脑中动脉栓塞-再灌注模型是一种常用的动物局灶性脑梗死模型。本实验结果显示,再灌注6 h和24 h时大鼠脑梗死体积增加较明显,再灌注24 h时脑组织含水量增加较明显,见皮层组织水肿、疏松,部分细胞变性、凋亡,海马区可见大量神经元细胞核皱缩、深染呈变性凋亡状。该结果与前人的发现一致,同时也证实了本实验模型的可靠性。基于该模型,我们进一步探讨了缺血再灌注不同时间点自噬的激活情况。
LC3是自噬标志物。自噬泡成熟时,LC3-I转变为LC3-II(即自噬体膜型),LC3-II/I比值的大小被广泛用于评估自噬激活的程度。本实验结果显示,缺血诱导自噬激活的时间可能在30 min以上,该结果与之前的报道类似[19]。然而,缺血诱导的自噬并未因血流再灌注而终止,再灌注1 h、6 h时自噬持续升高,再灌注24 h达到高峰。该结果提示,缺血后再灌注同样是诱导神经元自噬的一种重要应激因素。该结果还提示,在缺血后再灌注过程中自噬可能存在着较长的激活时相。透射电镜是研究自噬最可靠的检测手段,我们利用透射电镜对梗死区周围大脑皮层组织进行了观察,进一步证实了上述现象。上述研究均发现,在局灶性脑缺血再灌注模型中大脑皮层缺血2 h神经细胞自噬即明显激活,再灌注1 h、6 h自噬均持续增高,再灌注24 h自噬达高峰,提示缺血和缺血再灌注过程中都伴有自噬激活。
在缺血过程中,组织低氧、酸化及能量供应障碍都可能是导致自噬激活的因素,本研究发现自噬随缺血时间延长而激活,提示自噬激活可能与病理损伤的程度呈正相关。然而,伴随着血流再灌注过程,氧化应激损伤是主要病理特征。有文献报道,氧化应激是激活自噬的重要途径[6]。脑缺血后的再灌注过程伴随着氧化应激,在再灌注早期有大量活性氧(reactive oxygen species, ROS)生成,对组织细胞造成氧化损伤,同时细胞通过多种抗氧化机制清除部分的过氧化物。随着再灌注的进行,这些半衰期较短的ROS可能通过超氧化物歧化酶的作用形成过氧化氢及脂质过氧化物,后者的半衰期较长,造成组织的持续氧化损伤。不仅如此,而且细胞的抗氧化机制在再灌注早期已耗竭,会造成氧化应激的第二次增强。本实验发现,相比缺血2 h组,缺血后再灌注过程造成的自噬激活呈现先降低、后升高的趋势,于再灌注24 h达峰值,这可能是再灌注过程中氧化应激导致自噬二次激活的原因。该结果提示,调控缺血再灌注后的氧化应激可能是有效干预自噬的手段之一。
本研究未对再灌注24 h后的情况进行观察。但有学者[20]采用透射电镜观察到,脑缺血再灌注损伤后半暗带神经细胞内自噬体形成、溶酶体增多,并持续到5 d。提示自噬激活可能存在于脑缺血再灌注后的较长时间内,这可能为缺血性脑损伤治疗提供了一个具有更长时间窗的治疗策略。有研究利用永久性脑缺血大鼠模型发现,缺血1 h半暗带自噬就开始激活,缺血5 h自噬达高峰,而缺血性脑卒中24 h时自噬活性明显下降而凋亡激活,认为可能发生了从自噬到凋亡的转变[19]。这提示,在不同脑缺血大鼠模型中自噬激活的规律存在差异,在将自噬作为脑卒中治疗靶点时,需要充分考虑到这一点。
综上所述,本研究通过大鼠在体脑缺血和缺血再灌注损伤模型,发现大脑皮层缺血2 h神经细胞自噬即明显激活,缺血后再灌注1 h、6 h时自噬均持续增高,缺血后再灌注24 h时自噬达高峰,为自噬干预提供了理论依据。
