内皮素-1对大鼠血管平滑肌细胞产生MCP-1的影响及其机制*
2018-08-29汪晨净裴淑燕南晓东马艳庆
汪晨净, 裴淑燕, 南晓东, 马艳庆
(1. 西北民族大学医学院机能教研室, 甘肃 兰州 730030; 2. 武警甘肃总队医院重症医学科, 兰州 730050)
随着动脉粥样硬化(atherosclerosis, ATH)发生机制研究的不断深入,血管平滑肌细胞(vascular smooth muscle cells, VSMCs)激活,及其所引发的慢性血管炎症反应在ATH病理过程中的关键性作用已得到共识[1,2]。
大量的研究证实,外周血中单核细胞趋化、黏附于损伤内膜,并侵入动脉壁是ATH发生过程中最早期的中心事件。尽管此过程受多种趋化因子影响,但起关键作用的是单核细胞趋化蛋白-1(monocyte chemoattractant protein-1, MCP-1)[3]。MCP-1对单核吞噬细胞有较强的趋化作用,可与其受体—趋化因子受体2(chemokine C-C-motif receptor 2, CCR2)结合,通过细胞膜上G蛋白偶联的磷酸肌醇等信号通路,特异性地趋化并激活单核/巨噬细胞黏附、迁移进入内膜下层[4]。此外,MCP-1也可作用于VSMCs上的CCR2,直接刺激VSMCs增殖和迁移[5]。而在ATH发生后期,MCP-1对于促进斑块的形成和破裂也起到重要作用[6]。MCP-1可通过多种途径直接参与或影响ATH慢性炎症反应的多个病理过程。
MCP-1可由多种细胞合成与分泌。研究发现,在IL-1、TNF-α、PKC和AngII等炎性因子或血管活性物质的刺激下,MCP-1可由VSMCs产生[7,8]。Takahashi等[9]以鼠抗人MCP-1单克隆抗体进行的免疫组化研究也表明,MCP-1在ATH病灶中的表达主要位于VSMCs。据此认为,在ATH血管炎症反应过程中VSMCs不仅是MCP-1的效应器,亦是ATH过程中MCP-1的重要来源。
血管活性肽-内皮素-1(endothelin-1, ET-1)是ET家族中重要成员之一,可由主要分布于VSMCs、心肌细胞及内皮细胞的ET-1受体(endothelin-1 receptor, ETR)ETAR、ETBR介导,参与多种心血管疾病的发病过程[10]。近年来的研究表明,ET-1不仅与ATH病理过程中的内皮细胞损伤有关,还直接参与了这一过程中VSMCs、单核细胞、白细胞等炎性细胞的激活和趋化。ET-1亦可刺激VSMCs异常增殖、迁移及重塑;可诱导VSMCs和单核细胞释放IL-6、IL-1β、TNF-α 等炎性因子[11, 12],进而参与ATH发生、发展中的慢性血管炎症反应。
尽管已有研究证实了来源于VSMCs的MCP-1和ET-1激活VSMCs在ATH慢性血管炎症反应发生机制中的重要作用,然而这两者之间可能存在的相互作用及其作用机制在ATH慢性血管炎症病理进程中的意义目前并不十分明晰。由此,本文拟探讨ET-1对VSMCs产生MCP-1的影响及其机制,以期为进一步揭示ET-1经由激活VSMCs及血管炎症性反应而介导ATH的发生机制提供理论依据。
1 材料与方法
1.1 动物
健康雄性 SD 大鼠,3~4月龄,200~250 g (购自兰州大学医学院实验动物中心)。
1.2 药品和试剂
ET-1、BQ123、BQ788、SB203580及SP600125(Alexis),PD98059(Cayman),NAC、PDTC(Sigma),DMEM(Gibco),胎牛血清(Hyclone),兔抗大鼠ERK、phospho-ERK、p38MAPK、phospho-p38MAPK、JNK及phospho-JNK抗体(Cell Signaling Technology),小鼠抗大鼠β-actin抗体(Abcam)、辣根过氧化物酶(HRP)标记的羊抗兔IgG二抗、HRP标记的羊抗小鼠IgG二抗(Pioneer biotechnology Inc),MCP-1 ELISA检测试剂盒(深圳晶美),兔SP免疫组化试剂盒、DAB显色试剂盒及兔抗大鼠α-actin多克隆抗体(北京博奥森),RNAfast1000-总RNA 提取试剂盒(上海飞捷生物),Thermo Scientific RevertAidTMFirst Strand cDNA Synthesis 试剂盒K1622(德国Fementas),2×Taq PCR MasterMix试剂盒(Beijing Aide Lai Biotechnology Co., Ltd)。
1.3 主要实验仪器
CO2培养箱(美国Sheldon公司),Olympus倒置相差显著镜(日本Olympus公司),TC-512 Thermal Cycler DNA扩增仪(英国Techne),DYY-7C 型转移电泳仪(北京六一仪器厂),Gel DOC2000凝胶扫描成像系统(美国Bio-Rad公司),Image master VDS 扫描仪(瑞典Amersham Pharmacia Biotech公司)。
1.4 VSMCs培养
按文献组织贴块法培养大鼠VSMCs[13]。分离雄性SD大鼠胸主动脉段血管,置于含10 %胎牛血清、100 U/ml 青霉素和100 U/ml 链霉素的DMEM培养基中,于37℃,5% CO2孵箱中培养。胰蛋白酶消化进行传代,采用3~8代细胞进行实验。
1.5 VSMCs鉴定
倒置相差显微镜下,VSMCs增殖到一定时期,VSMCs呈典型“峰”和“谷”状。用SP组化试剂盒及兔抗大鼠α-actin抗体进行VSMCs免疫细胞化学染色,鉴定培养细胞。
1.6 ELISA法检测大鼠主动脉VSMCs MCP-1蛋白质浓度
VSMCs同步化后,分为ET-1刺激组及阻断剂干预组。ET-1刺激组:VSMCs与不同浓度ET-1(10-9,10-8,10-7,10-6mol/L)分别孵育(0、6、12、24、48 h);阻断剂干预组:VSMCs预先30 min分别加入ETAR拮抗剂BQ123(10-5mol/L)、ETBR拮抗剂BQ788(10-5mol/L)、抗氧化剂NAC(10-5mol/L)、ERK抑制剂PD98059(10-5mol/L)、p38MAPK抑制剂SB203580(10-5mol/L)、JNK抑制剂SP600125(10-5mol/L)及 NF-κB抑制剂PDTC(10-5mol/L),再加入ET-1(10-7mol/L)孵育24 h。按预定时间收集VSMCs上清液,-20℃保存备用。ELISA法测定大鼠VSMCs上清液中MCP-1的蛋白质浓度,以反映大鼠VSMCs MCP-1蛋白质表达量。
1.7 RT-PCR法检测大鼠VSMCs中MCP-1 mRNA的表达量
VSMCs同步化后,分为ET-1刺激组及阻断剂干预组。ET-1刺激组:VSMCs与不同浓度ET-1(10-9,10-8,10-7,10-6mol/L)分别孵育24 h;阻断剂干预组:VSMCs处理与1.2.3 中阻断剂干预组相同。按预定时间弃去VSMCs上清液,PBS冲洗后,用RNAfast1000-总RNA提取试剂盒提取细胞总RNA。取总RNA 1 μg,用RevertAidTMFirst Strand cDNA Synthesis 试剂盒将其逆转录为cDNA,4℃保存备用。
取上述逆转录cDNA产物 2 μl 作为PCR扩增模板。MCP-1上游及下游引物序列分别为:5’- AGG TCT CTG TCA CGC TTC TG -3’,5’- CTG GTG ATT CTC TTG TAG TTC TCC -3’(NM-031530.1),扩增产物长度为163 bp;内参基因GAPDH上游及下游引物序列分别为:5’-GCA AGT TCA ACG GCA CAG TCA AG-3’,5’-ACA TAC TCA GCA CCA GCA TCA CC-3’(NM-017008.3),扩增产物长度为124 bp。各引物均由北京三博远志生物技术有限公司合成。PCR扩增体系中包含MgCl2、dNTP引物和Taq-DNA 聚合酶。PCR扩增条件为:94℃、3 min;94℃、30 s,55℃、30 s,72℃、60 s,循环35次;72℃、5 min。PCR结束后,取5 μl 反应产物进行2 %琼脂糖凝胶电泳,紫外灯透射观察、拍照并分析结果,以目的基因MCP-1与内参基因GAPDH扩增条带的信号强度比值反映MCP-1 mRNA的表达量。
1.8 Western blot 法测定大鼠VSMCs ERK、phospho-ERK、p38MAPK、phospho-p38MAPK、JNK及phospho-JNK蛋白质表达量
VSMCs同步化后,预先分别加入BQ123(10-5mol/L)、BQ788(10-5mol/L)、PD98059(10-5mol/L)、SB203580(10-5mol/L)及SP600125(10-5mol/L)孵育20 min,再以ET-1(10-7mol/L)刺激5 min。然后提取VSMCs胞浆蛋白并定量。聚丙烯酰胺凝胶电泳法分离目的蛋白,化学发光法检测目的蛋白,全自动凝胶成像系统对结果进行扫描分析并拍照,Gel Pro软件进行条带的扫描分析数据,数据用灰度值表示,并将同一样本目的和内参蛋白所获数据进行比较得到目的蛋白的相对表达量。一抗:p-ERK、ERK、p-p38MAPK、p38MAPK、p-JNK兔抗大鼠单克隆抗体、JNK兔抗大鼠多克隆抗体及小鼠抗大鼠β-actin单克隆抗体浓度分别为1∶2 000、1∶1 000、1∶1 000、1∶1 000、1∶1 000、1∶1 000 及 1∶10 000。二抗:HRP标记的羊抗兔IgG抗体,羊抗小鼠IgG抗体浓度分别为 1∶5 000、1∶10 000。
1.9 统计学处理
2 结果
2.1 VSMCs的鉴定及纯度
培养5~6 d 时,倒置相差显微镜下可见组织块周围有少量细胞游出,形态呈长梭形,放射状生长。培养两周左右局部成束的细胞平行排列,呈典型高低起伏的“峰”、“谷”状(图 1A)。第 3 代VSMCs α-actin 免疫组化染色表明:阳性染色细胞大于99%,即胞浆呈棕黄色细颗粒状染色,胞核不着色,证实为高纯度VSMCs(图1B)。

Fig.1The identification of VSMCs
A: The third passage of rat aorta VSMCs (× 100); B: Expression of α-actin in aorta VSMCs observed by immunocytochemical staining with anti-rat α-actin polyclonal antibody (× 400); VSMCs: Vascular smooth muscle cells
2.2 ET-1对大鼠VSMCs MCP-1蛋白质及mRNA的影响
ELISA及RT-PCR检测结果表明: ET-1(10-9,10-8,10-7,10-6mol/L)刺激VSMCs不同时间,MCP-1蛋白质浓度随ET-1浓度和时间的增加而呈增高趋势。ET-1(10-9,10-8,10-7,10-6mol/L)刺激VSMCs 24 h后,MCP-1 mRNA表达量也随ET-1浓度的增加而升高,其表达量分别为0.18±0.06、0.34±0.07、0.55±0.08、0.75±0.08。与对照组比较,ET-1(10-8、10-7、10-6mol/L)能明显升高MCP-1蛋白质浓度及mRNA表达量,差异有显著性(P<0.01)。与0 h比较,10-9,10-8,10-7,10-6mol/L ET-1刺激VSMC 6 h,12 h,24 h, 48 h均能明显升高MCP-1蛋白质浓度,差异有显著性(P<0.05,P<0.01)。在阻断剂干预实验中,与对照组比较,ET-1(10-7mol/L)能显著升高VSMCs MCP-1蛋白质浓度及mRNA表达量,差异有显著性(P<0.01);与单独使用ET-1(10-7mol/L)组比较,BQ123、NAC、PD98059、SB203580及PDTC能显著抑制ET-1诱导的VSMCs MCP-1蛋白质及mRNA表达(P<0.01),而BQ788及SP600125对此作用无明显影响(表1,图2,图3)。
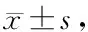
Tab. 1 Time-and-concentration effects of ET-1-induced MCP-1 protein production (ng/L, n=3)
ET-1: Endothelin-1; MCP-1: Monocyte chemoattractant protein-1
*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vs0 h
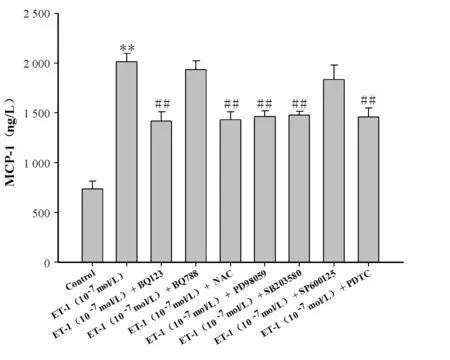

ET-1: Endothelin-1; MCP-1: Monocyte chemotactic protein-1
**P<0.01vscontrol group;##P<0.01vsET-1 alone
2.3 ET-1对大鼠VSMCs p-ERK及p-p38MAPK表达的影响
Western blot检测B结果显示:正常培养情况下,对照组VSMCs胞浆内以非磷酸化的ERK、p38MAPK表达为主,仅有少量p-ERK、p-p38MAPK。ET-1可明显提高p-ERK及p-p38MAPK水平。与对照组相比,p-ERK/ERK、p-p38MAPK/p38MAPK比值均显著升高(P<0.01),提示ET-1可激活ERK、p38MAPK通路。与单独使用ET-1组比较,BQ123、NAC与PD98059 或 SB203580均可显著减少ET-1诱导的ERK、p38MAPK磷酸化(P<0.05,P<0.01);而BQ788不能对p-ERK及p-p38MAPK的表达产生明显影响。说明ETAR及ROS介导了ERK、p38MAPK的磷酸化作用(表2,图4,图5)。
2.4 ET-1对大鼠VSMCs p-JNK水平的影响
Western blot检测结果显示:正常情况下,对照组VSMCs胞浆内以非磷酸化的JNK表达为主,仅有少量p-JNK存在。与对照组比较,ET-1(10-7mol/L)对p-JNK水平无明显影响,提示ET-1对JNK通路无明显激活作用。与单独使用ET-1(10-7mol/L)比较,BQ123、BQ788、NAC 及 SP600125 对ET-1刺激后p-JNK/JNK比值亦均无明显影响(表2,图6),说明ET-1刺激后,VSMCs未发生明显的JNK磷酸化反应。

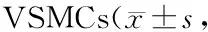
A: Concentration effect of ET-1-induced MCP-1 mRNA expression; B: Effect of different blockers on ET-1-stimulated MCP-1 mRNA expression
**P<0.01vscontrol;##P<0.01vsET-1 alone
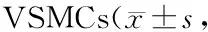

Groupp-ERK/ERKp-p38MAPK/p38MAPKp-JNK/JNKControl0.45±0.14**0.26±0.04**0.20±0.02ET-1 alone1.73±0.291.80±0.150.23±0.02BQ123+ET-10.71±0.27*0.96±0.04**0.22±0.01BQ788+ET-11.55±0.531.58±0.100.23±0.02NAC+ET-10.90±0.28*1.05±0.04**0.21±0.02PD98059+ET-11.07±0.27* - -SB203580+ET-1 -1.17±0.05** -SP600125+ET-1 - -0.21±0.01
*P<0.05,**P<0.01vsET-1 alone

Fig.4Expressions of p-ERK, ERK and β-actin protein in VSMCs detected by Western blot

Fig.5Expressions of p-p38MAPK, p38MAPK and β-actin protein in VSMCs detected by Western blot

Fig.6Expressions of p-JNK, JNK and β-actin protein in VSMCs detected by Western blot
3 讨论
ATH是缺血性心脑血管疾病的重要病理基础,其发病机制有“脂质斑块沉积”、“内皮细胞损伤”等多种学说。目前慢性炎症反应已逐渐成为ATH发病机制领域的研究热点。炎性反应过程中,致炎因子MCP-1通过与其特异性受体CCR2结合,不仅参与了单核/巨噬细胞的趋化、聚集,而且在VSMCs的增殖、迁移,粥样斑块的形成、破裂及血栓形成等ATH血管炎症反应的病理过程中起着重要作用[5, 6, 14]。同时已有研究证实,VSMCs作为参与ATH的关键性的细胞成分可能在血管活性物质的刺激下成为炎性因子的重要来源[11]。
ET-1是ET家族中生物学活性最强、作用持续时间最久的缩血管活性物质[15],主要表达于内皮细胞和平滑肌细胞。ETAR和ETBR是ET-1的两种特异性受体,ETAR主要分布于VSMCs,ETB2R主要分布于内皮细胞。新近研究发现:在ATH的病理过程中,ET-1与其不同受体结合后,经由ROS、MAPK通路等多个级联信号转导,不仅可以引起内皮损伤、刺激VSMCs凋亡、迁移、增殖和纤维化,同时还能诱导VSMCs产生炎性因子,进而参与ATH的炎症反应[16-18]。
MCP-1在ATH炎症反应中的作用及ET-1特异性ETAR的VSMCs分布特性和作用则提示:ET-1可能也是ATH血管炎症反应过程中激活VSMCs产生MCP-1的又一重要刺激物。本实验证实:ET-1能诱导大鼠VSMCs MCP-1蛋白质及mRNA表达。ETAR抑制剂BQ123能显著抑制ET-1的此种效应,而ETBR抑制剂BQ788的抑制作用并不明显,提示ET-1诱导VSMCs产生MCP-1主要通过VSMCs上ETAR介导。此外,抗氧化剂NAC、ERK、p38MAPK及NF-κB抑制剂PD98059、SB203580及PDTC亦能抑制上述ET-1刺激条件下VSMCs MCP-1蛋白质及mRNA表达,说明ROS、ERK、p38MAPK及NF-κB可能参与了ET-1诱导VSMCs产生MCP-1的信号转导途径。同时,BQ123、NAC与PD98059或SB203580能分别抑制ET-1刺激条件下VSMCs 胞浆中ERK及p38MAPK的磷酸化,进一步证明ETAR、ROS及MAPK信号分子(ERK、p38MAPK)是ET-1诱导VSMCs产生MCP-1信号通路中的重要信号分子。
综上所述,本研究揭示血管活性肽ET-1能通过ROS、MAPK信号通路诱导VSMCs产生MCP-1,提示ET-1→ETAR→ROS→MAPK→NF-κB→MCP-1可能是ATH过程中VSMCs激活触发慢性血管炎症反应过程中产生MCP-1的又一新的重要途径,这将为ATH的临床防治提供新的理论依据和治疗靶点。但有关这一途径的详细信号转导机制,及其与ET-1其他致炎、致ATH途径之间的相互关系尚需进一步研究。
