γ-聚谷氨酸对面筋蛋白功能特性的影响
2018-08-28谢新华毋修远朱鸿帅郝明远
谢新华,毋修远,张 蓓,徐 超,朱鸿帅,郝明远
(1.农业部大宗粮食加工重点实验室,河南郑州 450002;2.河南农业大学食品科学技术学院,河南郑州 450002)
γ-聚谷氨酸(γ-PGA)又称纳豆胶或多聚谷氨酸,是由D-谷氨酸和L-谷氨酸通过α-氨基和γ-羧基形成γ-酰胺键聚合而成的直链高分子氨基酸聚合物,分子量一般在10~2 000 kDa左右。γ-PGA具有独特的物理、化学和生物学特性,如良好的增稠性、保水性、抗冻性等,也因具有可食用性被广泛应用于食品中[1]。Shyu等[2]研究发现,γ-PGA的添加改善了小麦面团流变学及热力学特性,有效提高了面团持水率,延缓面包老化。Kumio等[3]研究发现,γ-PGA的添加可提升酵母的耐冻性,提高酵母细胞存活率、面制品体系的稳定性,且添加1%对面包的味道及香味无明显影响。小麦面筋蛋白主要由赋予面筋蛋白黏性性能的醇溶蛋白和赋予面筋蛋白弹性性能的麦谷蛋白构成[4],两者的功能性质对面团品质有重要影响。研究发现,面筋蛋白随水合程度变化,其流变学特性、二级结构及空间构象等均会发生改变[5-7]。本试验拟采用旋转流变仪(DHR)、核磁共振仪(NMR)、傅里叶变换红外(FITR)、扫描电子显微镜(SEM)探究不同γ-PGA添加量对面筋蛋白水合作用、结构、功能特性的影响,为γ-PGA在面制品中的应用提供理论依据。
1 材料与方法
1.1 材 料
谷朊粉(面筋蛋白)购自河南省莲花面粉有限公司,蛋白含量为81%。γ-聚谷氨酸购自西安四季生物科技有限公司。
1.2 方 法
1.2.1 面筋蛋白持水率测定
根据文献和预实验,分别配制浓度为0.00%、0.17%、0.34%、0.50%、0.67%的γ-PGA溶液,取面筋蛋白粉1.0 g,缓慢加入到10 mLγ-PGA溶液中,为避免结块,采用漩涡震荡的方式;混匀后20 ℃静置3 h;10 000 r·min-1离心15 min,去上清液后称取质量。面筋蛋白的持水率按以下公式[8]计算:
面筋蛋白的持水率=(M2-M1)/M1×100%
式中M1为面筋蛋白粉质量;M2为湿面筋蛋白质量。
1.2.2 面筋蛋白水分子存在状态测定
水分流动性采用上海纽迈公司的MicroMR型核磁共振仪测定,测定其横向弛豫时间T2,共振频率为22 MHz,磁体强度为0.5 T,磁体温度为32 ℃。参数设置如下:90°脉冲时间P90为17 μs,180°脉冲时间P180为33 μs,采样点数TD为22 290,主频SW为200 kHz,模拟增益RG1为20,模拟增益RG2为3,累加次数NS为32,回波个数NECH为5 000,回波时间TE为0.250 ms。
1.2.3 面筋蛋白流变学特性测定
准确称取10.0 g面筋蛋白,采用漩涡震荡的方式缓慢加入到15 mL不同浓度γ-PGA溶液中,使混合物中γ-PGA浓度分别为0.00%、0.25%、0.50%、0.75%和1.00%,利用美国TA公司DHR-2旋转流变仪,参照Tuhumury等[9]的方法稍作修改,用保鲜膜包裹湿面筋于20 ℃恒温静置60 min;切成2 g且大小相同的圆片进行小振幅震荡测试,采用直径40 mm圆形平板探头,平板间距为1 mm,频率范围为0.1~10.0 Hz(0.63~62.80 rad·s-1),应变振幅为1%。
1.2.4 蛋白质二级结构测定
蛋白质二级结构参考文献[10]采用傅里叶红外光谱法测定,傅里叶红外光谱仪为布鲁克科技公司的TENSORⅡ型。将添加不同浓度γ-PGA的湿面筋蛋白(同1.2.3),利用美国FTS公司Flexi-Dry型冷冻干燥机冷冻干燥后磨粉,过100目筛后测定。测定参数:扫描范围400~4 000 cm-1;扫描256次;分辨率4 cm-1。结果利用 Omnic 8.2和Peakfit 4.12软件对酰胺 I 吸收峰(1 600~1 700 cm-1)进行基线校正、高斯去卷积处理和二阶求导后曲线拟合,计算各子峰面积的相对占比。
1.2.5 微观结构观察
将添加不同γ-PGA浓度的经冷冻干燥后的面筋蛋白块(同1.2.4)掰断,取中心部位制成5 mm×5 mm×5 mm样品,用导电胶粘贴于样品座上,喷金后采用美国FEI公司Quanta FEG 250型场发射扫描电镜进行观察。
1.3 数据分析
用SPSS 22.0 对数据进行统计分析。
2 结果与分析
2.1 γ-PGA对面筋蛋白持水率的影响
由图1可以看出,面筋蛋白持水率随着γ-PGA添加量的增加而显著增大,0.25%添加量可使面筋蛋白持水率由142%(不添加γ-PGA)升高至153%;添加1% γ-PGA,面筋蛋白持水率较对照提高了29%,说明γ-PGA能有效提高面筋蛋白的持水率。
2.2 γ-PGA对面筋蛋白水分迁移的影响
面筋蛋白中水分子的存在状态分别为位于0.1~10 ms与蛋白氨基酸残基结合最为紧密的强结合水和弱结合水(峰1)、位于10~100 ms可冻结的自由水(峰2)、100~1 000 ms对应的松散水分子(峰3)[11]。弛豫时间T2的值越高,表明氨基酸与低流动性水分子之间关联越弱[12]。由图2可知,随γ-PGA浓度增大,面筋蛋白中结合水与自由水的起峰位置发生前移。不同峰面积Ai值表示水分占比,低浓度γ-PGA使得松散水分(峰3)的峰面积明显降低,表明γ-PGA使得面筋蛋白中水分流动性降低。从表1可以看出,添加1%的γ-PGA使结合水A1值由9.52%升高至12.71%,松散水分子A3值从4.27%下降至0.86%,而自由水A2无明显变化,说明γ-PGA的添加使面筋蛋白中相对疏松的水分向结合水转换,更多游离水被面筋蛋白锁住,导致其持水力增大。
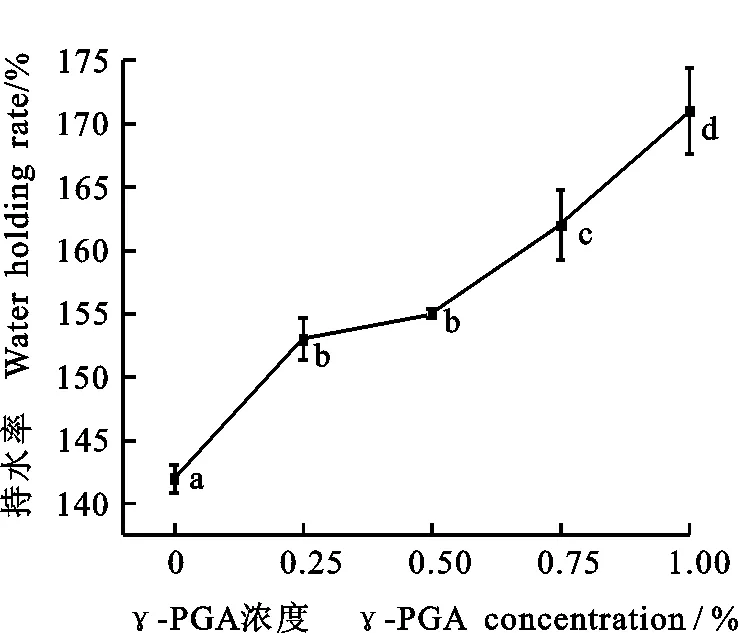
图中不同字母表示处理间差异显著(P<0.05)。Different letters in table mean significant difference at 0.05 level.

图2 γ-PGA对面筋蛋白T2的影响Fig.2 Effect of γ-PGA on the T2 of gluten proteins

表1 不同γ-PGA添加量对面筋蛋白中水分子占比的影响Table 1 Effect of γ-PGA on the ratio of water molecules of unit gluten proteins %
Ai:峰面积/样品质量。
Ai:Peak area/Sample mass.
2.3 γ-PGA对面筋蛋白流变特性的影响
由图3可知,被测面筋蛋白的G′、G″均随振动频率的增大而增加,添加γ-PGA的面筋蛋白G″值均高于对照,且随γ-PGA浓度的增加而升高,当γ-PGA浓度高于0.75%时,其G″增大速度变缓;而G′值却随γ-PGA浓度增高呈现降低趋势,表明其面筋弹性减弱。面筋蛋白体系具有类固体性质[13]。由图3看出,随γ-PGA浓度增大其tanδ呈现增大趋势,但其tanδ值始终小于1,表明面筋蛋白体系的类固体特性因γ-PGA的添加而减弱,但其类固体性质始终没有改变。
2.4 γ-PGA对面筋蛋白二级结构的影响
蛋白质的二级结构决定其功能和性质。采用傅里叶红外图谱中酰胺Ⅰ带表征蛋白的二级结构,各特征峰与面筋蛋白二级结构对应关系参考文献[12]。γ-PGA对面筋蛋白二级结构的影响如表2所示,未添加γ-PGA时,面筋蛋白二级结构中β-折叠含量为34%,α-螺旋为18%,β-转角为28%,无规则卷曲为19%。γ-PGA的添加使得面筋蛋白二级结构发生变化,蛋白聚集形成的分子间β-折叠由11.4%降至10.8%,1 686 cm-1处β-折叠增加0.7%,但β-折叠的峰面积积分总量无显著差异;α-螺旋由18.7%降至16%,而β-转角却增加2.5%,并具显著性差异。结果表明,γ-PGA的添加导致部分α-螺旋转化成β-转角,说明γ-PGA的添加使得面筋蛋白的二级结构发生变化,从而改变了蛋白功能特性。
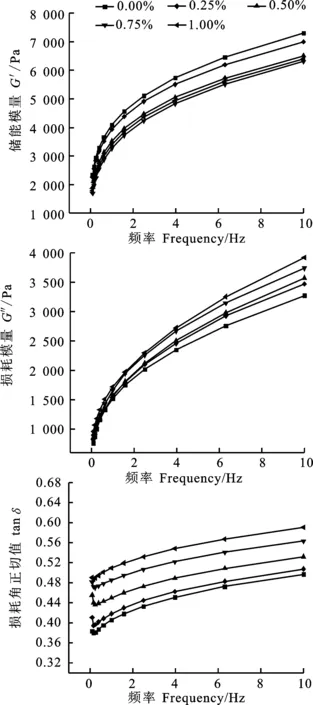
图3 γ-PGA对面筋蛋白动态流变学特性的影响
2.5 γ-PGA对面筋蛋白微观结构的影响
由图4可以看出,未添加γ-PGA的面筋蛋白网络结构中孔洞大小不均匀且平整度较差,大孔径多在40 μm左右;而添加小于0.5%的γ-PGA使面筋蛋白网孔结构变得均匀整齐,孔径多保持在20~25 μm之间;随着γ-PGA添加量的增加,面筋蛋白网孔结构分布更加均匀、密集,且孔径下降至10~15 μm,这可能与蛋白二级结构的改变有关。均匀且较小孔径的面筋蛋白网络结构可能增强了滞留水分的能力,这可能是面筋蛋白持水性提高的主要因素。
3 讨 论
本研究发现,γ-PGA的添加显著提升了面筋蛋白持水率。蛋白质持水性与其亲水基团和疏水基团分布有关,γ-PGA作为高分子阴离子聚合物,其中大量游离羧基会与水形成氢键,导致γ-PGA可吸收超过自重多倍的水[14];同时,蛋白质三维网络结构的物理截留作用与持水率提高存在很大关系,面筋蛋白和γ-PGA之间可能发生了相互作用,形成多肽-面筋蛋白复合网络结构,束缚更多的水分子,从而使得面筋蛋白体系持水率增大[15]。这与Shyu等[2]在小麦面团中添加γ-PGA的研究结果相似。

表2 γ-PGA对面筋蛋白二级结构的影响Table 2 Effect of γ-PGA on secondary structures of gluten %

图4 γ-PGA对面筋蛋白微观结构的影响(1 000×)Fig.4 Effect of γ - PGA on the micro structure of gluten proteins(1 000×)
水分分布和存在状态的差异对面筋蛋白结构及功能特性有重要影响。γ-PGA的添加促使更多的自由水转变为结合水,这可能是因为γ-PGA作为高分子聚合物,其大量亲水残基在面筋形成过程中形成竞争性吸水,加之γ-PGA良好的增稠性产生水分滞留效果,从而降低了其水分活度,使得面筋蛋白结合了更多水分子,提升了结合水含量[16],Lim等[17]研究也表明γ-PGA的添加可有效控制水分迁移。
随γ-PGA添加量的增大,面筋蛋白的G′呈下降趋势,G″呈上升趋势,可能因为γ-PGA借助阴离子基团与蛋白形成复合物,使蛋白分子表面覆盖许多使得蛋白分子间产生排斥力的负电荷,阻碍了麦谷蛋白分子链之间的相互交联,避免蛋白质聚集[18],从而降低了面筋蛋白的G′值。G″的提升则是因为蛋白聚集的减少间接提升了醇溶蛋白的流动性,同时具有强黏性的γ-PGA充当一个吸水性填充物分散在面筋网络结构中[8],从而提高了面筋蛋白的黏性性能。Baier-Schenk等[19]认为,tanδ值越大,面团体系中高聚物的含量越少,聚合度越小,本研究 tanδ值的升高也反映出γ-PGA减少了蛋白聚集,导致其弹性性能降低,黏性性能升高。Shyu等[2]也认为,添加γ-PGA可以使小麦面团黏性更高。
γ-PGA的添加导致部分α-螺旋下降,β-转角上升。这可能是因为在亲水环境中,维持α-螺旋结构稳定的氢键受到水分子或亲水基团的影响,α-螺旋稳定性降低导致其含量下降。而面筋蛋白水合作用导致了β-转角的增加,且转化程度与面筋蛋白水合程度及水分分布有关[20]。面筋蛋白二级结构的改变表明,γ-PGA在面筋蛋白体系中不仅仅起到了填充物的作用,还与面筋蛋白发生了相互作用,产生了复合空间网络结构,这两者可能是面筋蛋白持水性、流变特性变化的主要原因[21]。
γ-PGA的添加可有效改善面筋蛋白在速冻及冷冻干燥后形成的三维网络状结构[22],使水分在其中的分布更均匀,面筋蛋白也结合了更多的水,这与持水率的提高和水分迁移的变化结果保持一致,而面筋网络的改善可能与其二级结构的改变有密切关联,导致其流变学特性发生改变。
