茵陈蒿汤对脂代谢紊乱模型大鼠CH、LDL-C、TAG影响的实验研究*
2018-08-25赵嘉晶岳瑶函施永美高书荣汪颖珏
赵嘉晶 岳瑶函 施永美 高书荣 汪颖珏
(上海市普陀区人民医院,上海 200232)
随着我国经济水平的不断提高,居民日常脂肪类食物的摄入量出现明显上升,饮食习惯也发生了重大转变,从而导致脂代谢紊乱的发生率明显上升[1-3]。因此由脂代谢紊乱所继发的高脂血症、非酒精性脂肪肝以及糖尿病等相关疾病的发生率呈现出逐年上升的趋势[4-6]。中医药在脂代谢紊乱类疾病的治疗方面有着千年经验的积累,具有独特的优势。其中茵陈蒿汤通过多途径发挥调节清脂祛湿、护肝利胆等作用,是高脂血症、脂肪肝等疾病的重要方剂之一。本次研究旨在明确经方茵陈蒿汤对于脂代谢紊乱的治疗效果及其作用机制。笔者通过建立动物模式的方式进行深入探讨。现报告如下。
1 材料与方法
1.1 实验动物 40只洁净级SD雄性大鼠,周龄为6~8 周,体质量(120.34±11.49) g,购于西普尔必凯实验动物公司,动物许可证号:SCXK2013-0002。
1.2 试药与仪器 茵陈蒿汤,组方:茵陈、大黄、栀子,3味药物按2∶2∶1的配比制备为质量浓度0.6 g/mL的中药汤剂。药材购自同仁堂健康药业公司。自制高脂饲料(普通大鼠专用饲料83.25%,猪油10%,糖5%,胆固醇1.5%,脱氧胆酸钠0.2%,丙硫氧嘧啶0.05%),屈臣氏蒸馏水,购自屈臣氏专卖店。主要试剂:三酰甘油(TAG)试剂盒(100 mL/盒,F001),低密度脂蛋白胆固醇(LDL-C)试剂盒(80 mL/盒,F004),高密度脂蛋白胆固醇 (HDL-C)试剂盒 (80 mL/盒,F003-1),胆固醇(CH)试剂盒(80 mL/盒,F002),丙硫氧嘧啶(批号:20080304),脱氧胆酸钠(批号:20160311)均购自南京建成生物制品研究所。主要仪器:电热恒温DKZ-2型恒温水浴振荡水槽、DHG-9123A型电热恒温干燥箱(上海精宏试验设备有限公司出品),WK-600A高速药物研磨机(青州市精诚机械公司出品)1-15K型微量冷冻离心机、2-16K冷冻离心机 (Sigma公司出品),ULT1386-3-V39超低温(-80℃)冰箱)(美国 Thermo Scientific Revco公司出品),M2多功能酶标仪 (美国Molecular Devices公司出品),AL104电子天平 (梅特勒-托利多仪器(上海)有限公司出品),QT-2漩涡混合仪(上海琪特分析仪器公司出品),SP-400大容量生化培育箱(南昌新长征医疗科技公司出品)。
1.3 分组与造模 采用随机数字表法将大鼠分为空白对照组、模型组、阴性对照组和中药组各10只,饲养于18~25℃、40%~50%相对湿度条件下的专用喂养室,自然光照,每日上午加水,更换垫料。空白对照组给予正常大鼠专用饲料喂养,每日7~10 g,期间自由饮食、活动。模型组、阴性对照组与中药组高脂饲料喂养,每日3次,每日7~10 g,限制活动,连续喂养 4周,期间保持喂养室内清洁,仔细观察全部大鼠的健康状态,保证大鼠健康。建模后尾静脉血样3 mL,离心分离得血清,检测血脂指标(TAG、LDL-C、HDL-C、CH),炎性因子[肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)],相关指标[补体 3(C3)、补体 5(C5)、酚化刺激蛋白(ASP)、游离脂肪酸(FFA)]。 大鼠取血后妥善包扎,防止感染。以建模后TG、LDL-C、CH均高于空白对照组为建模成功[7]。
1.4 给药方法 造模成功后,中药组改用正常专用饲料喂养,同时按1 mL/100 g鼠体质量 (生药质量0.6 g/mL)给予茵陈蒿汤灌胃[8]。阴性对照组改用正常专用饲料喂养,给予等剂量蒸馏水灌胃;模型组持续高脂饲料喂养,限制运动量,不予任何干预,正常自由饮水,不给予任何液体灌胃。每日1次,持续5周。
1.5 标本采集与检测 末次给药结束后,模型组、阴性对照组、中药组再次取血检测上述各项指标进行组间对比。以空白对照组与模型组、阴性对照组、中药组建模后检测数据为基础分析血脂指标与相关指标间的相关性,分析脂代谢紊乱与炎性因子、相关指标间的相关性。
1.6 统计学处理 应用SPSS22.0统计软件。计量资料以(±s)表示,其中多组计量资料采取单因素方差分析,两两对比采取LSD(L)检验;非连续变量相关性采取Spearman检验,连续变量相关性采取Pearson检验;校验水准α=0.05。P<0.05为差异有统计学意义。
2 结 果
2.1 各组血脂指标比较 见表1。建模后治疗前空白对照组、模型组、阴性对照组、中药组各组间TAG、LDL-C、CH、HDL-C水平差异具有统计学意义 (P<0.05);空白对照组大鼠血清TAG、LDL-C、CH表达水平均低于其他3组,HDL-C高于其他3组 (P<0.05),模型组、阴性对照组、中药组3组间TAG、LDL-C、CH、HDL-C均无统计学差异(P>0.05)。治疗后模型组、阴性对照组、中药组 3组间 TAG、LDL-C、CH、HDL-C 水平差异均具有统计学意义 (P<0.05);中药组HDL-C高于模型组、阴性对照组,中药组TAG、LDL-C、CH均低于模型组、阴性对照组(P<0.05),阴性对照组TAG及CH低于模型组、HDL-C高于模型组 (P<0.05),模型组与阴性对照组LDL-C水平差异无统计学意义(P>0.05)。
表1 各组血脂指标比较(mg/dL,±s)

表1 各组血脂指标比较(mg/dL,±s)
与空白对照组治疗前比较,*P<0.05;与模型组治疗后比较,☆P<0.05;与阴性对照组比较,★P<0.05。 下同
组别 时间空白对照组 治疗前TAG LDL-C HDL-C CH 51.92±4.58 2.51±1.08 1.29±0.04 1.89±0.23(n=10) 治疗后 - - - -模型组 治疗前 66.99±4.46* 10.97±1.09* 0.61±0.04* 10.74±0.66*(n=10) 治疗后 73.11±2.18 11.44±1.71 0.51±0.02 11.5±1.08阴性对照组 治疗前 66.89±5.08* 10.82±1.05* 0.61±0.05* 10.7±0.64*(n=10) 治疗后 65.78±0.02☆ 10.63±0.01 0.69±0.02☆ 10.24±0.01☆中药组 治疗前 66.97±4.95* 10.82±1.12* 0.61±0.06* 10.71±0.66*(n=10) 治疗后 52.73±6.23☆★ 6.19±0.89☆★ 0.87±0.05☆★ 6.97±0.26☆★
2.2 各组炎性因子水平比较 见表2。治疗前空白对照组、模型组、阴性对照组、中药组四组间TNF-α、IL-6表达水平差异具有统计学意义(P<0.05);空白对照组大鼠血清TNF-α、IL-6表达水平低于其他3组(P<0.05),模型组、阴性对照组、中药组组间 TNF-α、IL-6差异均无统计学意义(P>0.05)。治疗后模型组、阴性对照组、中药组组间大鼠血清TNF-α、IL-6表达水平差异具有统计学意义(P<0.05);经两两比较验证,中药组TNF-α、IL-6表达水平低于模型组、阴性对照组(P<0.05),模型组与阴性对照组差异无统计学意义(P>0.05)。
表2 各组炎性因子水平比较(ng/L,±s)
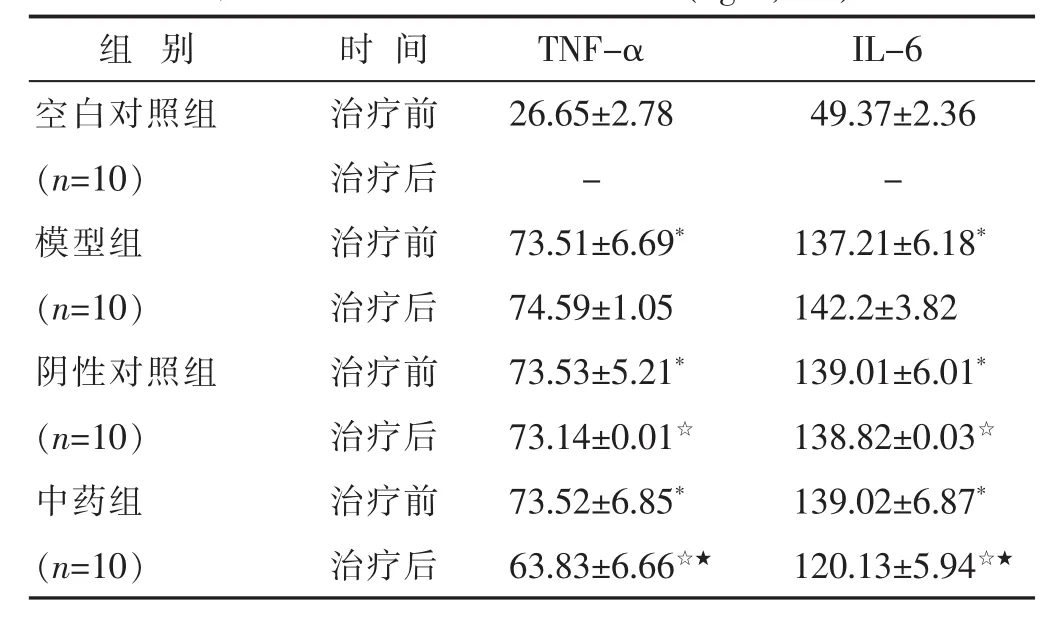
表2 各组炎性因子水平比较(ng/L,±s)
组 别 时间空白对照组 治疗前TNF-α IL-6 26.65±2.78 49.37±2.36(n=10) 治疗后 - -模型组 治疗前 73.51±6.69* 137.21±6.18*(n=10) 治疗后 74.59±1.05 142.2±3.82阴性对照组 治疗前 73.53±5.21* 139.01±6.01*(n=10) 治疗后 73.14±0.01☆ 138.82±0.03☆中药组 治疗前 73.52±6.85* 139.02±6.87*(n=10) 治疗后 63.83±6.66☆★ 120.13±5.94☆★
2.3 各组 C3、C5、ASP、FFA表达水平比较 见表 3。治疗前空白对照组、模型组、阴性对照组、中药组组间C3、C5、ASP、FFA表达水平差异具有统计学意义 (P<0.05); 空白对照组大鼠 C3、C5、ASP、FFA 表达水平低于其他3组(P<0.05),模型组、阴性对照组、中药组组间 C3、C5、ASP、FFA 差异均无统计学意义 (P>0.05)。治疗后模型组、阴性对照组、中药组组间C3、C5、ASP、FFA表达水平差异均具有统计学意义(P<0.05);经两两比较验证,中药组 C3、C5、ASP、FFA 低于模型组、阴性对照组(P<0.05),阴性对照组C3低于模型组(P<0.05),模型组与阴性对照组C5、ASP、FFA差异无统计学意义(P>0.05)。
表 3 各组 C3、C5、ASP、FFA 表达水平比较(±s)

表 3 各组 C3、C5、ASP、FFA 表达水平比较(±s)
组 别 时间空白对照组 治疗前C3(g/L) C5(mg/L) ASP(nmol/L) FFA(mol/L)0.36±0.14 50.12±2.67 25.87±2.69 213.76±17.84(n=10) 治疗后 - - - -模型组 治疗前 1.87±0.17* 85.31±6.07* 45.96±2.8* 508.87±37.47*(n=10) 治疗后 1.99±0.05 85.98±0.05 46.43±0.02 510.59±0.02阴性对照组 治疗前 1.86±0.17* 85.31±6.61* 45.89±2.46* 508.17±36.42*(n=10) 治疗后 1.69±0.02☆ 85.09±0.02 45.16±0.02 507.89±0.03中药组 治疗前 1.87±0.2* 85.37±6.93* 45.96±2.55* 508.24±42.97*(n=10) 治疗后 0.98±0.17☆★ 69.22±6.24☆★ 34.72±2.07☆★ 459.81±39.39☆★
2.4 血脂指标与 C3、C5、ASP、FFA相关性 见表 4。TAG、LDL-C、CH 与 C3、C5、ASP、FFA 间均具有高度正相关性(0.8 表4 血脂指标与相关指标相关性分析统计值表(r/p) 2.5 脂代谢紊乱与炎性因子、C3、C5、ASP、FFA 相关性 见表5。脂代谢紊乱与炎性因子、相关指标间均具有中度正相关性(0.8 表5 脂代谢紊乱与炎性因子、相关指标相关性分析统计值表 脂代谢紊乱的形成机制较为复杂,通常认为与饮食结构、生活习惯、遗传因素等多种因素有关。脂代谢紊乱可诱发多种相关疾病,主要可见高脂血症、脂肪肝、糖尿病等。尽早调节脂肪代谢可有效预防或延缓高脂血症、脂肪肝、糖尿病等继发疾病的发生[9]。脂代谢紊乱的主要发病机制为:外周脂肪增多,诱导FFA的入肝量显著上升,提高了TAG的合成功能;HDL-C的分泌与合成降低导致LDL-C的分泌升高,CH的含量明显上升,从而导致转运出肝的TAG量显著减少,最终形成脂代谢紊乱的病理演进过程。FFA的异常升高可为脂质的过氧化性反应提供充足的反应基质。C3、C5在脂代谢紊乱及相关疾病患者中均可见显著升高。有研究表明C3、C5与脂代谢紊乱及非酒精性脂肪肝的形成具有密切关系[10-12]。脂代谢紊乱导致血脂水平显著上升,TAG、LDL-C等升高可致使CH转动受限,从而均可诱发血管内皮损伤,导致心脑血管意外发生。TNF-α、IL-6作为重要的炎性因子在这一病变过程中发挥着关键性的促进作用。本次研究结果表明,模型组大鼠血清中的LDL-C、TAG、CH等含量异常上升而HDL-C的含量明显下降,说明高脂饮食能够有效诱导脂代谢紊乱形成及演进。 中医学认为脂代谢紊乱属于痰湿雍盛之证。主要诱因为过食厚味、肥甘,久之导致脾失运化、聚湿生痰,或遇情志失调致使气滞血瘀、肝郁痰凝、燥热纠结而成疾病。经方茵陈蒿汤以茵陈为君,可有效清肝利胆;以栀子为臣可清三焦之热,引热下行经小便排出体外;佐以大黄起到逐瘀活血,荡涤胃肠、通便清热之功[13-17]。三药共用,能够起到清热降燥、活血化瘀、疏肝利胆,引热下行之功。本次研究中我们对模型组大鼠给予茵陈蒿汤治疗,结果表明灌喂茵陈蒿汤后中药组大鼠血清中的TAG、LDL-C、CH含量均可见明显下降,同时HDL-C的含量明显上升,均优于模型组与阳性药物组;证明茵陈蒿汤能够有效调节脂代谢紊乱大鼠的血脂水平。同时灌胃茵陈蒿汤后中药组大鼠血清中的炎性因子TNF-α、IL-6的表达水平显著降低;相关因子C3、C5、ASP、FFA的表达水平均可见明显改善,均优于模型组与阳性药物组。通过相关性分析证明,TNF-α、IL-6、C3、C5、ASP、FFA 的表达水平均与脂代谢紊乱发生具有正相关性,因此可知 TNF-α、IL-6、C3、C5、ASP、FFA的异常升高提示脂代谢紊乱的发生。本次研究中我们对血脂指标与C3、C5、ASP、FFA的表达水平进行了相关性分析,结果血脂指标与C3、C5、ASP、FFA的表达水平间具有明确的相关性,提示血脂水平越高C3、C5、ASP、FFA的表达也可出现明显升高,脂代谢紊乱相关疾病的发生风险也明显升高。因此,笔者认为茵陈蒿汤能够有效改善脂代谢紊乱大鼠的血脂水平、炎性状态并由此降低高脂血症、脂肪肝等相关疾病发生的概率。 综上所述,茵陈蒿汤对于脂代谢紊乱大鼠的血脂指标、炎性因子以及相关指标均具有明确的改善作用,因此可有效预防或延缓脂代谢紊乱相关疾病的发生。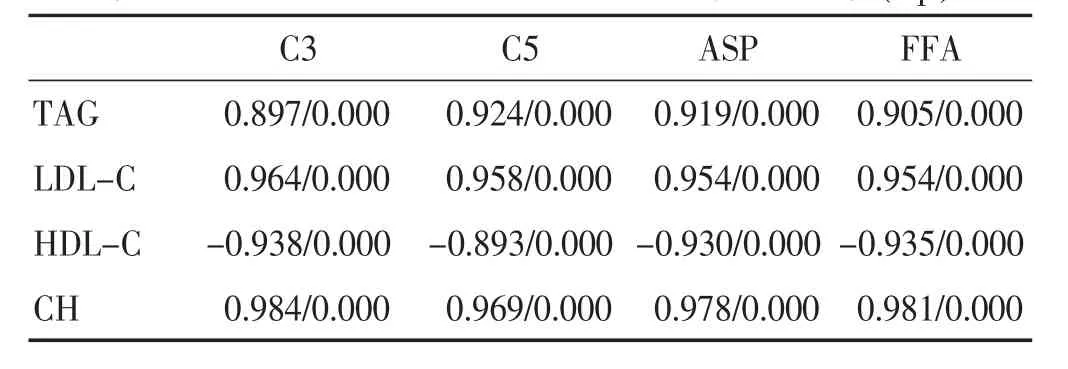

3 讨 论
