玉米细胞核雄性不育突变体K305ms的生理生化分析
2018-08-24石海春余学杰赵长云柯永培
汪 燕,石海春,余学杰,赵长云,柯永培,*
(1.四川农业大学 农学院,四川 成都 611130; 2.贵州师范大学 植物遗传育种研究所 荞麦产业技术研究中心,贵州 贵阳 550001; 3.四川农大正红生物技术有限责任公司,四川 成都 610213)
利用辐射诱变创制突变体库是解析植物基因功能的有效手段之一。目前,利用60Co-γ射线在植物中已经选育出大量不同类型的突变体,如早熟、矮秆、抗倒伏、抗病、高蛋白和高油脂含量、雄性不育等有实用价值的突变体[1-2];其中,雄性不育突变体在杂种优势利用、植株生殖发育与遗传特性研究中具有重要意义。本课题组前期利用60Co-γ射线诱变筛选得到1个玉米雄性不育突变体K305malesterility(K305ms),该突变体不育性状表现稳定,花粉败育彻底,在花粉母细胞时期不育花粉外形开始表现异常,至小孢子时期单核小孢子完全皱缩,停止发育,直至分解[3];该性状受单个隐性核基因控制[4];不育植株在农艺性状及其配合力和产量方面与同群体内的可育株K305 fertility(K305F)无明显差异[5]。本试验通过对K305ms与K305F生理代谢等指标进行比较研究,以期明确K305ms花粉败育过程中的物质代谢和抗氧化代谢的特点,为后续研究与利用提供参考。
1 材料与方法
1.1 试验材料
以玉米雄性不育突变体K305ms为母本,与同群体内可育植株K305F进行姊妹交,以该姊妹交群体为试验材料,实验材料均由四川农大正红生物技术有限责任公司提供。2012年4月,将来源于同一个果穗的K305ms姊妹交群体种植于四川省成都市双流县基地,共378颗种子,直播不间苗,田间进行精细管理,幼苗期对每个单株挂牌并统计存活株数。最终存活358株,用于本试验中物质含量和酶活性的测定。
1.2 试验方法
玉米抽雄穗前将植株进行单株标记。根据植株外形特征和雄穗的大小,分别取花粉母细胞时期(Ⅰ)、四分体时期(Ⅱ)、小孢子时期(Ⅲ)和成熟时期(Ⅳ)的花药,每次仅选取雄穗的中部小穗,避免伤害其余部分小穗,让其继续生长至成熟期,田间鉴定该植株的雄花育性。将所取雄花的颖壳和花药分离,并对首尾两端的花药进行显微观察以确定所在的时期。若小穗首尾两端花药发育阶段均相同,则视为发育时期一致。将3~5穗同一发育时期的花药和颖壳分别混合收集于离心管中,储存于-80 ℃冰箱,供物质含量与代谢酶活性的测定。
采用考马斯亮蓝法测定可溶性蛋白含量[6];茚三酮显色法测定游离脯氨酸含量;超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT))和过氧化物酶(peroxidase,POD)活性的测定参照张宪政等[7]的方法。SOD活性以每min每g鲜质量样品抑制氮蓝四唑(NBT)光化还原的50%为1个酶活性单位(U)。CAT活性以每min每g样品催化消耗每mg H2O2为1个活性单位(U)。POD活性以连续5 min内每min每g鲜质量样品的吸光度值增加1为1个活性单位(U)。
1.3 数据处理
使用Excel 2003对实验数据进行整理,使用SPSS 16.0软件包中t-test法对K305ms与K305F相应的数据进行差异显著性分析。
2 结果与分析
2.1 玉米K305ms雄花的可溶性蛋白含量
可溶性蛋白对于花药的发育至关重要。由图1可知,在花药发育过程中,K305ms和K305F花药和颖壳可溶性蛋白含量的变化趋势一致,均先增加后降低,但K305ms花药和颖壳可溶性蛋白含量均低于相应时期的K305F。花药处于四分体时期时,K305ms和K305F花药可溶性蛋白含量均为最高,达到顶峰,而K305ms和K305F颖壳可溶性蛋白含量顶峰时期则在小孢子时期。除小孢子时期外,其余3个时期K305ms花药可溶性蛋白质含量均极显著低于K305F;K305ms颖壳中可溶性蛋白质含量除成熟期以外,其余时期均显著低于K305F。
2.2 玉米K305ms雄花的游离脯氨酸含量
游离脯氨酸不仅是重要的渗透代谢物质,还是花粉萌发和花粉管生长所必需的能源物质。由图2可知,随着花药的发育,K305ms花药和颖壳游离脯氨酸含量的变化均呈逐渐降低的趋势,在成熟期降到最低值;而K305F花药和颖壳游离脯氨酸含量却呈现出相反的趋势,即随着花药的生长逐渐升高,在成熟期达到最高值。除此以外,从花药花粉母细胞期到成熟期的4个阶段,K305ms花药和颖壳的游离脯氨酸含量均明显低于相应时期的K305F。其中,K305ms花药中游离脯氨酸含量在4个时期均极显著低于K305F,其成熟期的游离脯氨酸含量仅为K305F的1.5%;相应地,除花粉母细胞时期外,其余3个时期K305ms颖壳游离脯氨酸含量均显著或极显著低于K305F,在成熟期时,K305ms颖壳脯氨酸含量仅为K305F的8.8%。
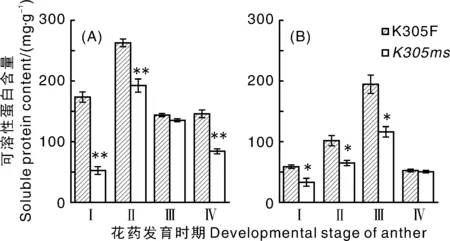
数值代表3次重复的平均值±SE;星号代表使用t-test方法统计在0.05(*)和0.01(**)水平下K305ms和K305F之间差异达到显著水平。Ⅰ,花粉母细胞时期;Ⅱ,四分体时期;Ⅲ,小孢子时期;Ⅳ,成熟期。下同。Values are the means of 3 samples ±SE. Asterisks indicate statistically significant difference at 0.05 (*) and 0.01 (**) levels between K305ms and K305F using t-test. Ⅰ, Pollen mother cell stage; Ⅱ, Tetrad stage; Ⅲ, Microspore stage; Ⅳ, maturity. The same as below.图1 花药发育过程中K305ms和K305F植株花药(A)与颖壳(B)中可溶性蛋白含量Fig.1 Soluble protein content in anther (A) and glume(B) of K305ms and K305F plants during anther development

图2 花药发育过程中K305ms和K305F植株花药(A)与颖壳(B)中游离脯氨酸含量Fig.2 Free proline content in anther (A) and glume (B) of K305ms and K305F plants during anther development
2.3 玉米K305ms雄花的抗氧化酶活性
2.3.1 SOD活性
2.3.2 CAT活性
植物CAT是一种重要的保护性酶,可将H2O2降解成水和氧气,清除其对细胞的毒害。由图4可知,在花药发育过程中,K305ms花药的CAT活性均显著或极显著低于K305F,且呈现逐渐下降趋势。但是在花药发育前期,K305ms颖壳的CAT活性高于K305F,且在花粉母细胞时期显著高于K305F;随着花粉发育至中后期,K305ms颖壳的CAT活性低于K305F,但未达到显著差异。

图3 花药发育过程中K305ms和K305F植株花药(A)与颖壳(B)中SOD活性Fig.3 Superoxide dismutase (SOD) activity in anther (A) and glume (B) of K305ms and K305F plants during anther development
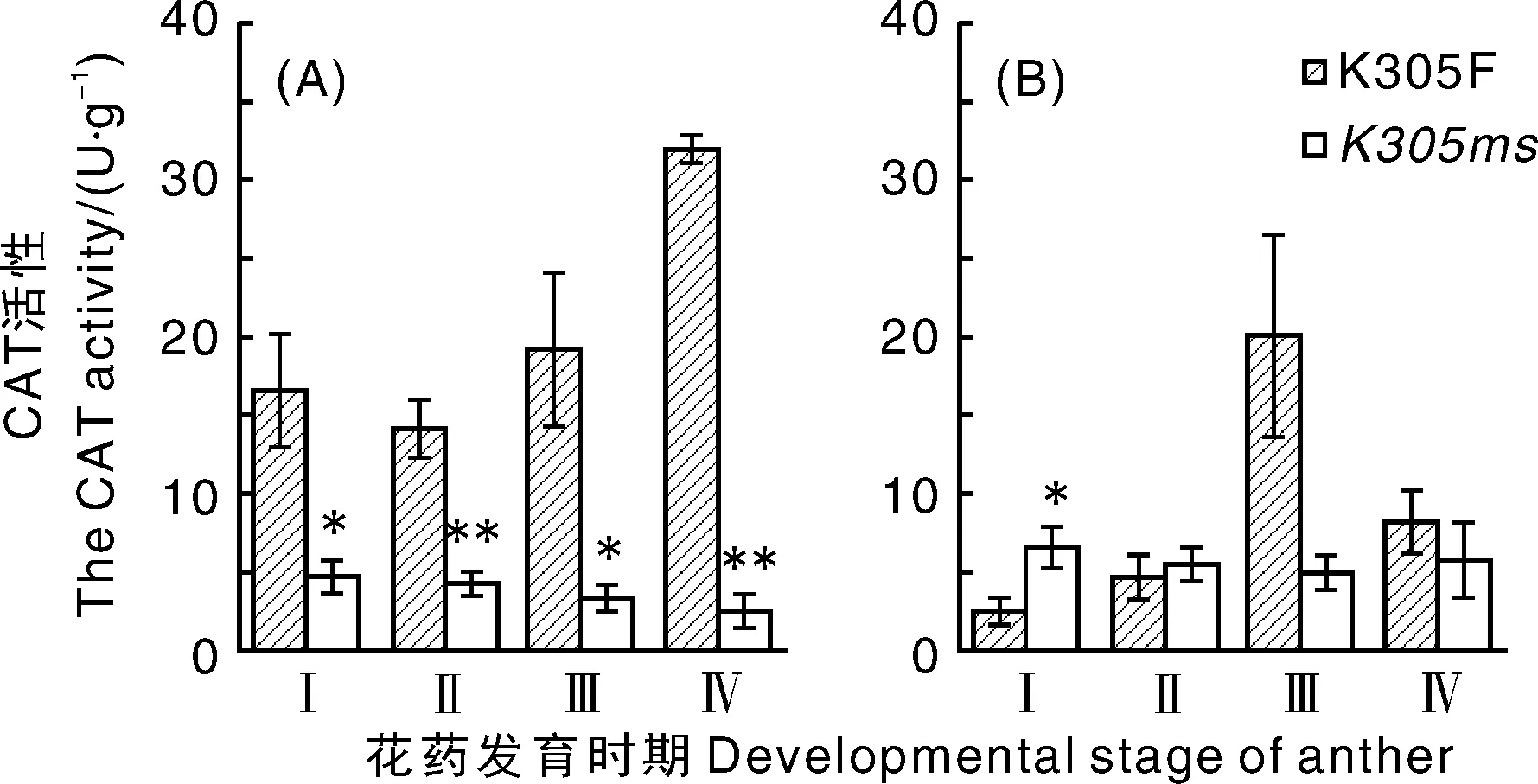
图4 花药发育过程中K305ms和K305F植株花药(A)与颖壳(B)中CAT活性Fig.4 Catalase (CAT) activity in anther (A) and glume (B) of K305ms and K305F plants during anther development
2.3.3 POD活性
植物POD可有效清除H2O2对细胞的毒害,还具有氧化分解花药中植物生长素IAA的作用。从图5可知,花药发育过程中,K305ms花药POD活性均显著或极显著高于K305F;且其POD活性表现出逐渐上升的趋势,而K305F花药POD活性则相反,呈现逐渐下降的趋势;成熟期K305ms花药POD活性达到最高,为K305F的28.6倍。K305ms颖壳的POD活性也均明显高于K305F,且在花药发育前2个时期,差异达到极显著水平。

图5 花药发育过程中K305ms和K305F植株花药(A)与颖壳(B)中POD活性Fig.5 Peroxidase (POD) activity in anther (A) and glume (B) of K305ms and K305F plants at anther developmental stage
3 讨论
3.1 玉米细胞核雄性不育的代谢物质基础
可溶性蛋白质在花药发育过程中起着至关重要的作用,其含有众多的代谢酶和活性成分,参与花药的代谢和发育过程。前人研究表明,任何干扰蛋白质合成、代谢、分解的基因发生突变,都有可能导致雄性不育现象发生[8]。花药发育过程中,不育株花药中可溶性蛋白质含量明显低于可育株,在花粉母细胞时期、四分体和成熟期这3个时期均达到极显著差异。不仅如此,不育株颖壳中的可溶性蛋白质含量也明显低于可育株,其中3个时期达到显著差异。说明60Co-γ辐射引起的目标基因突变,导致了玉米雄花发育过程中蛋白质合成和代谢出现明显异常。
植物生殖生长期,花粉中会积累大量的游离脯氨酸,一些作物中游离脯氨酸含量高达花粉干质量的1.6%[9]。游离脯氨酸是花粉代谢活动中一个非常活跃的化合物,可提供花粉萌发和花粉管伸长所必需的能量、碳骨架[10-11]。Chiang等[12]研究发现拟南芥小花中游离脯氨酸含量占总游离氨基酸含量的17%~26%,叶片与根中却仅占1%~3%。Schwacke等[13]发现番茄花的游离脯氨酸含量是其他组织的60倍。本研究发现,随着花药的发育,可育花药中游离脯氨酸含量呈现急剧增加的趋势,说明游离脯氨酸的积累与生殖生长密切相关,这与前人的研究结果一致[12-14]。邹佳等[8]发现玉米细胞质雄性不育小花中脯氨酸含量显著低于其恢复系。除此以外,在甜椒[15]、胡萝卜[16]、辣椒[17]、小麦[18]、番茄[19]中均发现雄性不育花药内游离脯氨酸含量低于可育株。本研究发现,不育花药中游离脯氨酸含量从花粉母细胞时期到成熟时期均极显著低于可育株,尤其是在成熟期,其游离脯氨酸含量仅为可育株的1.5%;同样,不育株颖壳中游离脯氨酸含量在花粉发育过程中也显著低于可育株,在成熟期其游离脯氨酸含量仅为可育株的8.8%。说明玉米生殖生长过程中,不育株目标基因突变导致雄花游离脯氨酸无法正常积累,脯氨酸代谢出现紊乱。植物生殖生长期间,特别是花粉发育和胚胎形成期,生殖细胞会经历一个自发的脱水过程,脱水可造成对细胞的渗透胁迫[20]。但植物体内的脯氨酸,作为一种重要的渗透相容性物质,其大量积累有助于生殖器官的渗透调节[11, 21]。本研究发现不育花药游离脯氨酸在花药发育过程中不仅没有逐渐积累,反而逐渐降解,这种趋势同样存在于不育株颖壳中。花药发育过程中游离脯氨酸的含量仅维持在0.11~0.14 mg·g-1,远低于可育花药中的游离脯氨酸含量。说明玉米生殖生长过程中,不育植株目标基因突变导致花药中游离脯氨酸含量降低,花药遭受渗透胁迫危害。
3.2 玉米细胞核雄性不育与抗氧化酶活性代谢的关系
植物活性氧清除酶系统(ROS),如SOD[22]、POD[23]和CAT[24]等可有效阻止高浓度氧的积累,防止膜脂的过氧化,维持植物的正常生长发育[23, 25]。现有的研究发现这些酶的活性与植物雄性不育现象相关。有研究认为不育株ROS系统活性会降低,导致植株体内活性氧水平升高,进而造成膜脂过氧化[26];不过,在对榨菜、花椰菜和王百合等植物的研究中发现,不育株ROS系统活性明显高于可育株,其体内活性氧含量超量积累,认为ROS系统活性的升高正是对自身活性氧升高的一种保护应激反应[27-29]。
张子学等[30]研究发现,辣椒不育系花药的SOD活性与可育系差异不显著;而张建奎等[31]研究发现,小麦不育系花药中SOD活性却明显低于可育系。本研究结果显示,花药发育过程中,玉米不育花药中SOD活性明显低于可育株,且在花粉母细胞期、四分体期和成熟期达到显著或极显著差异,说明不育植株目标基因突变导致植株花药中渗透调节出现异常。不过,K305ms不育花药POD活性与CAT活性的变化趋势相反。不育花药POD活性随着发育进程呈现逐渐上升的趋势,在花药成熟期达到可育株的28.6倍;而不育花药CAT活性随着花药发育呈现不断下降的趋势,在花药成熟期仅为可育株的8.2%。这一趋势与小麦雄性不育系花药POD和CAT活性变化趋势一致[32]。前人研究发现,不育花药CAT酶活性过低则不能有效地清除超氧自由基,导致H2O2大量积累,进而造成膜脂过氧化,花粉败育[26]。因此,推测不育株中目标基因突变导致的植株花药中CAT活性降低,可能造成超氧自由基过量积累,进而损害花药的正常发育。植物中POD对于花药的发育具有至关重要的作用[33]。POD作为保护性酶,不仅能清除H2O2对细胞的毒害,还可分解花药中的生长激素IAA。研究表明,植物生殖生长期,花蕾中POD活性与体内IAA含量呈负相关,即POD活性升高会导致IAA含量降低,最终造成花粉败育[33]。本研究发现,玉米花药发育过程中,不育花药的POD活性明显高于可育株,随着花药发育进程呈急剧升高的趋势。因此,认为不育植株目标基因突变导致POD活性提高,可能会加速对花药中IAA的分解,造成花药中IAA不足,从而影响其正常发育。
