玉米高无机磷突变体的选育和特性研究
2018-08-24徐秀红吕桂华郭国锦陈坚剑
徐秀红,吕桂华,郭国锦,陈坚剑
(1.贵州大学 烟草学院/贵州省烟草品质研究重点实验室,贵州 贵阳 550025; 2.浙江省东阳玉米研究所,浙江 东阳 322100)
植酸,又称肌醇六磷酸,是自然界作物种子中含磷最丰富的化合物,占种子总磷含量的65%~85%和酸溶性肌醇磷酸盐的90%以上[1],是玉米籽粒中广泛存在的一种有机酸(肌醇六磷酸)。植酸被认为是一种抗营养因子,它易与玉米种子中微量金属元素螯合成植酸盐,人和非反刍动物(缺乏植酸酶)难以消化吸收利用这些植酸盐,从而降低了Zn2+、Fe3+、Ca2+等微量金属元素的生物有效性[2]。而不可利用的植酸盐被排泄到环境中,会造成严重的环境污染,特别是水体富营养化。因此,解决和改善这些问题迫在眉睫,而降低玉米种子的植酸含量是有效途径之一[3]。
理化诱变技术是降低玉米种子植酸含量有效可行的途径,通过该技术研究人员在水稻、大麦、小麦、大豆、玉米等作物上获得了大量的低植酸突变体,植酸含量下降的程度在30%-93%,同时还伴随着无机磷含量的显著增加[4]。玉米低植酸突变体最早是由Raboy等[5]采用化学诱变剂EMS对玉米花粉进行诱变获得的,其育成了两份低植酸含量的玉米突变体lpa1-1和lpa2-1。国内的低植酸玉米研究起步较晚,一些玉米突变体陆续被筛选出,但对突变体及野生型亲本的生化特性和农艺性状研究鲜有报道。本研究主要采用60Coγ射线对玉米自交系种子进行辐射诱变,经过几代的选择、鉴定获得了2份低植酸突变体,并开展了突变体的遗传控制类型、生化特性和农艺性状等初步研究工作,以期为低植酸玉米新品种选育奠定坚实的材料基础。
1 材料与方法
1.1 玉米低植酸突变体材料的选育
于2014年选取玉米自交系Zhong为材料,均种植于浙江省东阳玉米研究所试验田内。利用60Coγ射线对玉米的种子进行辐射诱变,处理剂量为250 Gy,处理地点为浙江大学原子核农业利用研究所的辐照中心。M0种子(辐照后)按单株种植,套袋自交获得种子混收;M1植株自交所结种子(记为M1∶2,以下类推)混收,M2按单株种植,自交后所得种子M2∶3则按单株收获。每株取8粒M2∶3种子,按Xu等[6]方法检测无机磷含量,选取显色为高无机磷(high inorganic phosphorus, HIP)突变种子,将该单株剩余的种子种成株行,成熟后单株收获种子,继续检测HIP籽粒的分离情况,直至获得纯合HIP突变株系。
1.2 高无机磷(HIP)种子检测
以Larson等[7]的方法为基础进行改进。从收获的玉米种子中,每份种子选取16粒成熟饱满的,用剪刀从种子中间剪半或1/3,置于96孔深孔板中,然后按每毫克样品质量10 μL加入提取液0.4 mol·L-1HCl,一般为200 μL,用板盖盖紧,4 ℃条件下放置过夜。次日,从深孔板中用8管排枪吸取10 μL浸提液于96孔酶标板中,加入90 μL蒸馏水;在酶标板上设置5个用KH2PO3配制的标准P溶液,含P量分别为0 μg·mg-1(Ⅰ)、0.155 μg·mg-1(Ⅱ)、0.465 μg·mg-1(Ⅲ)、0.93 μg·mg-1(Ⅳ)和1.395 μg·mg-1(Ⅴ),溶液体积为100 μL。
在样品浸提液和标准P溶液中加100 μL显色剂,室温下静置0.5~1.0 h显色。其中,显色剂由3 mol·L-1H2SO4、2.5%钼酸铵、10%抗坏血酸(贮于4 ℃)和蒸馏水按体积比1∶1∶1∶2配制而成,加入顺序为蒸馏水、3 mol·L-1H2SO4、2.5%钼酸铵、10%抗坏血酸,现用现配。标准P溶液显色后分别呈浅黄色/无色、微蓝色、浅蓝色、蓝色和深蓝色。显色在标准P溶液(Ⅲ)以上(含P量>0.465 μg·mg-1)的种子样本,可判定为高无机磷(HIP)种子,用于下一步的研究与分析。每份材料测16粒种子,检测材料是否纯合。
1.3 突变的等位性测验及遗传控制类型材料准备
1.3.1 等位性测验
2016年秋,对种植的高无机磷突变体lpa-zhong1和lpa-zhong2进行互交,对收获的F1种子进行无机磷(HIP)含量检测,判断其等位性。
1.3.2 遗传控制类型研究材料
2016年秋,配制了以下杂交组合郑58×lpa-zhong1、郑58×lpa-zhong2、昌7-2 ×lpa-zhong1和昌7-2×lpa-zhong2。分离群体为F1植株自交产生的后代F2∶3的遗传群体。对F1和F2种子进行无机磷含量检测,判断其显色类型。
1.4 种子发芽率的测定
选取收获的亲本自交系Zhong和两个低植酸突变体lpa-zhong1、lpa-zhong2发育良好、形态完整自然风干的种子50粒,采用沙床法进行种子发芽率的测定,加入适量的水,置于25 ℃的人工智能培养箱中,3次重复,记录种子萌发后种子的发芽粒数,以百分率计算;田间成苗率则是选取各材料饱满完整自然风干的种子50粒,于田间覆土萌发,记载在田间试验条件下存活的植株数。
1.5 各磷组分含量和微量金属元素含量的定量分析
1.5.1 总磷(TP)和金属元素含量的测定
样品处理:取100 g成熟自然风干的亲本Zhong和lpa-zhong1、lpa-zhong2的种子,去杂选净后,放置于真空干燥箱中60 ℃真空干燥72 h,后经旋风粉碎机粉碎,过60目网筛,用自封袋装好后置于干燥器中,低温干燥保存。用于测定总磷、无机磷、植酸磷和金属元素含量。
总磷含量的测定:种子总磷含量的测定参考Hansen等[8]的方法。每个样品取约100 mg加入到微波消解管中,然后每管加入6 mL 65% HNO3和0.2 mL H2O2。采用Microwave3000(Anton PAAR,Graz,Austria)微波消解系统进行样品消化;消解结束后将微波消煮管盖打开,置于赶酸器中160 ℃排酸后加去离子水定容至20 mL。消化后的样品采用电感耦合等离子体发射光谱仪(ICP-OES) (Optima 8000DV,PerkinElmer,USA)测定磷含量。每个样品重复3次。
金属元素含量测定:种子金属元素提取同样采用微波消解消煮法,但每个样品增加至约500 mg;元素含量的测定采用电感耦合等离子体发射光谱仪(ICP-OES) (Optima 8000DV,PerkinElmer,USA)。
1.5.2 无机磷(Pi)含量的测定
P标准液的制备和工作曲线的绘制:将KH2PO3用锡箔纸包好,置于烘箱中105 ℃干燥1 h,放置于干燥器中冷却。准确称取0.219 5 g溶解于水,移入1 L容量瓶中,加硝酸3 mL,用蒸馏水定容,上下颠倒混匀,制备成50 μg·mL-1的P标准液。准确量取0、1.0、2.0、4.0、8.0、16.0 mL P标准液放入50 mL容量瓶,各加10 mL钒钼酸铵显色剂(含100 g·L-1钼酸铵,2.35 g·L-1钒酸铵和165 mL·L-165%硝酸),用蒸馏水稀释定容摇匀,常温下静置10 min,以0 mL溶液为对照,在400 nm下用岛津UV-2450紫外可见分光光度计测定各种P标准液的吸光值,以P含量为横坐标,吸光值为纵坐标,绘制工作曲线,得到P含量与D值的线性方程。
无机磷(Pi)含量测定。根据Wilcox等[9]所用的无机磷测定方法加以改进,取亲本和突变体样品各0.5 g,两次重复,放入50 mL离心管中,加入10 mL提取液(12.5% TCA+25 mmol·L-1MgCl2),置于恒温振荡器中,4 ℃条件下振荡过夜。将样品放于低温超速离心机中,4 ℃条件下10 000 r·min-1离心15 min,提取上清液5 mL,按钒钼酸铵显色法根据工作曲线的线性方程测定Pi的含量。
1.5.3 植酸磷(PA-P)的测定
植酸磷含量的测定方法参考Tan等[10]报道的高效离子色谱法(HPIC)。称取约300 mg玉米粉到50 mL离心管中,加入10 mL 0.6 mol·L-1HCl,混匀后置于沸水浴中孵育30 min;将样品取出冷却至室温后,10 000g4 ℃离心15 min,取450 μL上清液用去离子水稀释10倍至4.5 mL;将稀释后的样品依次经过IC-RP柱、IC-H柱、0.22 μm微孔滤膜以去除样品中的疏水性物质、碱土金属离子、碳酸根离子、过渡金属离子、大分子物质等。
制备好的样品通过离子交换色谱仪ICS-2000 (Dionex, Sunnyvale, CA, USA)检测,其中分离柱为IonPac AS11-HC (250 mm×4 mm)、保护柱为IonPac AG11-HC (50 mm×4 mm),淋洗液采用50 mmol·L-1KOH,淋洗速率为1 mL·min-1。通过电导检测仪在124 mA抑制电流下检测信号。标准样品采用植酸钠(P-3168, Sigma, St. Louis, MO, USA)。每个样品重复3次。
2 结果与分析
2.1 突变体的获得、等位性测验和突变的遗传控制类型
通过对玉米自交系Zhong进行辐照处理,经过M0、M1多代自交混收,获得M1∶2植株即M2群体,单穗收获的M2∶3种子,按单株进行高无机磷(HIP)玉米籽粒的检测。在1 860株系M2∶3种子中,检测到HIP突变体2份,其籽粒无机磷含量高于标准P的Ⅳ(0.93 μg·mg-1),并经后代种植鉴定检测,低植酸性状稳定不再分离,是稳定遗传的(图1)。自M5起,这两个突变体分别定名为lpa-zhong1和lpa-zhong2。
对高无机磷突变体lpa-zhong1和lpa-zhong2互交的F1种子进行无机磷检测,结果表明,其与突变体显色一致,说明这两个突变是等位的。
对组合郑58×lpa-zhong1、郑58×lpa-zhong2、昌7-2×lpa-zhong1和昌7-2×lpa-zhong2的F1种子进行HIP籽粒检测,结果表明,显色与野生型亲本相似,基本无色,可确定lpa突变是由隐性基因所控制。对郑58×lpa-zhong1 F2群体252个单株所结的F2∶3种子进行HIP籽粒检测,结果有183个单株表现为低Pi,69个单株表现为HIP,经卡方检测,其分离比例符合3∶1理论比,表明lpa-zhong1为单隐性基因控制类型,因lpa-zhong2与lpa-zhong1等位,即lpa-zhong2也为单隐性基因控制类型。

1A-1E和12D-12H,不同浓度的P标样(0、0.155、0.465、0.930、1.395 μg·mg-1);1F-1H和12A-12C,野生型亲本;2A-2H、3A-3H、4A-4H、5A-5H、6A-6H、7A-7H、8A-8H、9A-9H、10A-10H、11A-11H:不同单株的高无机磷突变体。Both 1A to 1E and 12D to 12H are P standards at amounts of 0, 0.155, 0.465, 0.930, 1.395μg·mg-1,respectively; 1F to 1H and 12A to 12C, wild type parent lines; 2A to 2H,3A to 3H,4A to 4H,5A to 5H,6A to 6H,7A to 7H,8A to 8H,9A to 9H,10A to 10H and 11A to 11H are homozygous for LPA.图1 高无机磷突变体与野生型亲本的种子无机磷检测Fig.1 Detection of high levels of inorganic P by molybdenum staining of hydrochloric extracts of maize grains
2.2 突变体与野生型亲本的发芽率
对不同收获季节的突变体与野生型亲本的发芽率进行测定,结果表明,与对照相比,突变体的发芽率极显著下降,田间成苗率则无显著变化。这一结果说明,两个突变均为非致死型突变,但却造成了发芽率极显著下降,而突变体的生长发育没有受到显著影响(表1)。这与Raboy等[11]、Pilu等[12]报道的玉米高无机磷突变体情况类似。
2.3 突变体与野生型亲本的磷组分含量变化
从表2的结果可以得出,与对照相比,两个突变体的无机磷含量和植酸磷含量都极显著增加,lpa-zhong1和lpa-zhong2无机磷含量分别是野生型亲本的4.7和2.8倍,植酸磷含量分别下降了40%和21%;总磷含量也一样,突变体的总磷含量都极显著高于亲本野生型。据报道,与野生型亲本对照相比,低植酸高无机磷突变体多数的总磷含量基本不变,但也有例外,少数低植酸突变体的总磷含量高于或低于野生型亲本,如Hatzack等[13]发现的大麦A型低植酸突变体,其种子总磷含量则高于野生型种子,这与我们的研究结果类似。
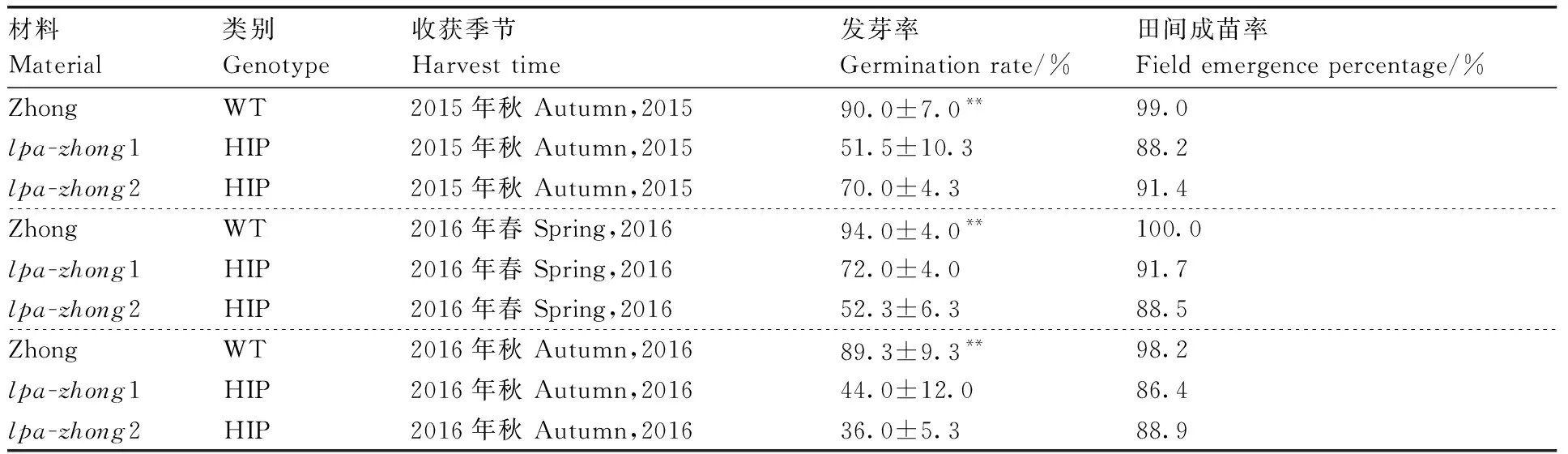
表1 不同种植时间的突变体与野生型亲本的发芽率及成苗率测定Table 1 Germination rate and field emergence rate of LPA mutant lines and wild type parent lines in different planting time
**表示突变体与野生型亲本的指标在0.01水平下差异极显著。下同。
The asterisks ** indicate that the mean value of mutants was significantly different from that of WT atP<0.01 level. The same as below.

表2 高无机磷突变体与野生型亲本的总磷、无机磷和植酸磷含量Table 2 The concentrations of various forms of P in LPA mutant lines and wild type parent lines
2.4 突变体与野生型亲本的微量金属元素含量
本研究表明,突变体与野生型亲本的微量元素含量变化无明显规律(表3)。突变体lpa-zhong2的Fe元素含量显著高于野生型,而突变体lpa-zhong1则与野生型相当;两个突变体的Zn元素含量都显著低于野生型;突变体lpa-zhong2的Na元素含量与野生型相当,而突变体lpa-zhong1则显著高于野生型亲本;两个突变体Mn、K、Ca、Mg和S元素的含量都显著低于野生型亲本。
2.5 突变体的产量性状和农艺性状
通过浙江东阳的3季种植,发现这两个突变体均能正常生长发育,同时气候环境的改变对种子的HIP表型影响较小。亲本与突变体的产量性状和农艺性状数据结果表明,与野生型亲本相比,除了百粒重略有降低之外,其他产量性状和农艺性状无显著变化(表4、表5)。
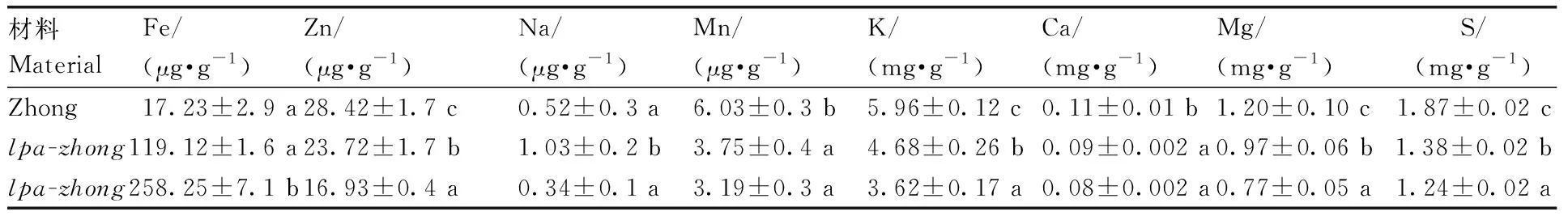
表3 突变体与野生型亲本的微量金属元素含量Table 3 Trace element contents of LPA mutant lines and wild type parent lines
同列不同行数据后没有相同小写字母表示0.05水平下差异显著。
For the mean values of the mutant lines and wild type parent lines, multiple comparisons were undertaken and the different letters indicate the significant difference atP<0.05.
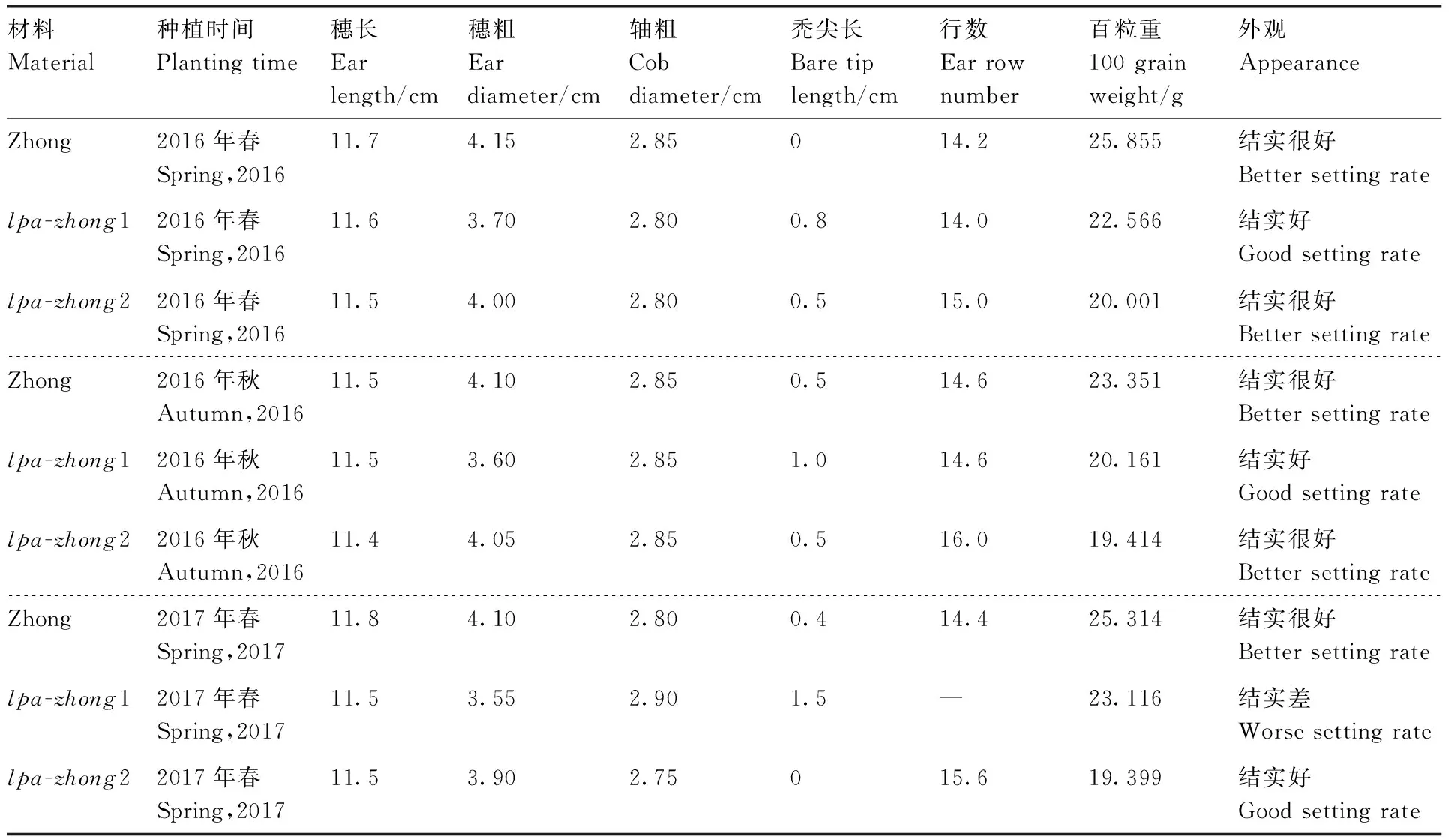
表4 不同种植时间的突变体与野生型亲本的产量性状Table 4 Yield and yield-related agronomic traits of LPA mutants and wild type parent lines in different planting time
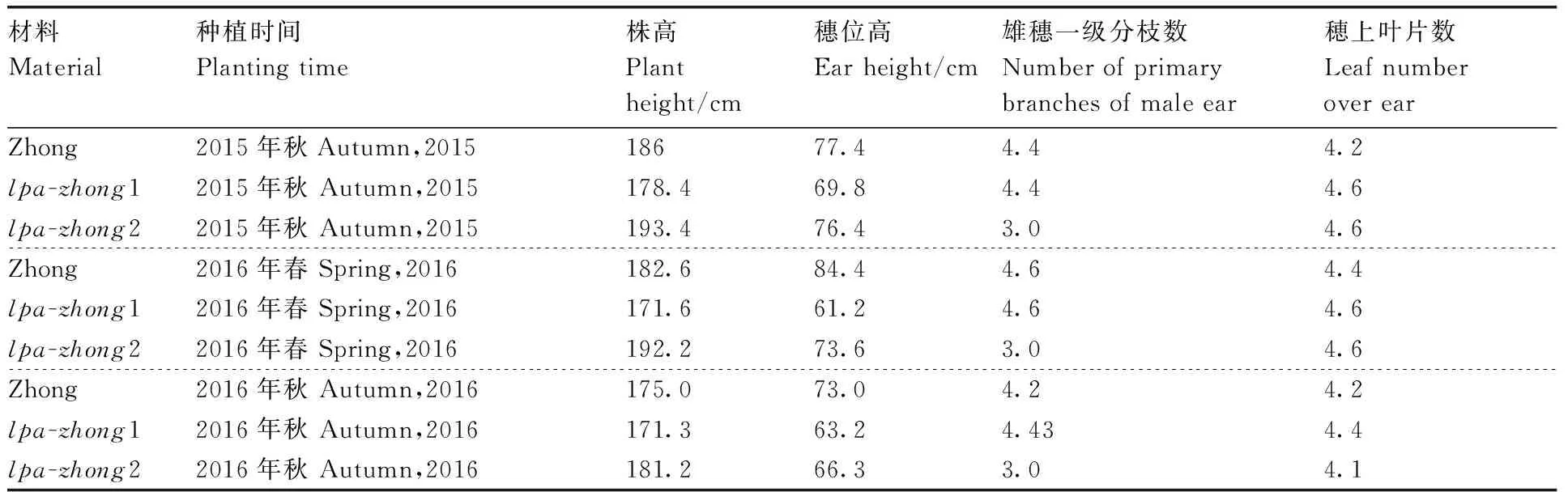
表5 不同种植时间的突变体与野生型亲本的农艺性状Table 5 The agronomic traits of LPA mutants and wild type parent lines in different planting time
3 讨论
迄今为止,在水稻[6,10,14]、玉米[15-18]、大豆[19]和大麦[13,20]等主要农作物中均已获得了低植酸、高无机磷(HIP)的突变种质。玉米中现主要有lpa1、lpa2和lpa3三种突变被鉴定出来。其中,Raboy等[2]通过NaN3化学诱变剂获得的lpa1-1玉米突变系归类为lpa1突变,其种子植酸含量降低,伴随着无机磷的升高,未积累肌醇和低价肌醇磷酸盐中间物,总P量保持不变;Shi等[15]和Badone等[16]获得的玉米突变系lpa1和lpa1-7均属于此类突变;Raboy等[11]、Pilu等[12]和Shi等[17]获得的lpa2-1、Lpa241和lpa2突变则不同,归类为lpa2突变,主要表现在种子植酸含量下降、无机磷含量升高的同时,低价肌醇磷酸盐含量上升,而总P量仍然保持不变;lpa3突变则表现出种子植酸含量减少,无机磷含量和肌醇含量显著增加,但低价肌醇磷酸盐没有明显变化[18]。
研究发现,低植酸、高无机磷的玉米突变体大多数是通过化学诱变培育而成,而通过辐照诱变创造出的HIP材料则较少。本实验采用这一方法获得高HIP突变体。这两个突变等位,属于单隐性基因控制类型,这与前人报道的研究结果一致。突变体的总P含量都极显著高于野生型亲本,这与多数突变体报道的结果不同,仅与Hatzack等[13]研究的大麦A型低植酸突变体的结果类似。
前人研究表明,在玉米HIP突变体的研究中,绝大多数伴随着植酸含量的下降、无机磷含量的升高,农艺性状和种子品质特性也会出现不同程度的变化,主要表现为种子发芽率下降,粒重下降等[11]。通过对两个突变体的初步研究发现,突变造成了发芽率和百粒重下降,但产量性状和农艺性状无显著变化,这可能会影响突变体的后续利用,这也与前人的报道基本一致。这些变化是由突变的直接作用还是间接作用引起,还有待进一步的实验。
此外,突变体种子质量变劣可通过育种途径进行改善,如采用多次回交和常规品种杂交等方法改良突变体的产量性状,这已在玉米和大豆低植酸突变体中取得了进展[10]。这说明,低植酸高无机磷玉米突变体具备一定应用价值,可作为低植酸高无机磷玉米杂交种的基础材料,而低植酸商业杂交种的育成将对动物和人类的营养元素吸收利用发挥重要作用。
