绿茶对高糖环境下乳鼠海马神经细胞的保护作用
2018-08-23刘声菊刘国旗许永劼高超潘卫李兴
刘声菊,刘国旗,许永劼,高超,潘卫,2,3,李兴
(1贵州医科大学,贵阳550004;2贵州医科大学附属医院;3贵州省产前诊断中心)
糖尿病脑病是糖尿病严重的慢性并发症,主要表现为学习、记忆及认知功能障碍等[1]。目前,糖尿病脑病的发病机制尚不清楚,亦缺乏有效的防治手段,因此积极寻找糖尿病脑病的药物已不容忽视。我国是茶叶的资源大国,茶叶一直作为药用植物被广泛应用,其生理功效和药理功效受到了广泛关注[2]。大量研究表明,绿茶具有降低神经退行性疾病发病率和保护神经等功效[3]。血清药理学反映了药物有效成分在血中的动态变化及相互作用,避免了药物的物理化学性质对实验结果的影响,能够更好地模拟药物在体内发挥作用的过程[4]。目前,对于含茶血清用于糖尿病脑病体外药理学研究的报道罕见。2017~2018年,我们以大鼠为绿茶浸出液血清供体,观察绿茶浸出液血清对乳鼠海马神经细胞高糖损伤的保护作用,探讨茶叶保护神经细胞的作用机制,为茶叶用于临床防治神经退行性疾病提供实验依据。
1 材料与方法
1.1 动物、试剂与仪器 SPF级(SD)雄鼠6只,体质量180~220 g;出生24 h内的SD乳鼠,体质量3~6 g,均购于贵州医科大学动物中心。Neurobasal-A培养基、DMEM培养基、B-27、0.25%胰蛋白酶、双抗均购自美国Gibco公司;AusGeneX胎牛血清购自上海臻诺生物科技有限公司;马血清购自美国Hyclone公司;L-谷氨酰胺购自碧云天生物技术研究所;CCK-8试剂盒购自北京鼎国昌盛生物技术有限责任公司;乳酸脱氢酶(LDH)试剂盒购自南京建成生物公司;绿茶由贵州省流通环节食品安全检验中心提供。JA2003N型电子天平购自上海菁海仪器有限公司;Thermo-3111型CO2培养箱购自上海旦鼎国际贸易有限公司;VL-4型无菌操作台购自珠海再鑫仪器有限公司;IMARK型酶标仪购自美国Bio-Rad公司。
1.2 绿茶浸出液及空白血清制备 称取绿茶粉末20.0 g,加入100 mL蒸馏水,摇匀,70 ℃条件下水浴1 h,过滤,取滤液浓缩,用蒸馏水定容至原体积的1/2,摇匀,供大鼠灌胃使用。将大鼠随机分为2组,每组3只,一组采用绿茶浓缩液20 mL/(kg·d)剂量灌胃,另一组采用生理盐水20 mL/(kg·d)剂量灌胃,2次/d,连续3 d。第3天末次灌胃大鼠1.5 h后,股动脉取血,经3 000 r/min离心10 min,取上层血清,56 ℃灭活30 min,过滤除菌后-80 ℃保存。用Neurobasal-A培养基按倍比稀释的方法分别配制为25%、50%、100%浓度,作为低、中、高浓度血清待用。
1.3 海马神经细胞原代培养 取出生24 h内SD乳鼠的海马组织,剪碎、吹打、离心、弃上清后,加入0.125%胰蛋白酶,37 ℃消化15 min,加入等体积的胎牛血清终止消化,200目筛网过滤,制成单细胞悬液,种植于预先用L-多聚赖氨酸包被的6孔板和96孔板中,8 h后将种植培养基(83%DMEM培养基+1%L-谷氨酰胺+1%双抗+10%马血清+5%胎牛血清)全量换成维持培养基(96%Neurobasal-A+2%B-27+1%L-谷氨酰胺+1%双抗)培养,以后每48 h半量换液1次。
1.4 分组与干预方法 海马神经细胞培养至第5天时,随机分为8组,分别为对照组、高糖组、空白血清低浓度组、空白血清中浓度组、空白血清高浓度组、绿茶低浓度组、绿茶中浓度组、绿茶高浓度组。对照组按培养基总体积的10%加入维持培养基,并保持葡萄糖浓度为25 mmol/L;高糖组按培养基总体积的10%加入维持培养基,并保持葡萄糖浓度为45 mmol/L;空白血清低、中、高浓度组分别按培养基总体积的10%加入低、中、高浓度空白血清,并保持葡萄糖浓度为45 mmol/L;绿茶低、中、高浓度组分别按培养基总体积的10%加入低、中、高浓度绿茶浸出液血清,并保持葡萄糖浓度为45 mmol/L。
1.5 观察指标
1.5.1 细胞形态 各组干预后继续培养48 h,于倒置显微镜下观察细胞胞体、细胞突触数目及形态改变。
1.5.2 细胞超微结构 采用消化离心法收集各组细胞,细胞离心成团后吸去上清,并加入2.5%戊二醛固定2 h后收集细胞团块,并用电镜固定液固定海马组织,制作超薄组织切片,透射电镜下观察各组细胞超微结构。
1.5.3 细胞损伤情况 采用LDH法。细胞培养至第7天,收集各组细胞上清液10 μL于酶标包被板中,每组平行做5孔,并设空白孔,经过孵育、加酶、显色和终止后,以空白孔调零,在酶标仪450 nm波长处测定光密度D(λ)值,以评价细胞损伤情况。
1.5.4 细胞活性情况 采用CCK-8法。细胞培养至第7天,向每孔中加入10 μL的CCK-8溶液,每组平行做5孔,并设空白孔,置于培养箱中孵育2 h后,以空白孔调零,在酶标仪450 nm波长处测定光密度D(λ)值,以评价细胞活性情况。
2 结果
2.1 各组细胞形态变化 对照组海马神经细胞形态成熟饱满,体积较大,聚集生长明显,细胞质丰富,光晕明显,突起发达并向外延伸,同时变粗且分出许多分支,互相连接形成密集交错的网络。与对照组比较,高糖组海马神经细胞形态多变,胞体内出现空泡,突起回缩,呈现出明显的退变现象。与高糖组比较,空白血清组海马神经细胞形态无明显差异。各干预组神经细胞形态规则饱满,有光晕,突触明显增多增长并相互连接成网状,但高浓度组较低浓度组明显。
2.2 各组细胞超微结构变化 对照组海马神经细胞形态正常,细胞核形态规则,核内染色质丰富且分布均匀,核仁明显,细胞器丰富,内质网、线粒体形态正常,无囊泡化扩张,胞质内可见大量微丝(图1-A)。与对照组比较,高糖组细胞核形态不规则,核内染色质分布不均、颗粒化、凝集成块并边集,细胞内质网,线粒体有囊泡化扩张,伴随有自噬现象的产生,有明显的细胞骨架微丝结构改变(图1-B)。与高糖组比较,空白血清各组细胞结构无明显差异(图1-C、D、E)。与高糖组比较,干预各组神经细胞结构较高糖组有所改善,胞体形态结构较完整,细胞质内细胞器较多,可见较多的粗面内质网和线粒体,染色质均匀,并且高浓度组较低浓度组显著(图1-F、G、H)。
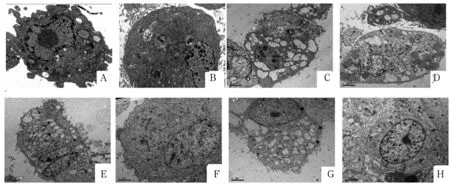
注:A为对照组;B为高糖组;C为空白血清低浓度组;D为空白血清中浓度组;E为空白血清高浓度组;F为绿茶低浓度组;G为绿茶中浓度组;H为绿茶高浓度组。
2.3 各组细胞损伤比较 高糖组LDH水平高于对照组(P<0.01);绿茶低、中、高浓度组LDH水平均低于高糖组,且高浓度组低于低浓度组(P均<0.01)。绿茶各浓度组LDH水平均低于相应空白血清对照组(P均<0.05);不同浓度空白血清组之间差异无统计学意义(P均>0.05)。LDH水平与绿茶血清浓度呈正相关(r2=0.856,P<0.05)。见表1。
2.4 各组细胞活性比较 高糖组CCK-8低于对照组(P<0.01);各干预组CCK-8均高于高糖组,且高浓度组高于低浓度组(P均<0.05)。绿茶各浓度组CCK-8均高于相应空白血清对照组(P均<0.05)。不同浓度空白血清组之间差异无统计学意义(P均>0.05)。CCK-8与绿茶血清浓度呈正相关(r2=0.993,P<0.05)。见表1。
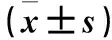
表1 各组LDH与CCK-8水平比较
3 讨论
糖尿病脑病是以认知功能障碍为特征的糖尿病严重慢性并发症之一,其对中枢神经的影响已经引起重视,严重影响糖尿病患者的晚年生活[5]。目前对糖尿病脑病的发病机制存在很多解释,包括神经细胞的凋亡、胰岛素分泌不足或抵抗、缺血缺氧、氧化应激、突触可塑性变化、非酶促糖基化终末产物的形成和大脑出现老化等[6]。但由于糖尿病脑病的病理生理机制尚不十分清楚,因而也缺乏明确的药物干预方法。本研究模拟体内的高血糖环境进行海马神经细胞的体外培养,结果发现,与对照组比较,高糖组海马神经细胞形态多样化,胞体内出现空泡,突起回缩,细胞器肿胀且数量减少,呈现出明显的退变现象,表明升高糖浓度可引起神经细胞形态结构的改变;而且LDH、CCK-8实验结果也显示,高糖组海马神经细胞损伤程度升高、活性明显下降,进一步证实糖浓度的升高可引起海马神经细胞的损伤,这可能是糖尿病脑病的发病机制之一。
绿茶是我国的主要茶类之一,为不发酵茶,其特性决定了它能较多地保留茶叶的天然物质,为发酵类茶等所不及,具有抗氧化、抗癌、抗糖尿病、抗衰老、降血脂等多种药理作用。茶叶的神经保护作用是近年来茶叶与健康领域的研究热点之一。研究发现,茶叶中含有茶多酚、生物碱、茶氨酸等生物活性物质,具有保护神经功能特性作用,相较于化学药物,茶叶的神经保护作用具有多靶点、低毒副作用、协同功效等优点[7]。研究表明,茶多酚、生物碱和茶氨酸都能够渗透血脑屏障进入脑组织,饮茶可降低AD、帕金森症等神经退行性疾病的发病率,降低认知功能障碍。Qi等[8]研究茶多酚对持续黑暗和血红素氧合酶(HO)诱导的小鼠脑SH-SY5Y细胞凋亡的影响,结果发现茶多酚能减弱HO引起的细胞活力损失和线粒体功能障碍,抑制SH-SY5Y细胞凋亡并使细胞内ROS和HO的水平降低,因此茶多酚对氧化应激引发的神经细胞损伤具有保护作用。Zukhurova等[9]首先证明茶氨酸可以改善谷氨酸受体激动剂诱导的脑缺血再灌注损伤,对诱导的神经细胞损伤具有保护作用。本研究发现,与高糖组相比,绿茶各浓度组海马神经细胞形态规则饱满,突触增多,超微结构改善,说明绿茶血清干预可降低糖浓度升高时的海马神经细胞损伤;与高糖组比较,绿茶各浓度组海马神经细胞活性升高且损伤程度下降,且绿茶各浓度组LDH、CCK-8水平与绿茶血清浓度具有相关性,表明在一定范围内药物作用具有浓度依赖性,随绿茶浸出液浓度增高,细胞活性升高,损伤程度下降;反之活性降低,损伤程度增加。
目前国内外研究主要集中在茶叶提取物或单一成分直接用于体外实验[10],但绿茶成分复杂,药理作用具有多靶点、多层次的特点,故以单一成分的体外实验结果来评价其在体内的效应不够确切和客观[11],同时茶叶直接作用于体外实验无法评价其在体内发挥生物效应的真正有效成分[12]。中药血清药理学是给实验动物服用药物,间隔一段时间后提取含药血清再进行体外实验研究的一种研究方法。这种实验方法不仅能从局部功能进行观察,而且可以排除中药直接体外用药的一系列干扰,更加接近药物在体内的真实过程,可体现药物本身以及自身代谢产物所产生的药理作用,有利于探讨药物在体内直接发挥药效的物质及作用机制[13]。本实验按血清药理学方法制备含药血清,并通过相同剂量多次给药后采血,根据药代动力学理论,相同剂量多次给药并固定给药时间的间隔,有利于血药浓度达到稳定状态,此时采集的含药血清是进行药理实验研究的理想阶段[14]。研究表明,多数药物在达到峰浓度时间为给药后1~2 h,采血时间一般定为给药2 h后,也可在末次连续给药2次,间隔1 h,第2次给药1 h后采血。根据本课题组前期对绿茶进行的药代动力学研究,发现绿茶部分成分在大鼠血清中达到峰浓度时间为1.5 h左右[15],故本实验在末次给药1.5 h后取血。有文献表明,含药血清在采集后多经过56 ℃ 30 min灭活处理,并认为血清灭活这一常规处理方法是必要的,既可灭活掉血清中的部分补体,减弱对培养细胞的非药物性影响,又符合减少微生物感染的常规细胞培养要求。故本实验血清经过56 ℃ 30 min灭活处理,并且也设定了严格的空白血清对照组来排除血清的非药物性干扰。本研究发现,与高糖组相比,绿茶血清各组细胞形态、超微结构和细胞活性均有改善,且细胞损伤程度下降,而空白血清各组细胞则无明显改变,因此可排除空白血清对实验结果产生的影响,进一步证明绿茶可降低糖浓度升高时海马神经细胞的损伤,具有一定的神经保护作用。
综上所述,高糖可引起海马神经细胞损伤,绿茶干预可降低糖浓度升高对海马神经细胞的影响,使细胞形态、超微结构均得到改善,且细胞活性升高,损伤程度下降,可能是绿茶发挥神经保护作用、进而降低机体的认知功能障碍的机制。本实验为绿茶应用于临床延缓糖尿病脑病的发病以及防治神经退行性疾病提供了依据。
