不同壳聚糖改性黏土对小球藻的絮凝效应及絮凝条件优选
2018-08-22赵雨枫宋新山赵志淼袁世红
赵雨枫,宋新山※,曹 新,赵志淼,宋 锦,袁世红,陈 燕
(1. 东华大学环境科学与工程学院,上海 201620;2. 上海海洋大学海洋生态与环境学院,上海 201306)
0 引 言
微藻分布广泛,其光合效率高、生长速度快,固碳和环境适应能力强,是一种新型的低碳环保资源[1]。小球藻含有丰富的蛋白质、不饱和脂肪酸(polyunsaturated fatty acid, PUFA)、生物多糖,具有抗肿瘤活性、抑制癌细胞、增强免疫等作用[2],拥有广泛的应用前景。但小球藻个体微小(3~30μm),且在培养液中的浓度低(<1 g/L),这导致工业规模的微藻养殖采收难度大、成本高。因此,寻求一种高效率、绿色无污染的絮凝剂是当前亟需解决的问题。
目前,絮凝沉降是微藻采收和微藻去除中最为广泛的技术之一[3]。常用的絮凝剂主要有金属盐类和高分子聚合物,但絮凝过程中金属离子的引入会对水环境形成二次污染,也对微藻产品的后续深加工造成影响。壳聚糖是一种无毒可生物降解的天然高分子化合物,它具有良好的吸附性能,较好的电中和能力和网捕架桥作用,在水处理[4-6]、食品加工和化学工业中都有广泛的应用[7-9]。研究表明,藻液的pH值控制在4~6时,壳聚糖可以有效的絮凝微藻[10]。然而微藻培养至中后期时,藻液pH值通常呈现碱性(9~10.5左右)[11],大幅度改变pH值会使得絮凝成本增加。近年来,壳聚糖复合无机材料已成为研究热点。在无机材料中,黏土矿物作为一种廉价易得、天然无污染的材料,已逐渐应用于藻类的絮凝,而将壳聚糖和黏土矿物进行复合絮凝采收微藻的研究较为少见。
因此,本研究选择 3种不同类型的无机矿物膨润土(链状)、硅藻土(直链状)、沸石(纤维状),采用酸性壳聚糖改性,以小球藻作为目标微藻,研究絮凝剂的浓度、絮凝的静置时间、藻液pH值和壳聚糖与不同黏土矿物的比例对藻类絮凝效果的影响,从而确定小球藻絮凝的最佳絮凝剂和最佳条件,为工业化采收微藻提供科学依据。
1 材料与方法
1.1 试验材料
藻种:蛋白核小球藻(Chlorella pyrenoidosa),购于中国科学院野生生物种质-淡水藻种库,编号FACHB-10。
黏土矿物:Na-膨润土(内蒙古天宇膨润土科技有限公司)、硅藻土(青岛三星硅藻土有限公司)、人造沸石(国药集团化学试剂有限公司)、壳聚糖(BR,分子量161.16,脱乙酰度 80.0%~95.0%,国药集团化学试剂有限公司)。其余试剂均为分析纯,购于上海国药。
1.2 试验方法
1.2.1 藻的培养
采用BG11培养基(pH值为7.2),培养基的成分包括 NaNO31.5 g/L,KH2PO40.04 g/L,MgSO4×7H2O 0.075 g/L,CaCl2×H2O 0.036 g/L,柠檬酸 0.006 g/L,柠檬酸铁铵0.006 g/L,乙二胺四乙酸二钠 0.001 g/L,NaCO30.02 g/L,A5(H3BO32.86 g/L,MnCl2×4H2O 1.86 g/L,ZnSO4×7H2O 0.22 g/L,Na2MoO4×2H2O 0.39 g/L,CuSO4×5H2O 0.08 g/L,CoCl2×6H2O 0.04 g/L)取1mL/L。将配制好的培养基高压灭菌后备用。藻种悬浮液与培养液以 1∶10的体积比接种,在温度20~25 ℃,光照强度2 000~3 000 lx,12 h光照/12 h黑暗条件下进行扩大培养(6 d左右),期间每天摇瓶3~4次避免贴壁。
1.2.2 藻细胞数的测定
用血细胞计数器进行细胞计数,并采用紫外分光光度法测定680 nm处的吸光度值OD680,得到小球藻细胞与密度的标准曲线:y=20x-0.309(R2= 0.998),其中y表示藻细胞数量(106个/mL),x表示OD680。
1.2.3 絮凝剂的制备
称取1.5 g壳聚糖于100 mL的烧杯中,加入50 mL的盐酸溶液(5 mol/L),室温搅拌至完全溶解。按照壳聚糖与黏土矿物质量比为 1∶2,1∶6,1∶10,1∶14,分别称取一定质量的硅藻土、膨润土和沸石加入烧杯中,常温搅拌24 h。将溶液抽滤,所得固体于75 ℃干燥,研磨,过200目筛,分别制得壳聚糖改性硅藻土(chitosan modified diatomite,CMD)、壳聚糖改性膨润土(chitosan modified bentonite,CMB)和壳聚糖改性沸石(chitosan modified zeolite,CMZ)3种复合絮凝剂。同时3种未改性的硅藻土(diatomite,DE)、膨润土(bentonite, BE)和沸石(zeolite,ZE)絮凝剂研磨,过200目筛,备用。
1.2.4 絮凝效果试验
以絮凝率表征小球藻的采收情况,设置不同的絮凝剂浓度(0、0.05、0.1、0.2、0.4、0.6 g/L)、藻液pH值(2、4、6、8、9、10)和静置时间(0、10、30、60、90、120 min),取生长对数中后期的小球藻液置于500 mL烧杯中进行试验。分别将一定量的 3种复合絮凝剂加入400 mL小球藻液中,调节pH值,同时设置空白对照组(原藻液),快速搅拌后静置沉降。取液面下3~5 cm处藻液测其吸光度OD680值,通过小球藻细胞数与光密度的标准曲线换算成细胞数,并根据式(1)计算小球藻的絮凝率。
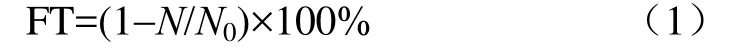
其中N0是原小球藻细胞数量,N是静置沉降后的小球藻细胞数量。
1.2.5 复合絮凝剂表征
将改性前后的复合絮凝剂样品干燥保存,采用扫描电子显微镜(JSM-5600LV, JEOL)观察其形态。
1.2.6 数据处理与分析
用Excel进行数据统计和绘图,结果表示为平均值±标准偏差(SD),所有数据的平均值和标准差都是3次重复的结果。
2 结果与分析
2.1 絮凝剂浓度及静置时间的影响
絮凝剂浓度和静置时间是影响絮凝率的重要因素。絮凝前用盐酸溶液将介质的 pH值调节至 8(偏碱性),当壳聚糖与黏土矿物的配比为1∶6时,在不同的絮凝剂浓度和静置时间下分别观察 3种复合絮凝剂对小球藻液絮凝率的影响,如图1所示。图1a~图1c表明,当絮凝剂浓度为0.2 g/L,沉降30 min后,CMD、CMB、CMZ对小球藻的絮凝率分别为90.61%、80.84%和66.14%,并且对于CMD,随时间变化其絮凝率并不发生显著改变,对于CMZ,沉降60 min后其絮凝率才基本趋于平稳。当絮凝剂浓度小于0.2 g/L时,CMD的絮凝率要高于另外两者20%~30%,且到90 min后3种絮凝剂才逐渐达到稳定。当絮凝剂浓度大于0.2 g/L时,随浓度的增加, 3种复合絮凝剂的絮凝率仅增加2%~6%。这是因为随着絮凝剂浓度的增加,对小球藻表面所带的负电荷胶体吸引的容量越大。但当浓度继续增大时,会使得水体中胶体的Zeta电位持续上升,由负电状态逐渐变为正电状态。研究表明一般天然水体中胶体颗粒的 Zeta电位在-30 mV以上,当电位上升到-15 mV左右时可以达到良好的絮凝效果[12]。因此随着浓度的继续增大,对小球藻的絮凝率并没有提升,甚至还可能会导致絮凝率的大幅下降。

图1 不同浓度和静置时间下不同絮凝剂对小球藻絮凝率的影响Fig.1 Effects of flocculant concentration and time with different flocculants on flocculation efficiency of C. pyrenoidosa
可见,CMD絮凝剂絮凝率最高,沉降速率最快。这是因为藻细胞的絮凝率与絮凝剂的理化性质密切相关。絮凝剂的比表面积和表面电性是影响絮凝率的主要因素[13-14]。不同絮凝剂的比表面积有着一定的差异。此外,黏土絮凝藻细胞的过程取决于其颗粒与藻细胞的碰撞效率和黏土与藻细胞的黏连作用,不同的黏土具有不同的分形维数[15]。黏土吸附在藻细胞表面时,分形维数较低的絮体与分形维数较高的絮体相比,有较大的接触面积,从而增加絮体的碰撞频率,使得沉降速率更快。
目前,改性黏土主要分为无机改性、有机改性和天然化合物改性,其改性后的黏土在水华治理中有着广泛的应用[16]。研究表明,除了絮凝剂的表面电性外,黏土矿物的结构、种类和硅铝比亦是影响复合絮凝絮凝效率的另一个重要因素[17]。本研究采用了天然改性剂对 3种黏土矿物(硅藻土、膨润土和沸石)进行改性,同时通过酸化处理,一方面可以有效的疏通了孔道,同时氢离子置换出黏土矿物中可溶的 Ca2+、Mg2+等阳离子,有利于黏土矿物在水中的分散性[18]。另一方面,黏土颗粒表面形成带正电的多铝化合物,使得藻细胞与黏土颗粒表面的电中和作用增强[19]。本研究采用钠基膨润土(蒙脱石含量 85%~90%)具有较好的离子交换性能。而丝光沸石,其具有较高的硅铝比(4.17~5.00),而藻的絮凝效率与黏土的硅铝比呈现负相关的线性关系[17],因此表现出的絮凝性能相对较差。与膨润土与沸石相比,硅藻土具有特殊的多孔构造,更有利于微藻的吸附,因此絮凝效果最佳。
2.2 pH值的影响
pH值对含藻水体表面电荷Zeta电位有较大影响,会导致絮凝效果不同[20]。图2为当絮凝剂浓度为0.2 g/L,不同pH值条件下3种复合絮凝剂对小球藻絮凝率的影响。
结果表明,当pH值为8时,3种絮凝剂中CMD的絮凝率最高,为94.4%,且絮凝率随时间不发生明显变化,当pH值为9时,CMD的絮凝率为91.2%,与pH值为8时相比其絮凝率变化不大。而当pH值为酸性(4、6)和碱性(11)时,其CMD絮凝率分别下降了约28%和11%。可见,pH值过低和过高时都不足以发生有效的絮凝,且小球藻的絮凝率随沉降时间的延长,会发生明显的变化。当pH值增大时,改性后壳聚糖与黏土矿物之间虽然有相互作用,但是黏土矿物表面的Zeta电位为负值,带有大量的负电荷,而在碱性介质中溶解的壳聚糖不足以中和小球藻细胞表面的电荷,因此只有部分藻类絮凝[21]。当pH值较小时,壳聚糖溶解性较好,絮凝剂中主要是黏土矿物发挥作用,但黏土矿物絮凝能力较差,因此对小球藻的絮凝率低。研究表明,壳聚糖在酸性水溶液中(pH值为 5)对藻类的絮凝率可高达 95%,其絮凝效果优于QCMC,PAM,Al2(SO4)3和FeCl3等常规絮凝剂,但在中性和碱性溶液中絮凝率显著下降[22]。这主要与壳聚糖的溶解性相关。研究表明采用壳聚糖改性海泡石的絮凝剂治理景观水,当浓度为18 mg/L,pH值为8的条件下,对浊度的去除率最高[23]。这与本研究的结果一致。
此外,3种改性絮凝剂中,CMD絮凝剂的絮凝率最高,且在弱碱性条件,静置30 min后,其小球藻的絮凝率随pH值变化仅改变10%~13%,这表明CMD是较为稳定的絮凝剂,适用的pH值范围更广。因此CMD絮凝剂在一定程度上扩大了絮凝剂使用的pH值范围,可以有效的节约成本。
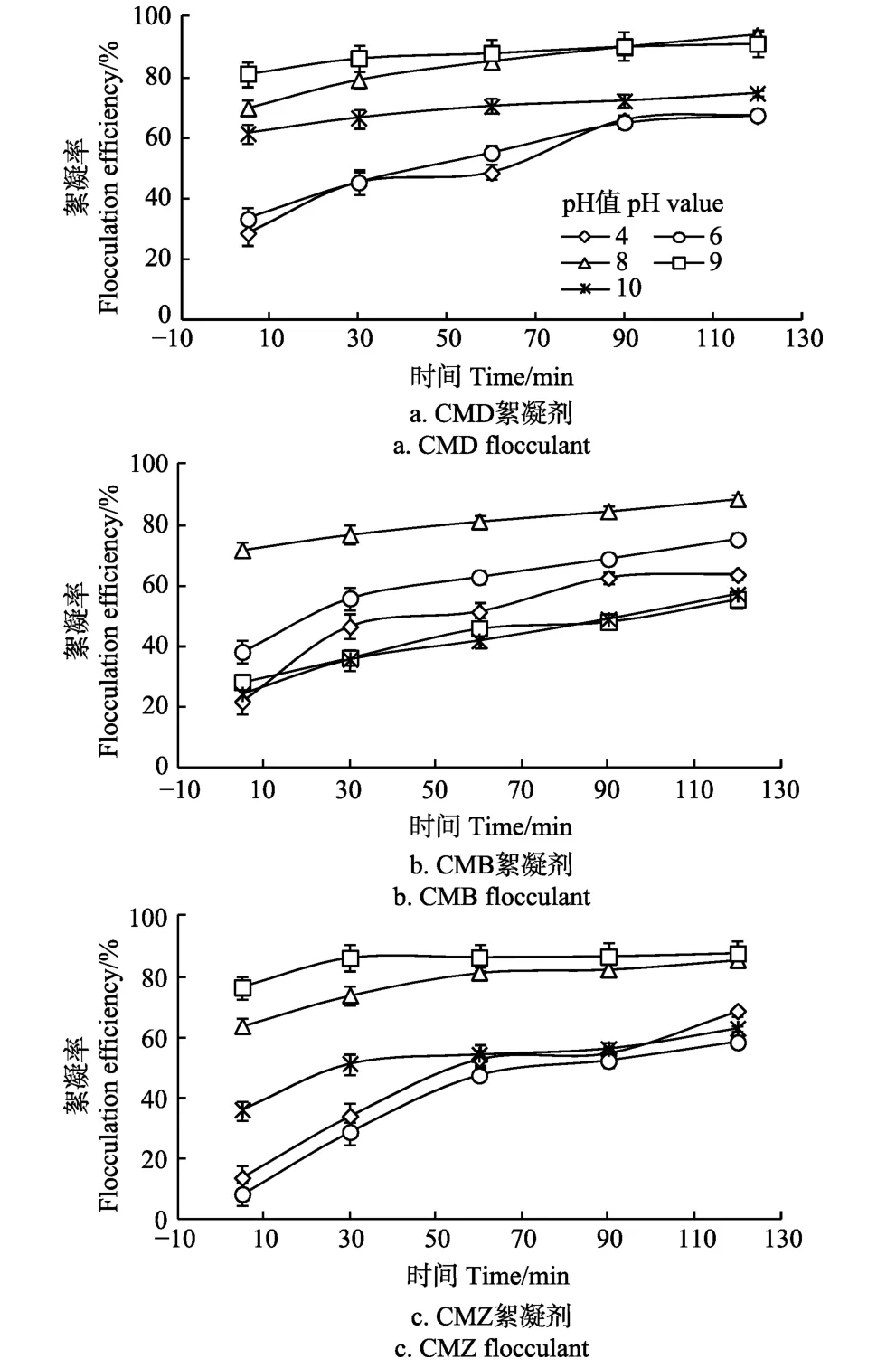
图2 不同pH值下不同絮凝剂对小球藻絮凝率的影响Fig.2 Effects of pH value with different flocculants on flocculation efficiency of C. pyrenoidosa
2.3 壳聚糖与黏土矿物配比的影响
当总质量相同时,壳聚糖与黏土矿物不同的配比对絮凝率也有着一定的影响。如图3可见,调节藻液pH值为8,絮凝剂的浓度为0.2 g/L,静置30 min后,随着壳聚糖与硅藻土配比增大,絮凝率呈现先增大后减小的趋势。其中CMD絮凝剂对小球藻的絮凝率明显高于其他两者。在壳聚糖与硅藻土配比为 1∶6时,絮凝率最佳为92.8%,而当配比增大到1∶14时,絮凝率相比最佳配比下反而下降了 10%。这是因为过多的硅藻土不能与壳聚糖进行复配,部分析出悬浮在藻液中,导致絮凝率降低。
2.4 絮凝剂改性前后对絮凝效果影响的比较
上述试验结果表明,当 pH值为 8,絮凝剂浓度为0.2 g/L时,静置120 min后,3种改性后的絮凝剂(CMD、CMB、CMZ)对小球藻的絮凝率分别可以达到96.61%、92.36%、88.59%。在相同的试验条件下,对3种未改性的絮凝剂硅藻土(diatomite,DE)、膨润土(bentonite,BE)、沸石(zeolite,ZE)和壳聚糖对小球藻的絮凝率进行试验,以确定复合材料的使用价值及意义。在不同浓度下,DE、BE、ZE和壳聚糖对小球藻絮凝率随置时间的变化如图4所示。
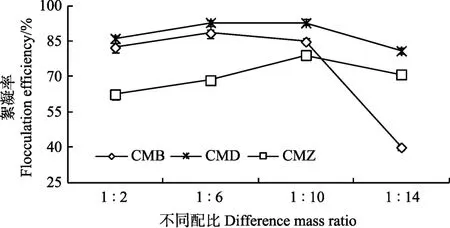
图3 壳聚糖与黏土矿物的配比对小球藻絮凝率的影响Fig.3 Effects of different mass ratios between chitosan and clay minerals on flocculation efficiency of cells of C. pyrenoidosa
结果表明,未改性的DE、BE和ZE絮凝剂与改性后的的絮凝剂相比,其絮凝效率仅为 CMD、CMB、CMZ处理后的45%~50%。单独使用DE、BE和ZE絮凝小球藻,当浓度低于0.6 g/L(静置120 min),其小球藻的絮凝效率均低于 45%。杜胜蓝等[24]采用沸石除藻,发现沸石浓度小于 500 mg/L时, 铜绿微囊藻去除效率均低于40%。这表明未改性的黏土矿物对藻细胞无明显的絮凝效应。这是由于黏土矿物与藻细胞的絮凝过程主要是由于两者之间的撞形会逐渐形成絮体,絮体不断增大累积,但是黏土矿物颗粒表面通常带有负电荷,与带负电的藻细胞产生经典排斥会导致两者的碰撞效率降低,影响絮凝效率,同时黏土矿物溶胶性差,容易迅速凝聚。
假设正弦电流源为iP(t)=IPsin(ωt),其中IP是电流幅值,ω是振动角频率。整流桥上的4个二极管的压降均为VD,则传统全桥整流电路输出电流的平均值是
图4a~4c表明,在相同静置时间下,随着3种未改性的絮凝剂浓度的增加,小球藻的絮凝效率仅增加5%~10%。这是由于黏土矿物的使用量较小,并没有有效的絮凝。亦有研究表明使用海泡石处理去除水体中的铜绿微囊藻时,浓度为2.25 g/L,可去除85%以上的藻细胞[25]。沸石对水体铜绿微囊藻的去除率随着浓度的增加而增大,当浓度为25 g/L时,其去除率可达93%[26]。因此黏土矿物的使用量过大也成为了限制黏土矿物使用的一个重要因素。与改性前的DE相比,改性后仅在0.2 g CMD中加入 0.028 g的壳聚糖,其小球藻的絮凝率提高了60.03%。这表明通过壳聚糖改性黏土矿物,提高小球藻的絮凝效率的同时,也有效减少了黏土矿物的用量。图4d表明单独使用壳聚糖对小球藻絮凝效率的影响。结果表明,静置30 min后,小球藻的絮凝效率仅为7.41%~12.41%,静置120 min后,其絮凝率可达32.41%~47.09%。而且浓度大于0.4 g/L时,絮凝效率才有一定的提高。这表明壳聚糖用量较小时,对微藻的絮凝效率并不高。这是因为在pH值为8微碱性的溶液中,壳聚糖的溶解能力下降,导致絮凝能力较差。研究表明,壳聚糖在酸性溶液中絮凝能力较强,而当溶液pH值大于7,絮凝能力迅速下降[27]。
因此藻液较高的 pH值是限制壳聚糖絮凝效率的重要因素。与改性前相比,壳聚糖改性黏土矿物后,在相同的絮凝条件下(pH值为8),改性后0.2 g的CMD中仅含有 0.028 g的壳聚糖,与单独使用壳聚糖(浓度为0.05 g/L),其小球藻的絮凝效率提高了64.2%。

图4 絮凝剂硅藻土(DE)、膨润土(BE)、沸石(ZE)和壳聚糖对小球藻絮凝率的影响Fig.4 Effects of DE、BE、ZE and chitosan flocculants on flocculation efficiency of C. pyrenoidosa
对比 3种黏土矿物改性前后对小球藻絮凝效果,不难发现改性后复合絮凝剂有效的改善了壳聚糖和黏土矿物的理化性质,静置30 min后,CMD絮凝剂对小球藻的絮凝率比 CMB絮凝剂高出 10%,比 CMZ絮凝剂高出20%。同时可以减少单独使用两者的用量,使得藻细胞的絮凝效率得到了明显的提高。一方面因为用壳聚糖对黏土进行包覆改性时,壳聚糖会改变黏土颗粒表面特性和表面电性。使得原本表面带有正电荷的黏土颗粒带正电荷。这主要是因为改性过程的酸化处理,壳聚糖溶于酸后,壳聚糖上质子化的胺数量会有所增加,使得其分子链上带有大量的正电荷,表现出阳离子絮凝剂的特性[28]。已有研究表明带电基团数量的增加会提高颗粒的不稳定性,易发生沉淀过程[29]。相比未改性的黏土矿物和壳聚糖,改性后使得絮凝剂与带负电荷的藻细胞之间排斥力减小,电中和效应得到了加强。因此藻细胞更容易脱稳,使得微藻的絮凝率大幅度提高。另一方面,壳聚糖对黏土进行包覆改性时,会增强絮凝剂与藻细胞之间的架桥网捕作用。这是因为壳聚糖具有较大的分子量,其分子链较长,在溶液中呈现较大的黏度[30]。壳聚糖的高分子链附着在黏土矿物的表面或周围,对于溶液中悬浮的微藻细胞有很好的网捕架桥作用,使得藻细胞絮凝而发生沉降。同时壳聚糖与黏土矿物之间的吸附交联作用使絮凝剂形成一定的结构空间,增大比表面积,增强了藻细胞与絮凝剂之间的接触,使得有效碰撞增强,为小球藻的附着提供了更大的空间。此外,单独使用黏土矿物絮凝后,絮体结构不稳,容易重新分散到水体中[13]。而改性后,絮凝剂的密度和体积大于改性前的黏土矿物,有效地增加了絮体的质量,使得聚集起来的絮体更加紧密。改性后的絮凝剂可以改善黏土矿物溶胀性,加快藻液中固液分离速度,使得絮体的沉降速度更快,更有利收集。同时紧密的絮体结构也可以有效的避免藻细胞重新进入水体。
2.5 改性前后絮凝材料的表征
图 5为硅藻土、壳聚糖改性硅藻土的扫描电镜图(SEM)。本研究采用的硅藻土是由筒状的直链藻藻壳组成,表面具有很多微孔,同时还具有一个中心内孔,其空心管状结构使得硅藻土表现出较好的架桥网捕作用,有利于硅藻土与藻细胞之间絮凝。图5表明经过改性后,其硅藻土的空心管状结构并没有发生破坏。而改性前筛管硅藻土(图 5a)表面光滑,在其表面整齐的排列着许多微孔,仅有小部分孔径被堵塞。改性后硅藻土(图5b)表面较为疏松,凹凸不平,说明壳聚糖附着在硅藻土的表面,增大了絮凝剂的比表面积,更有利于对小球藻的吸附。

图5 硅藻土和CMD絮凝剂的扫描电镜图Fig.5 SEM of diatomite and CMD flocculant
2.6 絮凝剂的综合比较
根据试验结果,确定最佳复合絮凝。对改性前后的壳聚糖、DE和CMD在最佳絮凝条件下的絮凝效率、经济成本以及使用过程中的优缺点进行总结比较,如表 1所示。

表1 不同絮凝剂的比较Table 1 Comparison of different flocculant
3 结 论
通过采用酸性壳聚糖对3种不同类型的黏土矿物(膨润土、硅藻土、沸石)进行改性,制备无公害复合絮凝剂,并分别对改性前后絮凝剂絮凝效率和絮凝条件(复合絮凝剂的浓度、静置时间、藻液pH值和壳聚糖与黏土矿物的比例)的研究得到如下结论:
1)壳聚糖改性硅藻土(CMD)絮凝小球藻的最佳条件是:调节pH值为8,壳聚糖和硅藻土的配比为1:6,浓度为0.2 g/L,沉降120 min。在最佳条件下,对小球藻的絮凝率可达到约96.16%。
2)壳聚糖分别改性硅藻土、膨润土与沸石得到的 3种复合絮凝剂(CMD、CMB、CMZ)的絮凝效果均明显高于壳聚糖和3种未改性的黏土矿物(DE、BE、ZE)。比较 3种复合絮凝剂,壳聚糖改性硅藻土对小球藻的絮凝效果最佳。在最适絮凝条件下,静置30 min后,CMD絮凝剂对小球藻的絮凝率比 CMB絮凝剂高出 10%,比CMZ絮凝剂高出20%。
3)改性前后硅藻土表面形貌表征表明,经过壳聚糖改性后的硅藻土表面形态发生了改变,在硅藻土的表面附着了大量的壳聚糖,形成了凹凸不平的表面,一方面更有利于藻细胞的附着,另一方面黏土矿物也有效的增加了絮体的重量,使得聚集起来的絮体更加紧密、沉降速度更快,更有利收集。
4)综合比较不同絮凝剂(壳聚糖、DE和CMD)絮凝效率、经济成本以及使用过程中的优缺点可知,CMD是一种高效经济且环保的微藻絮凝剂,具有良好的应用前景。
[1]霍书豪,陈玉碧,刘宇鹏,等. 添加沼液的BG11营养液微藻培养试验[J]. 农业工程学报,2012,28(8):241-246.Huo Shuhao, Chen Yubi, Liu Yupeng, et al. Experiment on microalgae cultivation in BG11 nutrient solution adding biogas slurry[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2012,28(8): 241-246. (in Chinese with English abstract)
[2]孔维宝,李龙囡,张继,等. 小球藻的营养保健功能及其在食品工业中的应用[J]. 食品科学,2010,31(9):323-328.Kong Weibao, Li Longnan, Zhang Ji, et al. Healthcare functions and applications in food industry of Chlorella[J].Food Science, 2010,31(9): 323-328. (in Chinese with English abstract)
[3]马志欣,尚春琼, 胡小丽,等. 微藻絮凝采收的研究进展[J]. 基因组学与应用生物学,2016,35(4):942-948.Ma Zhixin, Shang Chunqiong, Hu Xiaoli, et al. Research progresses on microalgae harvesting by flocculation[J].Genomics and Applied Biology, 2016, 35(4): 942-948. (in Chinese with English abstract)
[4]Divakaran R, Pillai V N. Flocculation of river silt using chitosan[J]. Water Research, 2002, 36(9): 2414-2418.
[5]Huang C, Chen S, Pan J R. Optimal condition for modification of chitosan: A biopolymer for coagulation of colloidal particles[J]. Water Research, 2000, 34(3): 1057-1062.
[6]Jean R, Maurice V V, Eric G. Chitosan for the coagulation and flocculation of mineral colloids[J]. Journal of Dispersion Science & Technology, 2005, 25(5): 663-677.
[7]Fernández M, Fox P F. Fractionation of cheese nitrogen using chitosan[J]. Food Chemistry, 1997, 58(4): 319-322.
[8]Hwang D C, Damodaran S. Selective precipitation and removal of lipids from cheese whey using chitosan[J]. Journal of Agricultural & Food Chemistry, 1995, 43(1): 33-37.
[9]Knorr D. Use of chitinous polymers in food: A challenge for food research and development[J]. Food Technology, 1984,38(1): 85-97.
[10]彭超,苏会波,熊强,等. 絮凝剂对雨生红球藻采收的影响[J]. 生物加工过程, 2017,15(2):1-6.Peng Chao, Su Huibo, Xiong Qiang, et al. Effects of flocculants on recovery ofHaematococcus pluvialis[J].Nutrition and Health Research Institute, 2017, 15(2): 1-6.(in Chinese with English abstract)
[11]Zhou W, Gao L, Cheng W, et al. Electro—flotation ofChlorella sp.assisted with flocculation by chitosan[J]. Algal Research, 2016, 18: 7-14.
[12]钱宝钢,黄力群,冯波,等. 枯草芽孢杆菌产絮凝剂的发酵条件及絮凝特性研究[J]. 水处理技术,2011,37(8):26-30.Qian Baogang, Huang Liqun, Feng Bo, et al. Study on fermentation conditions and flocculation characteristics of bacillus subtilis flocculant[J]. Technology of Water Treatment, 2011, 37(8): 26-30. (in Chinese with English abstract)
[13]蒋茜茜,张小凤,陈文清,等. 壳聚糖改性黏土絮凝去除水中铜绿微囊藻[J]. 四川化工,2017,20(1):54-58.Jiang Qianqian, Zhang Xiaofeng, Chen Wenqing, et al.Chitosan modified clays flocculate removing microcystis aeruginosa in water[J]. Sichuan Chemical Industry, 2017,20(1): 54-58. (in Chinese with English abstract)
[14]王洪亮. 颗粒物对藻华生物的絮凝作用及其分形数值模拟研究[D]. 青岛:中国科学院(海洋研究所),2010.Wang Hongliang, Study on the Flocculation of HAB Organisms by Particles and Its Fractal Numerical Simulation[D]. Qingdao: Chinese Academy of Sciences (Institute of Oceanology), 2010. (in Chinese with English abstract)
[15]Guenther M, Bozelli M. Factors influencing algae–clay aggregation[J]. Hydrobiologia, 2004, 523(1/2/3): 217-223.
[16]Pierce R H, Henry M S, Higham C J, et al. Removal of harmful algal cells (Karenia brevis) and toxins from seawater culture by clay flocculation[J]. Harmful Algae, 2004, 3(2):141-148.
[17]侯伟,孙韶华,陈求稳,等. 黏土改性技术用于絮凝除藻的研究进展[J]. 生态科学,2014,33(6):12-18.Hou Wei, Sun Shaohua, Chen Qiuwen, et al. Research progress of modified clay flocculating harmful algae[J].Ecological Science, 2014, 33(6): 12-18. (in Chinese with English abstract)
[18]潘君廷,马俊怡,郜天磊,等. 膨润土改善鸡粪厌氧消化产酸产甲烷特性[J]. 农业工程学报,2016,32(8):246-252.Pan Junting, Ma Junyi, Gao Tianlei, et al. Improving production characteristics of methane and organic acid during anaerobic batch digestion of poultry manure by adding bentonite[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016,32(8): 246-252. (in Chinese with English abstract)
[19]卢光远. 改性黏土治理藻华对主要营养元素循环及藻毒素的影响[D]. 青岛:中国科学院(海洋研究所),2014.Lu Guangyuan. Effects of HABs Mitigation by Modified Clay on Major Nutrient Cyclings and Algal Toxins[D].Qingdao: Chinese Academy of Sciences (Institute of Oceanology), 2014. (in Chinese with English abstract)
[20]Wu Z C, Zhu Y, Huang W Y, et al. Evaluation of flocculation induced by pH increase for harvesting microalgae and reuse of flocculated medium[J]. Bioresource Technology, 2012,110(2): 496-502.
[21]Ahmad A L, Yasin N H M, Derek C J C, et al. Optimization of microalgae coagulation process using chitosan[J].Chemical Engineering Journal, 2011, 173(3): 879-882.
[22]Dong C, Chen W, Liu C. Flocculation of algal cells by amphoteric chitosan–based flocculant[J]. Bioresource Technology, 2014, 170(5): 239-247.
[23]吴春笃,侯纯莉,杨峰,等. 海泡石、膨润土改性壳聚糖对景观水絮凝效果的研究[J]. 生态环境学报,2008,17(1):50-54.Wu Chundu, Hou Chunli, Yang Feng, et al. Flocculation effect of sepiolite and bentonite modified chitosan on landscape water[J]. Ecology and Environment, 2008, 17(1):50-54. (in Chinese with English abstract)
[24]杜胜蓝,刘文杰,臧常娟. 壳聚糖—沸石复合体对铜绿微囊藻的去除效果[J]. 水资源保护,2013(4):87-90.Du Shenglan, Liu Wenjie, Zang Changjuan. Removal of microcystis aeruginosa by chitosan–zeolite composite[J].Water Resources Protection, 2013(4): 87-90. (in Chinese with English abstract)
[25]李凯,刘汉湖,周子森. 壳聚糖—海泡石复合黏土去除铜绿微囊藻的试验研究[J]. 供水技术,2017,11(2):11-15.Li Kai, Liu Hanhu, Zhou Zisen. Removal of microcystis aeruginosa by chitosan–sepiolite composite[J]. Water Technology, 2017, 11(2): 11-15. (in Chinese with English abstract)
[26]黄斌,余国忠,栗印环. 沸石去除铜绿微囊藻的试验研究[J]. 信阳师范学院学报(自然科学版),2004,17(4):433-436.Huang Bin, Yu Guozhong, Li Yinhuan. Removing of microcystis aeruginosa by use of zeolite powder[J]. Journal of Xinyang Normal University (Natural Science Edition),2004, 17(4): 433-436. (in Chinese with English abstract)
[27]刘恋,陈兵,王志红. 壳聚糖改性黏土对高藻水中藻类的絮凝去除[J]. 环境工程学报,2010(6):1296-1300.Liu Lian, Chen Bin, Wang Zhihong. Flocculation and removal of algae in algae—bloom water by chitosan—modified clays[J]. Chinese Journal of Environmental Engineering, 2010(6): 1296-1300. (in Chinese with English abstract)
[28]Strand S P, Nordengen T, Ostgaard K. Efficiency of chitosans applied for flocculation of different bacteria[J].Water Research, 2002, 36(19): 4745-4752.
[29]Pan J R, Huang C, Chen S, et al. Evaluation of a modified chitosan biopolymer for coagulation of colloidal particles[J].Colloids & Surfaces A Physicochemical & Engineering Aspects, 1999,147(3): 359-364.
[30]Kubota N, Tatsumoto N, Sano T, et al. A simple preparation of half N–acetylated chitosan highly soluble in water and aqueous organic solvents[J]. Carbohydrate Research, 2000,324(4): 268-274.
