复合微生物预处理玉米秸秆提高其厌氧消化产甲烷性能
2018-08-22黄开明赵立欣姚宗路于佳动
黄开明,赵立欣,冯 晶,姚宗路,于佳动,罗 娟
(农业农村部规划设计研究院,农业农村部农业废弃物能源化利用重点试验室,北京 100125)
0 引 言
中国是农业大国,农作物秸秆资源丰富、种类多样。其中,玉米秸秆年产量约为3.2亿t,合1.6亿t标准煤[1-3]。然而,每年产生的巨量玉米秸秆除了一小部分被用于造纸、纺织、基料、饲料和肥料外,每年约有1亿t玉米秸秆被就地废弃,这不仅造成了资源的严重浪费,而且还会带来严重的环境污染[4]。以玉米秸秆为原料进行厌氧消化,不仅可以解决玉米秸秆因焚烧等处理方式所带来的环境污染问题,还可以为各类沼气工程的运行提供大宗原料来源。但玉米秸秆中含有大量难降解的纤维素、半纤维素和木质素,不易被厌氧微生物所降解和利用,成为制约玉米秸秆为原料生产沼气的一个瓶颈[5]。
玉米秸秆有着致密的组织结构,抗分解能力强,在自然条件下,往往需要很长时间才能被分解,因此如何加速玉米秸秆腐解,使其无害化、资源化,已成为国内外研究的一个热点[6-7]。综合比较各种技术,利用微生物产生纤维素酶来分解和转化纤维素,被认为是纤维素利用的一个有效途径[8]。要利用玉米秸秆为原料厌氧发酵生产沼气,首先需对玉米秸秆进行预处理,以解决玉米秸秆水解酸化问题。目前,国内外对玉米秸秆预处理的研究主要集中在挤压、粉碎、揉搓、蒸汽爆碎、化学制剂处理等几个方面[9]。但利用这些预处理方法处理玉米秸秆,存在能耗高、水耗大,易造成二次污染等诸多实际问题。和这些技术相比,生物预处理具有一定的优势,生物预处理是利用具有生物活性的酶、单一菌株降解玉米秸秆,此方法具有使用能耗低、条件温和、环境友好等优点[10-13]。但生物酶、单一菌株往往只能降解玉米秸秆中的个别成分,降解效果并不十分理想。为此人们将目光转向复合菌系,希望利用复合菌系中不同微生物之间的协同作用,实现含纤维素、半纤维素和木质素类物质的高效转化与利用[14-19]。
目前,研究较多的可降解农作物秸秆的微生物有黑曲霉(Aspergillus)、木霉(Trichoderma)、草酸青霉(Penicillium)和白腐真菌等[8]。黑曲霉、木霉、草酸青霉、白腐真菌分别为可利用不同底物如葡萄糖、丁酸、丙酸等碳水化合物高效降解纤维素和半纤维素的菌株。李砚飞等利用白腐真菌和木霉预处理玉米秸秆产沼气研究,玉米秸秆中木质素质量分数由未处理秸秆的15.2%降低为 7.4%,纤维素质量分数由 31.2%降低到20.1%,产气量比未经预处理秸秆提高11.95%[20];张瑞等利用灰绿草酸青霉、米根霉、白腐菌、黄曲霉和螺孢菌预处理15 g的小麦秸秆,并投入沼气罐中,在37 ℃条件下,进行30 d的厌氧发酵产气研究,较空白对照组提升了181%[19]。
黑曲霉、木霉和草酸青霉都可分泌纤维素酶,这是一种复合酶,由外切β-葡聚糖酶、内切β-葡聚糖酶和β-葡萄糖苷酶等组成,这3种酶共同作用把纤维素降解成葡萄糖;黑曲霉、木霉和草酸青霉降解半纤维素的酶主要也有3种酶:内切酶、外切酶和糖苷酶,这3种酶把半纤维素降解为单糖和糖醛酸[14];白腐真菌是目前发现能同时分解植物聚合物的少数微生物之一,因能产生分解木质素的过氧化物酶,所以它能分解秸秆中的纤维素和木质素,且降解木质素的能力优于降解纤维素的能力[15]。本文利用黑曲霉、木霉、草酸青霉和白腐真菌 4株菌发酵底物的互补性,以期提高玉米秸秆的转化效率,对其进行混合培养,构建了高效产乙酸复合菌系HK-4,通过优化其混合培养条件,并将其应用于沼气厌氧发酵领域,以期实现玉米秸秆的高效利用与转化,为玉米秸秆的资源化利用及农业可持续发展提供新的途径。
1 材料与方法
1.1 试验材料
玉米秸秆:取自河北省张家口市农场,自然晾干,粉碎至粒径为0.7~1 cm,测得总固体TS(total solid)为89.63%,室温储藏备用。
玉米秸秆前处理微生物为黑曲霉(ACCC 30171)、木霉(ACCC 31490)、草酸青霉(ACCC 32576)、黄孢原毛平革菌(CICC 40299),其中,黑曲霉、木霉和草酸青霉购于中国农业微生物菌种保藏管理中心(ACCC),黄孢原毛平革菌购于中国工业微生物菌种保藏管理中心(CICC);牛粪取自河北省三河市华夏畜牧。试验原料和接种物基本性质见表1。

表1 试验原料和接种物基本性质Table 1 Basic properties of experimental materials and inoculating substances
1.2 反应仪器装置
试验的整个过程分为微生物预处理阶段和厌氧发酵产沼气阶段,2个阶段在2个不同的装置内进行。微生物预处理试验阶段试验装置选用容积为2 L广口瓶,管口用无菌过滤透气封口膜密封,橡皮筋勒紧瓶口,固定在摇床中,在28 ℃、180 r/min的条件下进行试验;厌氧发酵产沼气阶段试验选用容积为750 mL的广口瓶,发酵装置固定在恒温水池中,38 ℃静置培养。
SW-CJ-2FD超净工作台(苏州净化设备有限公司)、BSA124S万分之一电子分析天平(梅特勒托利多仪器有限公司)、DZF-6050干燥箱(上海索普仪器有限公司)、QYC-2102C生物培养箱(上海新苗医疗器械制造有限公司)、YXQ-LS-50S立式压力蒸汽灭菌锅(上海博讯仪器有限公司)、DR/5000紫外可见光分光光度计(上海元析仪器有限公司)、便携式pH计(SX-610,上海三信)、便携式沼气成分分析仪(Biogas check,Geotech,英国)、ANTOM 220型纤维素分析仪(北京正方兴达科技发展有限公司,中国)。
1.3 试验方法
1.3.1 培养基
PDA培养基:称取39 g固体的培养基粉末(DifcoTM Potato Dextrose Agar,BD公司)溶于1 L水中,121 ℃灭菌15 min。
发酵培养基:葡萄糖10 g/L、蛋白胨 0.5 g/L、麸皮浸出液20 g/L、硫酸铵1.4 g/L、磷酸氢二钾2 g/L、氯化钙0.3 g/L、硫酸亚铁0.005 g/L、硫酸锰0.001 6 g/L、硫酸锌 0.001 4 g/L、氯化钴 0.002 g/L,蒸馏水定容到1 000 mL(pH 值 6.8±0.2)[12]。
1.3.2 菌剂的制备
孢子悬浮液的制备:将以上菌种活化后移至PDA平板上,于28 ℃培养4~6 d,长满孢子后,用无菌生理盐水将孢子冲洗至三角瓶中,三角瓶中加入灭菌玻璃珠,在200 r/min的振荡器中震荡30 min,取出,利用血球计数板计数,利用无菌蒸馏水调整至每种菌种的孢子数在108mL-1。复合菌剂的制备:将以上菌种的孢子悬浮液按照体积比为1:1:1:1的比例进行混配,制成复合微生物菌系HK-4,复合微生物菌系每种真菌孢子数为108CFU/mL[13]。
1.4 试验设计
复合微生物菌系HK-4生长曲线与发酵液pH值测定试验,在2 L广角瓶中加入400 mL发酵培养基,无菌透气封口膜密封,橡皮筋扎紧瓶口,于121 ℃灭菌15 min,每个三角瓶接种菌液10 mL,设置3个重复,在28 ℃恒温条件下 190 r/min震荡培养15 d,接种后每天测定发酵液的光密度(OD600)和pH值。
复合微生物菌系 HK-4预处理玉米秸秆试验设置微生物预处理组和空白对照组。在2 L广角瓶中加入400 mL发酵培养基,无菌透气封口膜密封,橡皮筋扎紧瓶口,于121 ℃灭菌15 min;将玉米秸秆(0.7~1 cm)30 g,置于1 000 mL的广口瓶中,橡皮筋扎紧瓶口,于121 ℃灭菌15 min,冷却至室温后,在超净工作台中进行混配操作。其中,微生物预处理组将灭菌玉米秸秆加入到灭菌培养基中,每个三角瓶接种菌液10 mL;空白对照组将灭菌玉米秸秆加到灭菌培养基中,2组试验每个处理组有3次重复。在28 ℃恒温条件下 190 r/min震荡培养15 d。接种后每天测定菌液生长量可溶性化学需氧量、可溶性糖含量及总糖含量;每3天测定纤维素、半纤维素和木质素的残余量[14]。
厌氧发酵产沼气阶段的试验原料为微生物预处理过的玉米秸秆、以及未经复合微生物菌系HK-4处理的玉米秸秆,2种秸秆分别捞出,放置烘箱中,110 ℃烘干至恒质量,各称取20 g;新鲜牛粪和秸秆,秸秆∶牛粪=3:1,TS为10%,发酵温度为38 ℃,加水调节有效体积为0.8 L,进行32 d中温厌氧消化批次试验。同时设置未预处理玉米秸秆和牛粪混合组[15]。每组试验设 3个平行,厌氧消化过程中每天记录产气量和气体成分,每天测定发酵液的pH值和产气量等指标。
1.5 分析方法
TS、VS测定参照美国 APHA方法[16]。采用紫外分光光度法测定发酵液的光密度(OD600),使用便携式 pH计监测发酵过程的pH值;采用排水集气法收集气体,每天定时记录量筒测量管中排出的水量,即沼气产量(mL);使用便携式沼气成分分析仪测定沼气中的甲烷体积分数(%);溶解性化学需氧量(soluble chemical oxygen demand,sCOD)的测定采用酸化水解液在4 ℃、3 000 r/min离心10 min,取上清液用COD测定仪测定;可溶性糖测定选用蒽酮硫酸法、总糖测定选用DNS法;纤维素、半纤维素、木质素采用范式洗涤法。
基础数据处理、显著性差异分析基于Microsoft Office 2003软件平台。
2 结果与分析
2.1 微生物预处理
2.1.1 复合微生物菌系HK-4生长曲线与发酵液pH值
由图1可见,接种后,复合菌系HK-4的生长大致分为3个生长阶段,即快速增加、稳定和降低3个阶段性生长阶段。其中,第 0~5 d,曲线斜率最大,这一阶段复合菌系HK-4处于对数生长期,OD600值达到1.71,说明该复合菌系适应能力很强,细胞代谢旺盛,生物量增加量较快;第5~12 d,复合菌系生长进入缓慢増长的稳定期,增殖速度较第0~5 d时降低,OD由1.71缓慢增长到 2.31;12 d以后,可能由于发酵培养基中复合菌系HK-4种间及种内竞争的原因,加剧了食物竞争、环境竞争、空间竞争,复合菌系进入衰弱期,OD600值逐渐下降[17]。复合菌系培养液的pH值呈现先下降后升高的趋势,经过4 d的发酵,发酵液pH值由初始值7.96下降至6.79左右,表明复合菌系HK-4发酵初期产生酸类物质,使pH值快速降低,5 d后发酵液的pH值稳步提高到7.8左右,13 d时,pH值稳定在8.1左右,整个微生物预处理过程中,pH值在6.79~8.28间浮动,表明复合菌系HK-4具有良好的pH值自我调节能力和稳定性,不会造成系统酸化现象[18]。

图1 复合微生物菌系HK-4生长曲线与发酵液pH值Fig.1 Growth curve and pH value of compound microbial strain HK-4
2.1.2 复合微生物菌系 HK-4预处理玉米秸秆发酵液sCOD的动态变化
复杂有机物在厌氧消化过程中,各类挥发性有机酸是主要的代谢中间产物,也是完成产甲烷过程的重要前体基质。本研究所得复合微生物菌系HK-4预处理玉米秸秆发酵液sCOD的变化趋势如图2所示。结果表明,培养的前4 d,培养体系的可溶性化学需氧量呈逐渐降低的趋势。复合微生物接种初期,玉米秸秆中的可溶性有机物和培养基成分使得初始可溶性化学需氧值较高,达到8 210 mg/L;接种复合菌系后,微生物快速繁殖将培养基中的营养物质快速消耗,使得可溶性化学需氧量迅速减小,接种第1 天便迅速降低至6 467 mg/L,到第4 天,降低至4 823 mg/L,呈现出单边下降的趋势,且下降速率较快。另外,随着发酵时间的延长,由于微生物的呼吸作用,底物降解过程中产生的酸会被转化成 CO2,从体系中排除,最终也会导致可溶性化学需氧量的下降[18]。第4~15 天,培养体系的可溶性化学需氧量趋向于平稳,此阶段培养体系中易于降解的可溶性有机物基本降解掉,培养体系中的微生物通过产生胞外酶释放到培养体系中,作用于玉米秸秆,使得秸秆中的纤维素、半纤维素、木质素等难降解的有机物降解成可溶性多糖,菌液中的复合菌系将其利用掉,从而形成这一阶段的 sCOD呈现出总体平稳,波浪往复的可溶性化学需氧量变化情况[18]。

图2 复合微生物菌系HK-4预处理玉米秸秆发酵液可溶性化学需氧量动态Fig.2 Dynamics of soluble COD in pretreatment of corn straw fermentation with composite microbial strain HK-4
2.1.3 复合微生物菌系 HK-4预处理玉米秸秆发酵液可溶性糖含量及总糖含量的动态
由图3可知,复合微生物菌系HK-4预处理玉米秸秆发酵液可溶性糖含量呈波浪形变化趋势,发酵培养第 3天,可溶性糖质量浓度升高至9.71μg/mL,随后迅速降低,然后呈波浪形降低趋势,培养15 d结束时,发酵液可溶性糖质量浓度为1.48μg/mL;复合微生物菌系HK-4发酵液总糖含量随着预处理进行逐渐降低,3 d后趋于稳定。这是由于在发酵过程中的0~10 d,复合菌系HK-4中的组成菌株发生交替生长发酵,协同分解玉米秸秆底物,将其降解成可溶性糖,可溶性糖又被复合菌系利用,从而发酵液中的可溶性糖含量呈现出先上升,然后波浪状上下波动的形态,预处理第10~15 天期间,由于易于降解的纤维素、半纤维素成分基本降解完成,加之复合菌系也由稳定期逐渐进入凋亡期,代谢产物积累,菌种活力下降,因此,这一阶段的发酵液总糖含量呈现下降趋势。发酵第3天总糖质量浓度由初始值0.49 mg/mL降低至0.16 mg/mL,之后的第3~15天趋于稳定。复合微生物菌系HK-4将玉米秸秆分解过程中产生的糖逐渐消耗,而随着培养时间的延长易分解的纤维素物质越来越少,最终导致总糖浓度趋于稳定[20]。

图3 复合微生物菌系HK-4预处理玉米秸秆发酵液可溶性糖质量浓度及总糖质量浓度的动态Fig.3 Dynamics of soluble sugar concentration and total sugar mass concentration in corn straw fermentation broth pretreated by composite microbial strain HK-4
2.1.4 复合微生物菌系 HK-4预处理玉米秸秆木质纤维素降解过程分析
由图4可知,复合微生物菌系HK-4预处理过程中木质素、纤维素、半纤维素的含量都呈现出减少。从结构角度来看,木质素是由对羟苯基丙烷、愈创木基丙烷和紫丁香基丙烷 3种单体组成的复杂芳香族高聚体[21],属于非水溶性难降解物质,说明复合微生物菌系产生了能够降解木质素的胞外酶,作用于玉米秸秆;纤维素是由D-吡喃葡萄糖环彼此经β-1,4-糖苷键,以 C1椅式构象联结而成的线形高分子化合物,具有很高的结晶度和聚合度,同时还被木质素包裹着,与纤维素相比,半纤维素结构较简单,由木糖、甘露糖和半乳糖等组成[22],属于比较容易降解的物质,说明复合微生物菌系产生了能够降解纤维素、半纤维素和木质素的胞外复合酶系,作用于玉米秸秆。李砚飞等利用白腐菌和木霉菌组成的复合菌进行玉米秸秆微生物预处理,纤维素的降解率为35.6[23];姜洁等利用白腐真菌预处理玉米秸秆,纤维素的降解率为58.5%[12]。而本试验研究,微生物预处理组预处理纤维素降解率为64.52%,半纤维素降解率为51.06%,而木质素较难被厌氧微生物利用,它的降解率为3.89%。
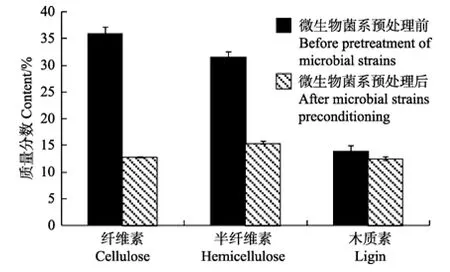
图4 复合微生物菌系HK-4预处理玉米秸秆纤维素、半纤维素和木质素的含量Fig.4 Content of cellulose, hemicelluloses and lignin in corn straw treated by composite microbial strain HK-4
2.2 复合微生物菌系HK-4预处理玉米秸秆对产气的影响
2.2.1 产气潜力
由图5可以看出,玉米秸秆复合微生物菌系HK-4预处理组和空白对照组厌氧发酵产沼气阶段,气潜力差别较大。复合微生物菌系HK-4预处理组和未处理组分别在厌氧发酵第4天及第8天进入产气高峰,峰值分别为287和249 mL/d,产气主要集中在第4~24 天及第6~21 天之间,产气高峰期,复合微生物菌系HK-4预处理组的日产气量维持在 280 mL/d,未处理组日产气量维持在240 mL/d水平。另外,复合微生物菌系HK-4预处理组产气过程中呈现出多个不规则产气高峰,原因可能是由于发酵过程中,当挥发性脂肪酸酸(volatile fatty acids)的产生速度大于其消耗速度时,导致挥发性脂肪酸累积,从而影响了原料的产气效果,之后随着VFA的消耗,解除了挥发酸所产生的抑制,复杂有机物逐渐被厌氧菌群消化,产气能力恢复,产气量升高[24]。但由于复杂有机物降解难易程度不同,当大分子有机质水解、产酸的速率与产甲烷速率不能保持平衡时,则造成沼气日产气量呈现上下起伏状的变化[25]。

图5 厌氧发酵日产气量Fig.5 Anaerobic fermentation of daily gas production
经复合微生物菌系 HK-4预处理组和未经处理的玉米秸秆与牛粪混合厌氧消化32 d,累积产气量(见图6)分别为7 364和5 347 mL,差异极显著(P<0.01=;单位干质量产气量为294.6和213.9 mL/g。李砚飞等利用白腐菌和木霉菌组成的复合菌进行玉米秸秆微生物预处理,产气量可比未经预处理秸秆的产气量提高11.95%[23];万楚筠等利用包含有枯草芽胞杆菌(Bacillus Subtilis)、地衣芽胞杆菌(Bacillus Licheniformis)、克鲁斯酵母菌(Canadian krusei)、变色栓菌(Trametes versicolor)和黄孢原毛平革菌(Phaerochaete chrysosporium)等微生物菌种的秸秆高效降解混合菌剂处理油菜秸秆,发现预处理后的秸秆累计产气量提高了17.8%[26]。本研究微生物预处理组比未处理组高了27.4%,产气高峰期甲烷体积分数提高了33%,效果明显。此外,由图6也可看出微生物预处理组产气量在厌氧消化前24天增长迅速,24 d之后逐渐变慢,表明产气高峰结束。由此可见,复合微生物菌系HK-4预处理过的玉米秸秆累积产气量明显提高,消化速率也得到大幅提升。
2.2.3 产气甲烷含量
各试验组日产甲烷体积分数变化如图 7所示。在厌氧消化过程中,2个试验组甲烷体积分数的波动规律基本一致,都呈现出先缓慢增加后趋于稳定的趋势[24]。复合微生物菌系HK-4预处理组,厌氧消化的第4天,CH4体积分数就快速提升到40%以上,之后20 d在45%~53%之间波动,说明此时段营养物质充足,消化体系内甲烷菌的活性得到了很大的提升。而未预处理组测得的 CH4含量相对较低,到第6天才升到36.7%以上,之后20 d,基本在26%~36%之间变动,随后开始下降。与复合微生物菌条HK-4预处理组相比,空白对照组发酵产气速率增长缓慢,原料转化及甲烷产生率低,秸秆利用效率差[27]。

图6 厌氧发酵累积产气量Fig.6 Accumulative gas production in anaerobic fermentation
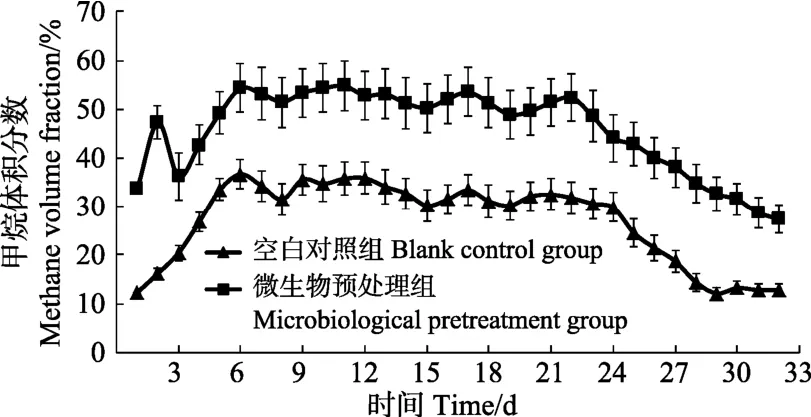
图7 厌氧发酵甲烷含量动态Fig.7 Methane content dynamics in anaerobic fermentation
3 结 论
玉米秸秆经复合微生物菌系HK-4在28 ℃处理14 d,纤维素、半纤维素和木质素的降解率分别可达64.52%、51.06%和3.89%,对复合微生物菌系HK-4处理过的玉米秸秆进行厌氧发酵产沼气研究,发现复合微生物菌系HK-4预处理过的玉米秸秆厌氧发酵产沼气,累积产气量明显提高,经过 32 d的厌氧发酵,累积产气量提高了27.4%,产气高峰期甲烷含量提高了33%。
综上,复合微生物菌系 HK-4对玉米秸秆中的纤维素、半纤维素拥有很好的水解效果,实现了在较低温度下获得较高的秸秆降解率,使用复合微生物菌系HK-4预处理过的玉米秸秆用于厌氧发酵产沼气,可有效提高日产气量及甲烷含量,是一种经济高效的预处理方法,为寒区秸秆资源化利用提供了新的微生物资源和方法。
[1]国家统计局. 2017年中国统计年鉴[M]. 北京:中国统计出版社,2017.
[2]陈羚,赵立欣,董保成,等. 我国秸秆沼气工程发展现状与趋势[J]. 可再生能源,2010,28(3):145-148.Chen Ling, Zhao Lixin, Dong Baocheng, et al. The status and trends of the development of biogas plants for crop straws in China[J]. Renewable Energy Resources, 2010, 28(3): 145-148.(in Chinese with English abstract)
[3]叶安珊. 我国农业废弃物资源化问题探讨[J]. 产经评论,2008(6):29-31.Ye Anshan. Discussion on the problem of agricultural waste resources in China[J]. Forum on Industrial Economy, 2008(6):29-31. (in Chinese with English abstract)
[4]熊菊芬. 农作物秸秆资源化利用效果试验[J]. 农业与技术,2017,37(14):51-53.Xiong Jufen. Experiment on utilization effect of crop straw resource utilization[J]. Agriculture and Technology, 2017,37(14): 51-53. (in Chinese with English abstract)
[5]Neshat S A, Mohammadi M, Najafpour G D, et al. Anaerobic co-digestion of animal manures and lignocellulosic residues as a potent approach for sustainable biogas production[J].Renewable & Sustainable Energy Reviews, 2017, 79: 308-322.
[6]Awasthi S K, Joshi R, Dhar H, et al. Improving methane yield and quality via co-digestion of cow dung mixed with food waste[J]. Bioresource Technology, 2017, 251: 259.
[7]Fu P, Yi W, Li Z, et al. Evolution of char structural features during fast pyrolysis of corn straw with solid heat carriers in a novel V-shaped down tube reactor[J]. Energy Conversion &Management, 2017, 149: 570-578.
[8]Bao L, Huang Q, Chang L, et al. Screening and characterization of a cellulase with endocellulase and exocellulase activity from yak rumen metagenome[J]. Journal of Molecular Catalysis B Enzymatic, 2011, 73(1): 104-110.
[9]Patinvoh R J, Osadolor O A, Chandolias K, et al. Innovative pretreatment strategies for biogas production[J]. Bioresource Technology, 2016, 224:13-24.
[10]张红莲,郭爱莲,何钧,等. 采用阶段处理和多菌种固态发酵玉米秸秆的研究[J]. 西北大学学报:自然科学版,2004,34(6):691-694.Zhang Honglian, Guo Ailian, He Yun, et al. A study on utilizing stage process and the multi-strains solid state fermentation for corn straw[J]. Journal of Northwest University: Natural Science Edition, 2004, 34(6): 691-694.(in Chinese with English abstract)
[11]Wang M, Zhou J, Yuan Y X, et al. Methane production characteristics and microbial community dynamics of monodigestion and co-digestion using corn stalk and pig manure[J].International Journal of Hydrogen Energy, 2017, 42(8):4893-4901.
[12]姜洁. 玉米秸秆微生物预处理工艺筛选[D]. 重庆:西南大学,2010.Jiang Jie. Screening of Microbial Pretreatment Technology for Maize Straw[D]. Chongqing: Southwestern University,2010. (in Chinese with English abstract)
[13]黄永春,彭祎,谭悠久. 链霉菌单孢子悬液制备方法:CN101418278[P]. 2009.
[14]任南琪,马方. 污染控制微生物学[M]. 哈尔滨:哈尔滨工业大学出版社,2002.
[15]陈子爱,邓小晨. 微生物处理利用秸杆的研究进展[J]. 中国沼气,2006,24(3):31-35.Chen Ziai, Deng Xiaochen. Progress in microbiologic utilization technology of crop straw[J]. China Biogas, 2006,24(3): 31-35. (in Chinese with English abstract)
[16]APHA. Standard Methods for the Examination of Water and Wastewater[M]. American Public Health Association,Washington, DC, USA, 2005.
[17]胡宝龙,林勇. 微生物生长量测定系统[J]. 试验技术与管理,1995(4): 49-50.Hu Baolong, Lin Yong. Microbiological growth measurement system[J]. Experimental Technology and Management, 1995(4):49-50. (in Chinese with English abstract)
[18]青格尔,高聚林,于晓芳,等. 玉米秸秆低温高效降解复合菌系GF-20的菌种组成及降解稳定性研究[J]. 中国农业科学,2016,49(3):443-454.Qing Geer, Gao Julin, Yu Xiaofang, et al. Function and composition stability of a composite microbial system GF-20 with efficient corn stalk decomposition under low temperature[J]. Scientia Agricultura Sinica, 2016, 49(3): 443-454. (in Chinese with English abstract)
[19]张瑞,张熠依,田昆鹏,等. 秸秆沼气发酵预处理微生物菌剂的筛选与特征研究[J]. 安徽农业科学,2014(11):3334-3337.Zhang Rui, Zhang Yiyi, Tian Kunpeng, et al. Research on the microbial agents for pretreatment of biogas fermentation[J].Journal of Anhui Agricultural Sciences, 2014(11): 3334-3337. (in Chinese with English abstract)
[20]王寒. 玉米秸秆的青贮及水解方法的研究[D]. 天津大学,2012.Wang Han. The Research on Silage and Hydrolysis Methods of Corn Stalk[D]. Tianjin: Tianjin University, 2012. (in Chinese with English abstract)
[21]Wang H, Frits P D V, Jin Y. A win-win technique of stabilizing sand dune and purifying paper mill black-liquor[J].Acta Scientiae Circumstantiae (English Edition), 2009, 21(4):488-493.
[22]李海红,王巧,袁月,等. 一组高温混合菌对木质素纤维素的降解[J]. 西安工程大学学报,2013,27(1):83-87.Li Haihong, Wang Qiao, Yuan Yue, et al. A high-temperature composite microbe for degrading of lignin and cellulose[J].Journal of Xi’an Polytechnic University, 2013, 27(1): 83-87.(in Chinese with English abstract)
[23]李砚飞,黄亚丽,代树智,等. 复合微生物预处理玉米秸秆产沼气的试验研究[J]. 可再生能源,2013,31(5):80-83.Li Yanfei, Huang Yali, Dai Shuzhi, et al. Experimental study of compound microoriganism pre-treatment to enhance straw anaerobic digestion[J]. Renewable Energy Resources, 2013,31(5): 80-83. (in Chinese with English abstract)
[24]陈中玉. 玉米秸秆预处理及与剩余污泥混合厌氧消化研究[D]. 天津:天津大学,2010.Chen Zhongyu. Pretreatment of Corn Stalk and Anaerobic Digestion with Excess Sludge[D]. Tianjin: Tianjin University,2010. (in Chinese with English abstract)
[25]Zhou S, Zhang Y, Dong Y. Pretreatment for biogas production by anaerobic fermentation of mixed corn stover and cow dung[J]. Energy, 2012, 46(1): 644-648.
[26]万楚筠,黄凤洪,刘睿,等. 微生物预处理油菜秸秆对提高沼气产量的影响[J]. 农业工程学报,2010,26(6):267-271.Wan Chuyun, Huang Fenghong, Liu Rui, et al. Effect on increasing biogas production using rape straw by microbiological pretreatment[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2010, 26(6): 267-271. (in Chinese with English abstract)
[27]魏域芳,李秀金,刘研萍,等. 不同预处理玉米秸秆与牛粪混合厌氧消化产气性能比较[J]. 中国沼气,2016,34(2):36-40.Wei Yufang, Li Xiujin, Liu Yanping, et al. Comparison of biogas production performance of anaerobic digestion of corn straw and cow manure with different pretreatment[J]. China Biogas, 2016, 34(2): 36-40. (in Chinese with English abstract)
