繁殖期与非繁殖期麝鼠香腺中Atg2a和Atg9b基因转录水平分析
2018-08-21吕鹏博钱鑫慧张博文白素英
张 宇 吕鹏博 钱鑫慧 张博文 白素英
(东北林业大学野生动物资源学院,哈尔滨,150040)
麝鼠(Ondatrazibethicus)又称青根貂,20世纪50年代末引入中国。成年的雄性麝鼠下腹部背皮与肌肉间有一对香腺,繁殖期(每年3~10月)时能够分泌麝鼠香[1]。麝鼠香的药理作用与天然麝香相近,具有成为天然麝香替代品的巨大潜力,具有很高的经济价值。目前,麝鼠的相关研究尚处于初级阶段,大多集中于组织形态学观察、分类与进化、毛皮和麝鼠香的药用价值等方面,对麝鼠香腺发育调节的研究有待深入。细胞自噬泛指溶酶体介导的细胞自身降解过程,借以维持细胞本身的代谢需要和对某些细胞器的更新[2]。自噬体是由单层或双层膜包裹待降解物所形成,其出现是自噬过程中的关键阶段,自噬系统的平衡对维持机体正常生理状态起到重要调节作用[3]。细胞自噬的分子机制中涉及多种自噬相关蛋白,Atg9(autophagy-related protein 9,自噬相关蛋白9)是其中唯一的跨膜蛋白。自噬过程中Atg9蛋白在外周膜与PAS(pre-autophagosomal structure,自噬前体结构,为自噬体组装位点)间往返循环,因此Atg9被认为可能具有“膜载体”的作用,对自噬体形成具有重要意义。Atg9由PAS返回外周膜的过程称为Atg9的逆向运输,目前公认的观点是Atg2-Atg18复合体与Atg9蛋白相互作用,促使Atg9蛋白逆向运输的发生[4]。因此Atg2和Atg9基因的转录水平可以从一定程度上反应细胞发生自噬的程度[5-6]。本研究以此为切入点,通过荧光定量PCR技术比较麝鼠Atg2a和Atg9b基因在香腺繁殖期与非繁殖期的转录水平差异,并探讨麝鼠香腺的发育与细胞自噬之间的潜在关系。
1 材料与方法
1.1 实验动物
分别于4月末(繁殖期)和10月末(非繁殖期)于哈尔滨市呼兰区麝鼠养殖场购买体况相近的1岁龄成年雄性麝鼠共计6只,繁殖期3只,非繁殖期3只。将麝鼠保定后乙醚吸入麻醉,采集左右两侧香腺并立即投入液氮中速冻,后转至-80℃超低温冰箱中保存。
1.2 RNA提取与反转录
将上述组织于液氮下快速研磨,利用RNA提取试剂盒(thermo scientific,USA)提取总RNA。利用DNase I消化总RNA中的DNA残留,并重新用试剂盒中提供的纯化柱纯化RNA。利用1.4%琼脂糖凝胶电泳检测总RNA完整性,RNA质量检测完成后进行反转录。反转录体系参照反转录试剂盒(Invitrogen,USA)说明书。反转录程序为42℃ 60 min,70℃ 5 min。
1.3 Atg2a和Atg9b基因转录水平RT-qPCR检测
Atg2a基因和Atg9b基因的mRNA序列在前期RNA-seq测序研究中已获得(待发表),利用Primer Premier Ver 6.0软件设计引物,内参基因选择β-肌动蛋白(β-actin)基因,内参基因的引物参考文献[7],引物序列见表1。RT-qPCR反应组分为:cDNA模板2 μL,上下游引物(10 μmol/μL)各0.2 μL,2x SYBR GREEN I Supermix(BIO-RAD)10 μL,7.6 μL H2O补足20 μL体系。扩增程序为:98℃ 30 s;98℃ 10 s,60℃ 1 min 40个循环,退火时收集荧光信号,熔解曲线为Bio-Rad CFX96默认程序。利用2-ΔΔCT法计算表达差异倍数,结果经t-检验分析,P≤0.05认为差异显著。
表1 本文所用的引物信息

Tab.1 Primers used in this study
2 结果与分析
2.1 RNA质量检测
总RNA经琼脂糖凝胶电泳后,28SrRNA 和18SrRNA分离彻底、条带清晰,28S条带亮度约为18S条带亮度的2倍,未见明显弥散降解(图1)。RNA质量良好,可用于下游实验分析。

图1 总RNA电泳结果Fig.1 Total RNA electrophoretic results
2.2 Atg2a和Atg9b基因转录水平检测结果
RT-qPCR检测结果发现,麝鼠Atg2a和Atg9b基因在香腺繁殖期和非繁殖期中的转录水平都出现了显著的差异。非繁殖期时麝鼠香腺中Atg2a基因的转录水平约为繁殖期时的43.7倍,Atg9b基因的转录水平约为繁殖期的16.6倍,转录水平差异显著(P≤0.05)(图2)。熔解曲线结果显示未出现明显非特异性扩增(图3和图4)。
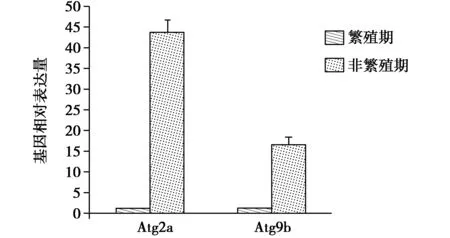
图2 繁殖期与非繁殖期Atg2a基因和Atg9b基因转录水平差异Fig.2 Differences in transcriptional levels of Atg2a and Atg9b genes in breeding and non-breeding stages

图3 Atg2a基因熔解曲线Fig.3 Melting curve of Atg2a gene

图4 Atg9b基因熔解曲线Fig.4 Melting curve of Atg9b gene
3 讨论
通过RT-qPCR对繁殖期与非繁殖期的麝鼠香腺Atg2a基因和Atg9b基因的转录水平进行检测,结果发现二者的转录水平都表现为非繁殖期显著高于繁殖期。因此,推测麝鼠在非繁殖期时香腺组织细胞的自噬水平高于繁殖期,原因可能有以下两点:
首先麝鼠的香腺随着繁殖期和非繁殖期周期性的发育和萎缩,本研究中10月末的样品正处于麝鼠香腺组织快速萎缩过程,结合实验结果推测,麝鼠香腺萎缩的过程中,自噬机制起到了重要作用。自噬被认为是Ⅱ型程序性细胞死亡,通过提高香腺细胞的自噬水平,细胞出现过度降解自身细胞器的现象,协同凋亡信号相关信号通路诱导的细胞凋亡过程,使香腺细胞大量程序性死亡,导致麝鼠香腺非繁殖期时的快速萎缩。研究证明细胞自噬的发生受到PI3K/AKT信号转导通路的调控[8],同时雄激素具有激活PI3K/AKT通路的作用,非繁殖期时麝鼠睾丸快速萎缩,雄激素水平降低,这可能是诱导香腺细胞自噬水平上升的重要原因。
Zhang等的研究发现麝鼠的香腺与睾丸存在协同发育关系,且雄激素水平对麝鼠香腺组织的发育有显著影响[9],该推测可以很好地从分子机制方面解释这一现象。另外,麝鼠的非繁殖期为10月末至翌年3月。该时期食物相对匮乏,在饥饿应答作用下麝鼠自噬水平整体提高。本研究中未涉及麝鼠香腺以外的其他器官,后续试验中会进一步验证麝鼠在繁殖期和非繁殖期整体自噬水平的变化情况。
麝鼠香腺发育机制的研究尚处于摸索阶段,很多分子机制尚待发掘,阐明麝鼠香腺的发育机制和其泌香机制是未来麝鼠相关研究的重点,也是未来更好发展麝鼠养殖产业的理论基础。
