阻塞性睡眠呼吸暂停患者默认网络功能连接及拓扑属性异常
2018-08-21陈立婷彭德昌李海军叶成龙余宏辉辛会珍龚洪翰
陈立婷,彭德昌,李 健,李海军,叶成龙,余宏辉,辛会珍,龚洪翰
(南昌大学第一附属医院影像科,江西 南昌 330006)
阻塞性睡眠呼吸暂停(obstructive sleep apnea, OSA)是一种常见的睡眠紊乱相关疾病,因睡眠期间反复上呼吸道阻塞引起呼吸暂停或低通气,导致睡眠片段化、反复微觉醒、慢性间歇性低氧血症及高碳酸血症,从而损害患者情绪、认知功能等,影响工作生活质量。功能连接(functional connectivity, FC)指空间上分离的脑区之间神经元自发活动的时间上的关联性,被广泛运用于脑功能障碍研究[1-2]。OSA患者脑默认网络(default mode network, DMN)内部存在广泛的FC异常并与认知功能损害相关[3],且其大尺度结构脑网络和功能脑网络均存在小世界属性,但其拓扑特性存在异常[4-5]。本研究采用FC及图论分析技术检测静息状态下OSA患者DMN内部FC和网络拓扑属性的改变及其与临床参数的相关性。
1 资料与方法
1.1 一般资料 收集2014年3月—2017年4月我院经睡眠检测确诊的未经治疗的40例男性重度OSA患者(OSA组),年龄22~65岁,平均(37.8±9.8)岁。收集同期年龄、教育程度相匹配的睡眠正常的男性志愿者43名(对照组),年龄24~64岁,平均(38.8±11.9)岁。受试者均为右利手。OSA诊断标准根据中华医学会呼吸病学分会睡眠呼吸障碍学组2011年修订的《阻塞性睡眠呼吸暂停低通气综合征诊治指南》[6],呼吸紊乱指数(apnea hyponea index, AHI)≥30次/小时,对照组AHI均<5次/小时。排除标准:①除OSA外其他睡眠相关疾病,如原发性失眠、不宁腿综合征等;②颅内器质性病变、神经退行性疾病、癫痫、脑外伤、抑郁症等中枢神经系统疾病;③高血压、糖尿病病史;④酗酒、滥用违禁药物、服用精神类药物病史等;⑤MR检查禁忌证。本研究经我院医学伦理委员会批准,所有受试者均自愿参加并签署知情同意书。
1.2 仪器与方法 采用Siemens Trio Tim 3.0T MR扫描仪,8通道头线圈,梯度场强40 mT/m。先行常规MR检查,除外颅内器质性病变。采集静息态fMRI时嘱受试者放松,平静闭目平躺,避免系统性思考,并采用沙袋固定头部以减少头动,佩戴耳塞、眼罩等减少外部条件的干扰;采用梯度平面回波序列,TR 2 000 ms,TE 40 ms,翻转角90°,FOV 230 mm×230 mm,矩阵64×64,层厚4.0 mm,层间距1.2 mm,连续扫描30层,扫描时间8 min 6 s。三维高分辨T1WI解剖图像采用SPGR序列,TR 1 900 ms,TE 2.26 ms,FOV 250 mm×250 mm,矩阵256×256,层厚1.0 mm,无层间距,共扫描176层。
1.3 数据分析
1.3.1 数据预处理 基于Matlab 2014a平台,采用DPARSF V2.3软件包对fMRI原始数据进行预处理。①格式转换,将图像DICOM格式转换为NIFTI格式;②去除前10个时间点数据;③时间层校正和头动校正,剔除三维平移超过1.5 mm或三维旋转超过1.5°的受试者数据;④空间标准化,将功能像配准到T1WI解剖像上,并配准到蒙特利尔神经学研究所(Montreal Neurological Institute, MNI)模板,重采样大小为3 mm×3 mm×3 mm;⑤平滑,以6 mm全宽半高的高斯核进行空间平滑;⑥去线性漂移和低频滤波;⑦回归协变量,去除脑白质、脑脊液、全脑信号及头动参数信号等因素的干扰。
1.3.2 构建DMN相关矩阵 采用GRETNA工具包(http://www.nitrc.org/projects/gretna/)[7]进行DMN网络构建和拓扑学属性分析。根据经典的DMN亚区提取方法[8],选取20个功能与解剖分区基本一致的DMN脑区作为节点(ROI,表1),以半径6 mm的球形提取各ROI的平均时间序列,计算其Pearson相关系数,构建20×20的二值化相关矩阵,计算DMN内部各脑区之间的FC值和小世界网络参数,并对比组间差异。DMN异常的FC值定义为所有有差异的DMN亚区FC值的平均值[9]。
在稀疏度为0.05~0.50、步长为0.01的水平下,以AUC计算整体网络属性参数,包括:①小世界指数(σ),小世界网络具有较短的特征性最短路径长度(Lp)和较高的聚类系数(Cp),当实际脑网络符合归一化聚类系数(γ=实际网络Cp/随机网络Cp)>1和归一化特征路径长度(λ=实际网络Lp/随机网络Lp)≈1,或σ(σ=γ/λ)>1,则被认为具有小世界网络;②网络全局效率(global efficiency, Eglob),度量网络的整体信息传输能力;③网络局部效率(local efficiency, Eloc),衡量网络局部信息传输能力及网络错误容忍度[10]。
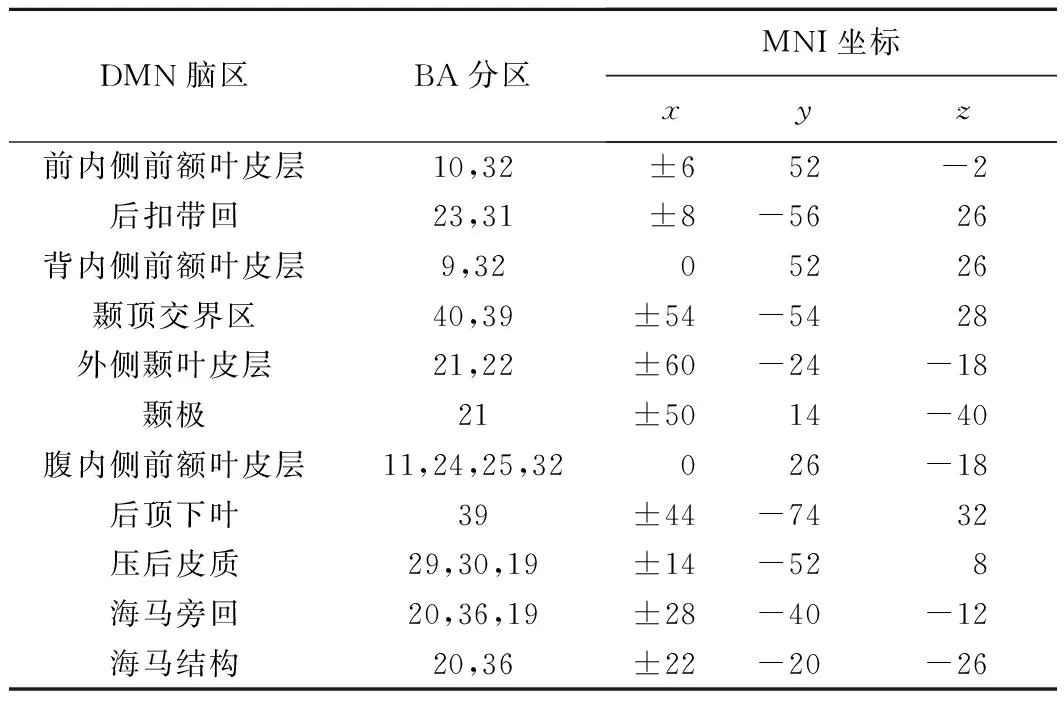
表1 20个DMN脑区节点分布
注:BA分区:布罗德曼分区(Brodmann Areas);+:右侧,-:左侧
1.4 临床资料 所有受试者均在我院呼吸科睡眠监测室接受7 h以上的睡眠监测,检查当天禁止服用睡眠相关药物、饮酒及含咖啡因的饮料等。采用Alice 5 LE睡眠系统记录标准脑电图、肌电图、心电图、血氧饱和度、口鼻气流、鼾声等项目,并根据检测结果计算AHI、动脉血氧饱和度(SaO2)、微觉醒指数(arousal index, AI)、氧减指数、睡眠效率等睡眠相关指标。所有受试者均接受蒙特利尔认知量表(Montreal cognitive assessment, MoCA)和爱泼沃斯嗜睡量表(Epworth sleepiness scale, ESS)测试,以评估认知功能和白天嗜睡情况。
1.5 统计学分析 采用SPSS 20.0统计分析软件。计量资料用±s表示,以独立样本t检验比较OSA组与对照组间临床资料及量表评分的差异。以年龄、体质量指数、头动、受教育年限等影响因素作为协变量,采用双独立样本t检验对比分析网络整体属性的AUC值和DMN各亚区FC值的组间差异。网络属性参数与DMN异常FC值、临床指标之间的相关性采用偏相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 临床资料 OSA组与对照组年龄、受教育程度、头动差异均无统计学意义(P均>0.05)。与对照组比较,OSA组体质量指数、AHI、AI、氧减指数、ESS评分增高,睡眠效率、最低SaO2、MoCA评分减低(P均<0.05),见表2。
2.2 DMN亚区FC值 与对照组比较,OSA组双侧后扣带回—双侧海马、左后扣带回—左压后皮质、左颞极—背内侧前额叶皮层、左颞极—左颞顶交界区、左压后皮质—双侧前内侧前额叶皮层、左压后皮质—左后顶下叶、双侧海马—双侧压后皮质、右海马—右颞顶交界区、右海马—右后顶下叶的FC值显著减低,右颞极—右海马旁回,左海马—右海马FC值显著增高(P均<0.05),见表3、图1。
2.3 DMN网络属性参数 在稀疏度为0.05~0.50范围内,OSA组和对照组DMN的小世界指数σ均>1,提示所有受试者DMN均具有小世界属性。OSA组DMN的Eloc的AUC值显著低于对照组(t=-2.45,P=0.02),2组间Eglob的AUC值差异无统计学意义(t=-0.34,P=0.73),见图2。
2.4 相关性分析 OSA组DMN异常FC值与MoCA量表评分呈负相关(r=-0.453,P=0.006)、与Eglob值(r=-0.736,P<0.001)和最低SaO2(r=-0.346,P=0.039)呈负相关。
3 讨论
性别、焦虑、抑郁等因素可影响静息状态下的脑自发活动[11],且女性更易伴焦虑或抑郁。为避免以上因素的干扰,本研究仅招募男性受试者。
DMN包括内侧前额叶、后扣带回、颞上回、顶下小叶等脑区,其主要功能是维持人脑静息状态下最基本的认知活动,感知外界信息和监控自我行为的精神状态等,与自传体记忆、自我参照加工、短期记忆等认知功能相关[8]。DMN功能障碍与认知功能损害关系密切,间歇性缺氧是导致OSA患者DMN功能损害的主要因素[3,12]。小世界网络介于规则网络与随机网络之间,兼有较高Cp和较短特征性Lp的拓扑优势,反映其功能分离和功能整合的特性,从而保证网络在局部和全局水平高效而低耗能的信息交流[10]。
表2 OSA组与对照组临床资料比较(±s)

表2 OSA组与对照组临床资料比较(±s)
组别年龄(岁)受教育程度(年)体质量指数(kg/m2)AHI(次/小时)睡眠效率(%)AI(/h)OSA组(n=40)37.8±9.812.53±2.5727.35±3.3158.60±20.4483.08±18.7439.32±23.84对照组(n=43)38.8±11.912.21±2.8222.96±1.912.38±1.1492.19±5.7912.02±2.68t值-0.430.537.4718.01-3.047.46P值0.6670.596<0.001<0.0010.003<0.001组别氧减指数最低SaO2(%)MoCA评分(分)ESS评分(分)头动(mm)OSA组(n=40)56.74±24.1766.05±12.7224.98±2.1212.28±4.030.06±0.38对照组(n=43)2.90±1.4290.40±2.9727.77±1.393.40±2.160.05±0.03t值14.58-12.2-7.1412.631.89P值<0.001<0.001<0.001<0.0010.061
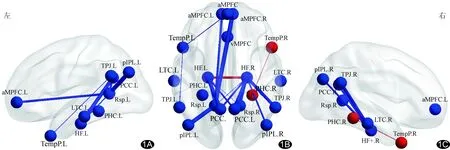
图1 OSA组与对照组DMN内亚区FC异常示意图 A.左侧观; B.底面观; C.右侧观 (蓝线:与对照组比较,FC减低;红线:与对照组比较,FC值增高;t值越大,线越粗;aMPFC:前内侧前额叶皮层;PCC:后扣带回;dMPFC:背内侧前额叶皮层;TPJ:颞顶交界区;LTC:外侧颞叶皮层;TempP:颞极;vMPFC:腹内侧前额叶皮层;pIPL:后顶下叶;Rsp:压后皮质;PHC:海马旁回;HF:海马结构;L:左;R:右)

图2 OSA组与对照组脑网络效率AUC比较 A.Eloc; B.Eglob
本研究发现OSA组前—后DMN的FC显著降低,主要位于前额叶、顶叶和颞叶等脑区。既往研究[13-15]发现OSA患者腹侧前额叶、背侧前额叶、海马、颞叶、扣带回等主要涉及焦虑和抑郁的脑区存在功能、结构损害。海马是DMN的核心脑区和边缘系统的核心子区域,与学习、记忆等认知功能的神经处理密切相关,并对缺氧损害敏感。OSA患者海马功能网络连接紊乱,与广泛大脑皮层/皮层下脑区FC存在异常[13],且海马损害与OSA患者抑郁密切相关。本研究中,海马主要与后扣带回、压后皮质、右颞顶交界区、右后顶下叶等脑区存在FC异常,推测海马FC异常可能是导致OSA患者焦虑、抑郁等情感和认知缺陷的关键因素。后扣带回和海马是正常情景记忆能力的基础,二者在功能及解剖结构上紧密联系,其FC减低与延迟记忆能力关系密切[3]。本研究OSA患者双侧海马—扣带回FC值减低,推测其为导致延迟记忆能力减低的重要原因。
本研究中,OSA患者前—后DMN的FC减低,提示OSA患者不同DMN区域间的信息传播和长距离连通性整合可能受损,而Eglob并无明显受损。Eglob反映远距离大脑皮层/皮层下脑区之间的信息传递效率。上述结果提示OSA并未损害患者DMN的全局信息传递效率和功能整合,可能与DMN为脑网络信息交流、整合的核心区域及功能代偿有关。此外,本研究还观察到后DMN的FC显著降低,主要包括颞叶、顶叶、后扣带回、海马等边缘系统脑区。
本研究发现OSA组和对照组的DMN均符合小世界属性,提示OSA患者的DMN在局部和整体水平上仍呈现出信息传递的高效性和低耗能性;但OSA患者DMN网络属性存在异常改变,主要表现为Eloc减低。Eloc主要反映局部网络信息处理效率、容错能力,推测OSA患者DMN脆性较高,区域信息处理、传递效率减低,容错能力下降。Eloc还反映相邻脑区之间的短距离FC,因此推测OSA患者后DMN的FC异常改变,使DMN相邻脑区的连通性减低或中断,从而导致Eloc减低,与既往研究[4-5]结果一致。Park等[16]发现OSA患者全脑各区域存在广泛的异常FC,且与OSA患者全脑拓扑特性重组密切相关。本研究结果表明DMN异常FC与Eglob呈负相关,推测DMN异常FC可能与DMN的拓扑重构紧密相关,且与MoCA评分呈负相关,提示DMN的FC异常与OSA患者认知功能损害密切相关。因此,DMN内部各亚区FC异常可能是OSA患者认知功能受损和DMN拓扑属性异常改变的潜在神经病理学机制。本研究OSA患者Eglob与最低SaO2呈负相关,提示慢性间歇性缺氧是影响OSA患者DMN的Eglob的重要因素。
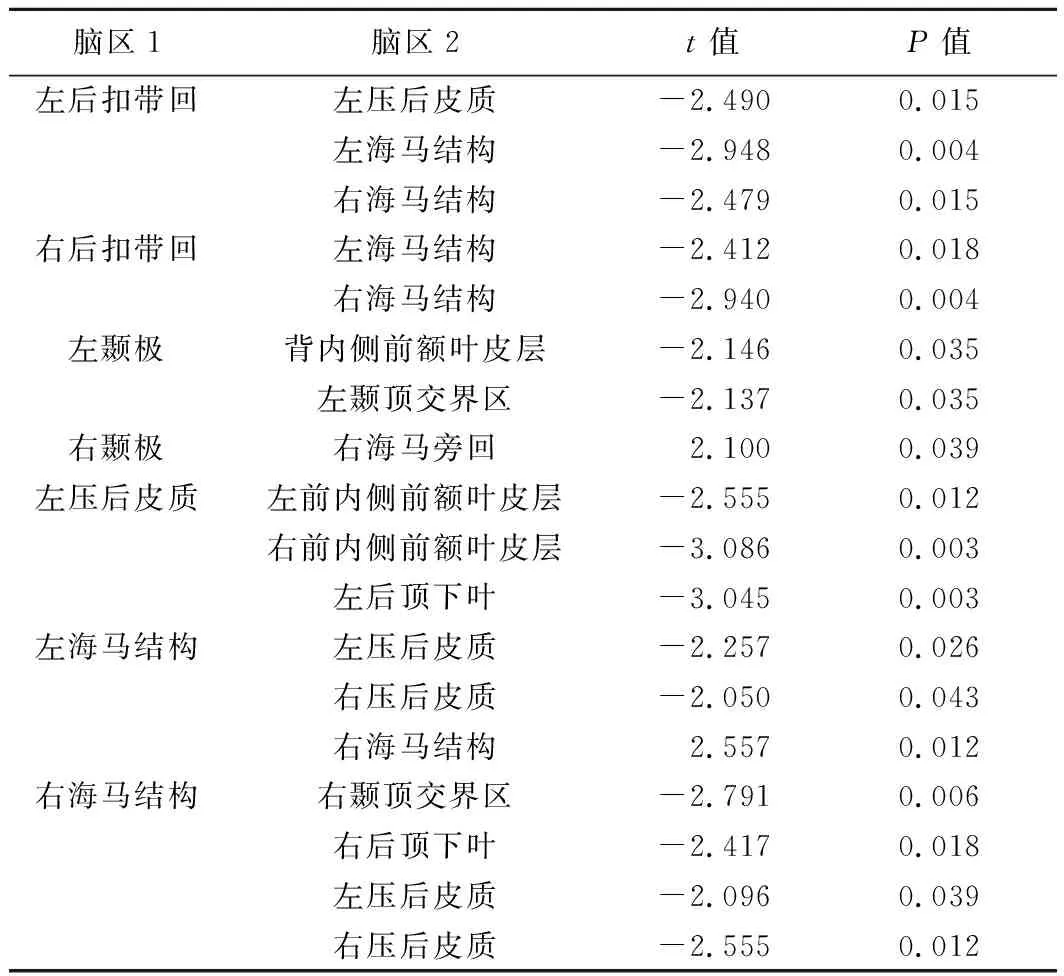
表3 OSA组与对照组DMN内FC异常的脑区
本研究的不足:①仅分析了OSA患者DMN内各亚区的FC及小世界属性,OSA还损害凸显网络、中央执行网络,而对于这些网络是否存在改变、网络内部之间的关系尚需进一步研究;②本研究DMN内部异常FC、网络拓扑属性结果并未经多重比较校正;③未对不同程度、不同性别间OSA患者进行对照分析。
综上所述,本研究采用静息态FC技术及图论的分析方法发现OSA患者DMN具有小世界属性,但Eloc减低,OSA患者DMN内部各亚区FC异常,且DMN异常FC与DMN拓扑属性密切相关,表明OSA患者DMN各亚区的神经生理活动环路受损,进而导致DMN拓扑属性重构、认知功能损害,为理解OSA患者认知、情感障碍的神经影像学机制提供了新的视角。
