心肌特异性导向肽靶向诊疗造影剂增强心肌分子显影及其在大鼠体内的分布
2018-08-21赵雪丽王志刚冉海涛刘丽文
赵雪丽,罗 文,王志刚,冉海涛,刘丽文*
(1.空军军医大学第一附属医院超声科,陕西 西安 710032;2.重庆医科大学超声影像学研究所,重庆 400010)
液态氟碳纳米探针是一种新型超声造影剂,可在低强度聚焦超声(low intensity of focused ultrasound, LIFU)作用下发生液—气相变形成微泡,从而增强超声显像,并可通过LIFU激发促使纳米探针相变至爆破,达到靶向释药目的,目前相关研究[1-4]多集中于对肿瘤的治疗,针对心脏疾病的研究较少。心肌特异性导向肽(primary cardiomyocyte specific peptide, PCM)是由20个氨基酸(WLSEAGPVVTVRALRGTGSW)组成的肽段,与心肌细胞结合能力强[5],将其连接于微球表面,可达到靶向心脏的效果。卡维地洛为非选择性β受体阻滞剂,可用于治疗心律失常、心肌肥厚及心力衰竭等[6-8],但对其他组织器官存在较多不良反应。本研究以卡维地洛为模型药物,利用PCM的主动靶向作用,并采用LIFU激发促使纳米颗粒在靶部位爆破,使药物聚集在心脏部位发挥作用,以期在增强超声显像效果的同时减少药物不良反应,建立诊断和治疗心脏疾病于一体的新型靶向载体。
1 材料与方法
1.1 主要药物及试剂 卡维地洛、羧基端聚乳酸-羟基乙酸(PLGA-COOH,分子量1.2万,聚合比为50∶50,济南岱罡生物工程有限公司),液态氟碳(全氟正戊烷PFP;Elfatochem公司),聚乙烯醇(Poly-vinylalcohol, PVA;Sigma公司),二氯甲烷(重庆川东化工有限公司),MES缓冲液、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)、N-羟基丁二酰亚胺(NHS,Sigma公司),DiI、DiR荧光染料(碧云天生物技术研究所),PCM、FITC-PCM(上海吉尔生化有限公司)。
1.2 主要仪器 FA2004A电子天平(上海电子仪器有限公司),XL2020声振仪(HEATSYSTEM公司),FJ-200高速分散均质机(上海标本模型厂),磁力搅拌器(IKA公司),冷冻离心机(EPPENDORF公司),马尔文激光粒径及电位检测仪(Malvern公司),倒置荧光显微镜(Olympus公司),高校液相色谱仪(岛津公司),流式细胞仪(BD公司),LIFU(重庆医科大学超声研究所自制)。
1.3 方法
1.3.1 制备载药液态氟碳纳米造影剂(双乳化法) 称取50 mg PLGA-COOH,加入5 mg卡维地洛,溶于2 ml二氯甲烷中,再加入200 μl PFP,冰浴声振3 min(振动5 s,停止5 s),取10 ml 4% PVA加入上述溶液,在高速均质机(10 000 r/min)中均质3 min,结束后加入适量2%异丙醇溶液,放入磁珠,在冰浴环境下磁力搅拌4~6 h;待有机溶剂完全挥发后,以双蒸水多次洗涤,离心后获得载药纳米粒,加入5 ml双蒸水重悬。制备带荧光纳米粒时,在PLGA-COOH溶于二氯甲烷的同时加入微量染料DiI,其余步骤同前。整个过程避光操作,获得非靶向纳米造影剂(C-PFPs)。
1.3.2 制备PCM修饰的载药液态氟碳纳米造影剂(碳二亚胺法) 取上述C-PFPs造影剂溶液1 ml离心、洗涤,复溶于pH为6.0的MES缓冲液中,再加入一定量EDC和NHS(摩尔比EDC∶NHS=2∶1),在4℃摇床上低温孵育活化1 h;再以pH为8.0的MES缓冲液多次离心、洗涤,洗掉多余的EDC和NHS;向上述溶液中加入FITC-PCM肽并混匀,使摩尔比PLGA-COOH∶FITC-PCM=1∶1,继续孵育10 h;再用MES缓冲液(0.1 mol/L,pH=8.0)漂洗离心3~5次,洗去未连接多肽;收集PCM靶向造影剂,分散溶解在MES的缓冲液(0.1 mol/L,pH=8.0)中,即获得连接PCM的靶向微球纳米造影剂(PCM/C-PFPs)。对照组不加EDC和NHS,其余步骤相同。
1.3.3 PCM/C-PFPs基本性质测定 采用光学显微镜和透射电镜观察PCM/C-PFPs的形态、大小及分布,以马尔文激光粒径电位仪测量其粒径和Zeta电位。采用高效液相色谱仪分析PCM/C-PFPs的包封率,包封率(%)=实际药物浓度/理论药物浓度×100%。
1.3.4 PCM与C-PFPs的连接情况 以倒置荧光显微镜以及流式细胞仪观察非靶向造影剂C-PFPs与多肽PCM的连接情况,所有步骤均避光操作。重复制备15个不同批次PCM/C-PFPs,包封率≥70%、PCM连接率≥90%为纳米粒制备成功。
1.3.5 体外载药造影剂热致相变反应 将稀释后的纳米微球滴于载玻片上,盖上盖玻片,并将其放于加热板上加热,记录加热时间及温度,其间动态调节聚焦观察纳米粒相变产生微气泡的过程。
1.3.6 LIFU激发后体内超声显影情况 将32只SD大鼠[许可证号SYXK(陕)2015-001]随机分为4组,每组8只,即声诺维组、PCM/C-PFPs+LIFU组、C-PFPs+LIFU组和单纯PCM/C-PFPs组,分别经尾静脉注射500 μl不同造影剂,除声诺维组和单纯PCM/C-PFPs组外,PCM/C-PFPs+LIFU组和C-PFPs+LIFU组大鼠均在注射后采用LIFU激发(3.2 W/cm2,10 min),分别在激发后1、10、30、60 min超声观察大鼠心脏部位显影情况,并以DFY软件定量分析显影声强度(灰度值)。
1.3.7 PCM/C-PFPs大鼠和体内分布 将24只SD大鼠[许可证号SYXK(陕)2015-001]随机分为3组,每组8只,即PCM/C-PFPs+LIFU组、C-PFPs+LIFU组和单纯PCM/C-PFPs组,分别经尾静脉注射DiI荧光标记纳米造影剂。给药 10 h后处死大鼠,取各组大鼠心脏及PCM/C-PFPs+LIFU组的其他主要器官组织(肝、肾、肺、脾),-20℃下冰冻切片,多聚甲醛固定15 min,DAPI染色 10 min,封片后采用激光共聚焦显微镜观察荧光标记纳米粒在大鼠体内各组织内的分布情况。以Image-Pro plus 6.0成像软件定量分析各组纳米粒在体内的荧光强度。
1.4 统计学分析 采用SPSS 12.0统计分析软件,计量资料以±s表示,多组间造影剂显影声强度的比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 载药靶向诊疗探针PCM/C-PFPs的基本特性 PCM/C-PFPs纳米造影剂为乳白色混悬液,光镜下观察为类圆形,形态规则,分布均匀,见图1A;透射电镜观察纳米粒呈球形,见图1B;其平均粒径为(415.00±6.24)nm,电位为(-20.27±1.55)mV,见图2。药物卡维地洛的包封率为(78.23±3.45)%。
2.2 多肽PCM与非靶向载药纳米探针C-PFPs的连接情况 倒置荧光显微镜观察,C-PFPs与多肽PCM连接良好,连接率为(98.98±1.02)%,见图3、4。15批次PCM/C-PFPs中,仅1个批次样品不合格,包封率为65.40%,制备成功率为93.33%(14/15)。
2.3 体外热致相变反应 加热前纳米探针稳定,无相变,见图5A;温度达45℃时,纳米探针开始变大,发生相变,见图5B;持续加热至60℃,纳米造影剂体积变大,数量增多,并逐渐聚集最后破裂,见图5C。
2.4 LIFU激发后大鼠体内显影情况
2.4.1 显影时间 体内显影实验结果显示,声诺维组和PCM-C/PFPs+LIFU组均能显著显影,但声诺维组仅注射后1 min显影,10 min时消失;PCM-C/PFPs+LIFU组在体内显影信号可持续至1 h;C-PFPS+LIFU组仅有少量显影,持续时间10 min;单纯PCM-C/PFPs组纳米粒无显影,见图6。

图5 PCM/C-PFPs热致相变反应(×200) A.加热前; B.温度到45℃时; C.加热到60℃时

图6 体内超声显影图
2.4.2 显影强度 LIFU激发1 min后,PCM-C/PFPs+LIFU组显影强度明显高于PCM-C/PFPs和C-PFPS+LIFU组、低于声诺维组(P均<0.05);LIFU激发10、30、60 min后,PCM-C/PFPs+LIFU组显影强度明显高于其他3组,差异均有统计学意义(P均<0.05),见图7。
2.5 靶向纳米探针在大鼠体内分布情况 PCM-C/PFPs+LIFU组大鼠心脏组织的红色纳米探针明显多于C/PFPs+LIFU组和单纯PCM-C/PFPs组,见图8A、8B;PCM-C/PFPs+LIFU组中,大鼠心脏的纳米探针分布多于肝、肾、肺、脾组织,见图8C、8D。
3 讨论
本研究制备的纳米造影剂是采用稳定性强的PLGA高分子材料作为外壳,同时包裹增加其声学反射性的液态氟碳,结合了两种材料的优点;相比于微泡造影剂,具有粒径小、半衰期长、可聚集显影、能穿过血管内皮、实现“组织染色”等优势[9-10],且可在增强显影的同时获得靶向治疗效果。目前心脏疾病如心肌肥厚、心功能衰竭、心肌梗死等已成为重要的致死原因[11-13],针对心脏疾病诊断和治疗的靶向探针是研究的热点。液态氟碳造影剂能增强显影效果,心肌导向肽PCM可提高探针的靶向性,使更多的纳米粒聚集于心脏,有助于及早发现和治疗心脏疾病。本研究结果显示,PCM-C/PFPs+LIFU组大鼠心脏可见明显的靶向纳米探针红色荧光,而单纯PCM-C/PFPs组和C/PFPs+LIFU组心脏红色纳米粒较少,提示靶向纳米粒能够通过主动靶向(通过心肌导向肽PCM靶向)和被动靶向(通过LIFU激发)的方式促进纳米探针进入心肌细胞;而单纯PCM-C/PFPs组大鼠心脏未显示明显红色荧光,提示在仅有主动靶向而无被动靶向的情况下,纳米粒不能大规模地聚集于心脏组织。宣吉晴等[14]制备携带精氨酸-甘氨酸-天冬氨酸(cRGD肽的聚乳酸/羟基乙酸(PLGA)纳米粒超声造影剂,大小均匀,在体外实验中对大鼠肝癌细胞有较强的特异性亲和力。
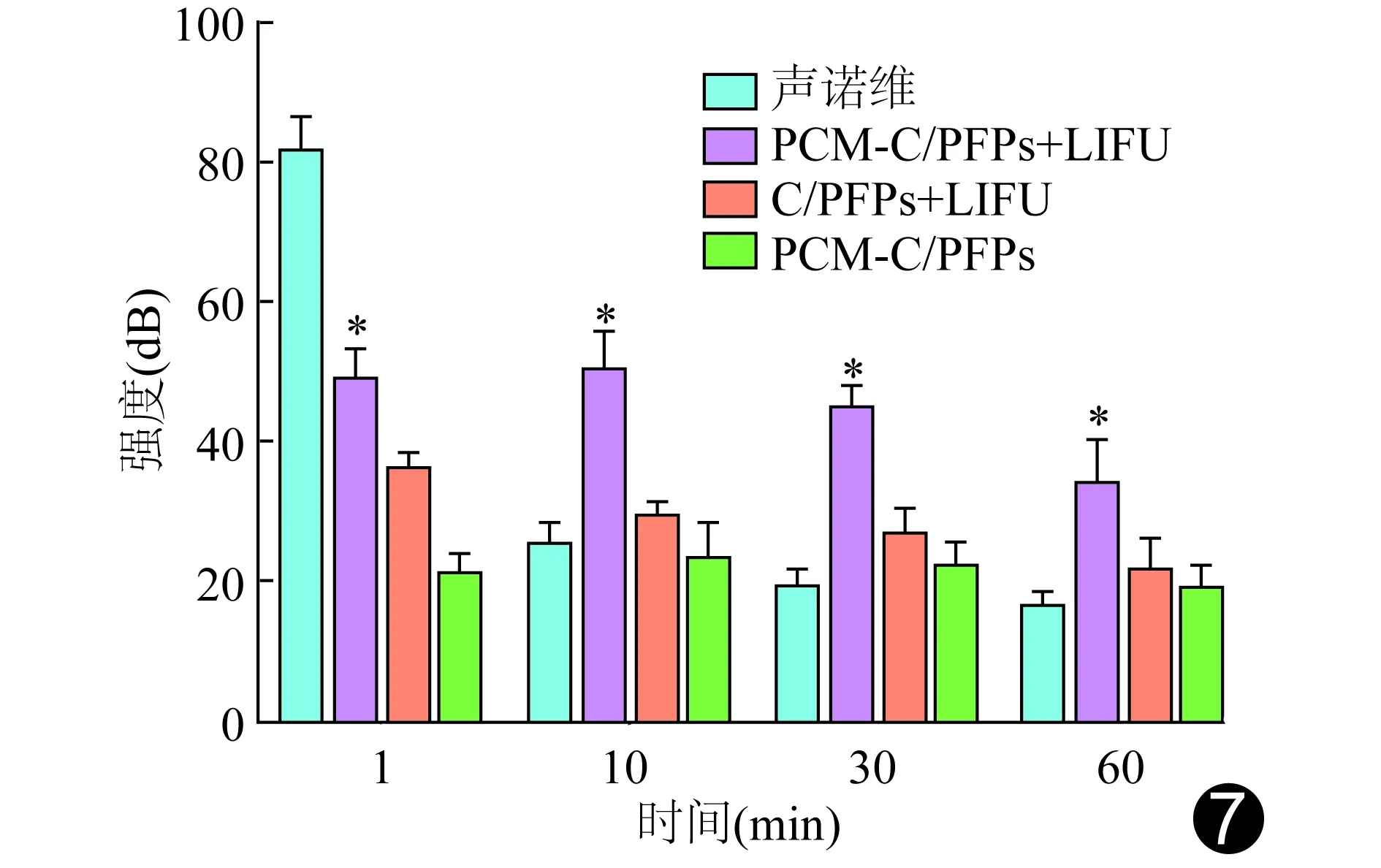
图7 体内超声显影声强柱形图 (*:与同时间点其他各组比较,P<0.05)
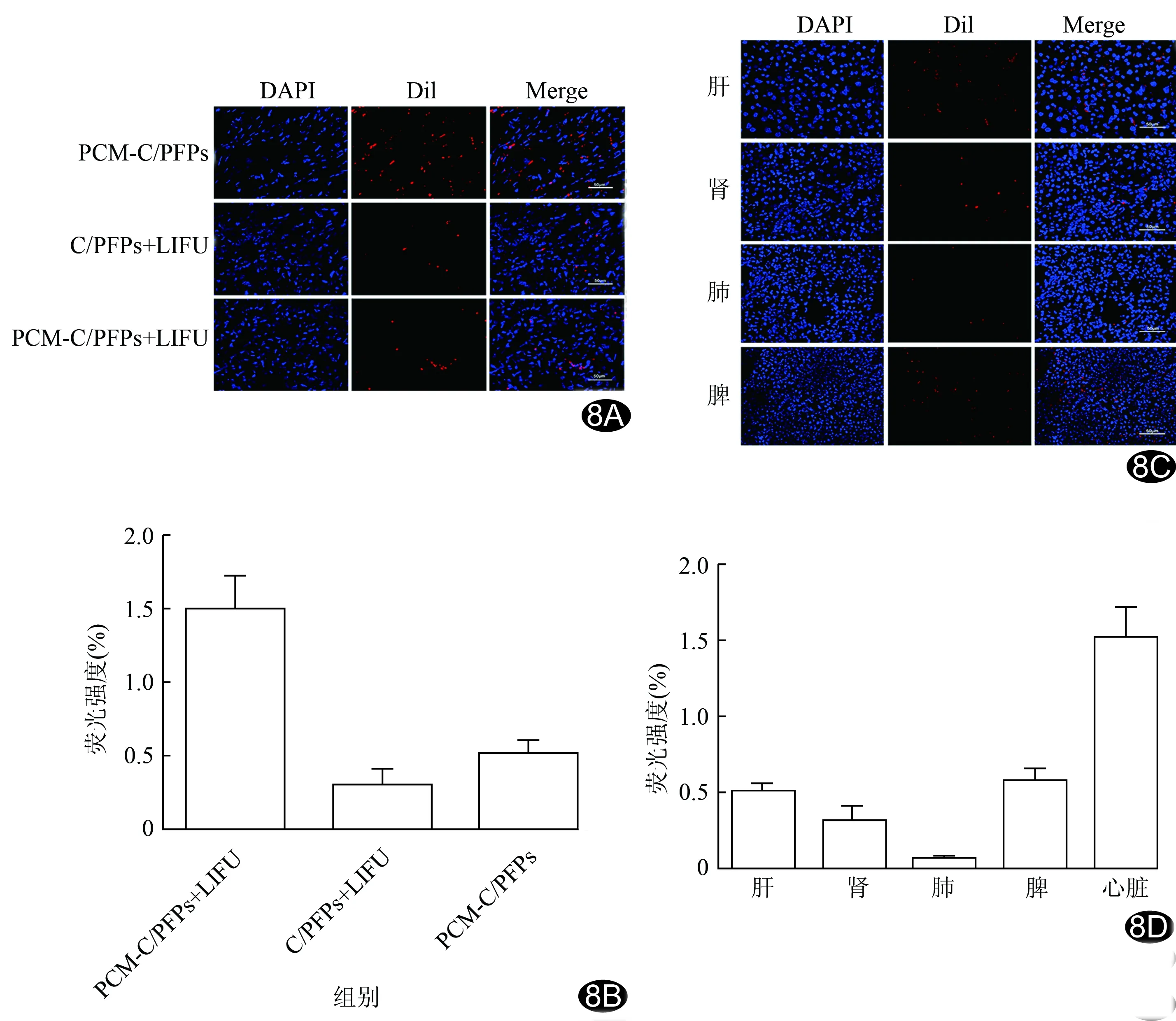
图8 纳米探针在大鼠体内的分布情况 A.纳米探针在心脏分布图(×400); B.纳米探针在心脏的荧光定量柱形图; C.PCM-C/PFPs+LIFU组大鼠肝、肾、肺、脾中纳米探针分布图(×400); D.PCM-C/PFPs+LIFU组大鼠心脏、肝、肾、肺、脾中的荧光定量柱形图 (DAPI为细胞核染色,Dil为纳米粒染色,Merge为两种荧光融合)
本研究以PFP作为包裹材料,其沸点仅29℃,在 37 ℃时未出现相变。研究[15]发现,PFP被PLGA材料包裹后,相变阈值会提高,粒径越小,相变温度越高。本研究所得的纳米粒粒径约(415.00±6.24)nm,相变温度约为45℃,表明PCM-C/PFPs靶向心脏的过程中不会自发相变,可保证纳米粒在体内的稳定性。而液态氟碳纳米粒通过LIFU辐照后可发生相变而形成微泡,增强超声显像。同时,相变形成的微泡在声场作用下还可发生非惯性空化,直至破裂释放出药物;而未发生相变的载药纳米粒在心脏组织可缓慢释放药物,在增强显影的同时实现被动靶向,以增强药物的治疗效果,减少不良反应。本研究选用的卡维地洛属于脂溶性药物[16],可很好地溶解于有机溶剂,镶嵌于纳米微球壳后可减少药物用量,提高增强超声靶向药物控释的安全性及可行性。本研究包载卡维地洛的纳米探针具有较高的包封率[(78.23±3.45)%],可达到治疗剂量,由此避免微泡载药量低、稳定性差缺点。
总之,本实验成功制备了可在大鼠体内同时实现心脏靶向显影和药物释放的PCM-C/PFPs纳米探针。该载药体系也可用于其他药物或基因治疗,为靶向诊疗心脏疾病提供了实验基础。
