HELLP综合征并发可逆性后部白质脑病综合征1例
2018-08-20薛晓霞郭书爱
薛晓霞 郭书爱 王 欣
1.河北省邢台市第九医院 (055250);2.首都医科大学附属北京妇产医院
可逆性后部白质脑病综合征(RPLS)是近20年来被报道的较为少见的可逆性脑部疾病,病因多样,产科常以高血压为诱因。常被误诊为脑出血、静脉窦血栓等,如能尽早诊断,经积极治疗,改善紊乱的神经细胞功能,预后良好。否则可能导致不可逆的神经细胞变形、变性和死亡。
1 病例资料
1.1 病史
患者女性,45岁,农民,孕39周,孕4产3,因左“上肢无力2+h”于2017年7月29日入院。患者自幼智力障碍,生活自理能力差。患者及家人无法提供孕期情况。停经8月余首次就诊,超声检查诊断妊娠,未行系统性产前检查。超声报告遗失,报告内容不详。入院前2 h自觉左上肢无力,无呕吐,叙述不清是否存在如下症状:头痛、头晕、视力改变、心慌、憋气、恶心等。月经史不详,既往足月自然分娩2次,孕期情况不详。现存子女2个,均存在智力障碍,未行医学遗传学检查。2年前“孕8+月、胎儿脑积水”引产,家人述当时诊为“重度子痫前期”。
1.2 体格检查
体温36.8℃,脉搏90次/分,呼吸19次/分,血压 27.9/14.6 kPa,表情淡漠,意识清楚,反应迟钝,对答欠流利,贫血貌。神经系统查体:自由体位,口角无歪斜,伸舌居中。左上肢肌力0级,深浅感觉消失,左上肢病理反射及生理反射均消失。右上肢及双下肢肌力5级,深浅感觉正常,生理反射存在,病理反射未引出。产科检查未见异常。
1.3 辅助检查
血常规:血红蛋白(Hb)100 g/L,血小板(PLT)42×109/L。尿蛋白2+。肝功能:丙氨酸转氨酶(ALT) 46.7 U/L,谷草转氨酶(AST) 65.5 U/L,乳酸脱氢酶(LDH) 1060.3 U/L,总胆红素(TBIL) 40.7μmol/L,α-羟基丁酸脱氢酶(α-HBDH) 819.5 U/L,Ca+2.18mmol/L,K+3.04 mmol/L。胎儿彩超示:双顶径8.66 cm,股骨长6.81 cm,羊水指数8.5 cm。
1.4 孕妇影像学检查
心脏超声:左房扩大,各瓣口轻度返流;左室舒张功能减低;心包积液。双下肢静脉超声未见明显异常。颅脑CT: 双侧额顶枕叶可见片状低密度影,脑室系统大小、形态无异常,脑沟裂无增宽加深,中线结构居中,考虑双侧顶枕叶梗塞灶(图1)。
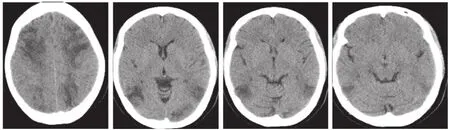
图1 孕妇剖宫产术日头颅CT
1.5 头颅核磁情况
入院后5 h在全麻下行子宫下段剖宫产术,娩一正常女婴。术后患者神志清晰,左上肢仍无肌力,转入神经内科监护室。给予重症护理、吸氧、心电监测,抗凝改善循环脱水、预防感染等治疗。术后1d头颅核磁回报:① 脑干、双侧基底节、侧脑室旁、半卵圆中心及双侧额颞顶枕叶T1稍低信号,T2高信号,FLAIR像呈高信号,DWI为等信号或低信号,ADC为高信号,边缘欠清,病变局部脑沟变浅(图2);②颅内MRA血管成像表现:右侧椎动脉颅内段较对侧细,椎动脉走行迂曲;③头部血管静脉磁共振血管成像(MRV)表现:右侧颈内静脉横窦血流信号走行正常,未见明显闭塞,右侧乙状窦末端局部血流信号弱,管腔狭窄。左侧横窦、直窦未见明显显影。上矢状窦局部可见双支。左侧颈内静脉、乙状窦较对侧细(图3)。印象:可逆性后部白质脑病综合征。
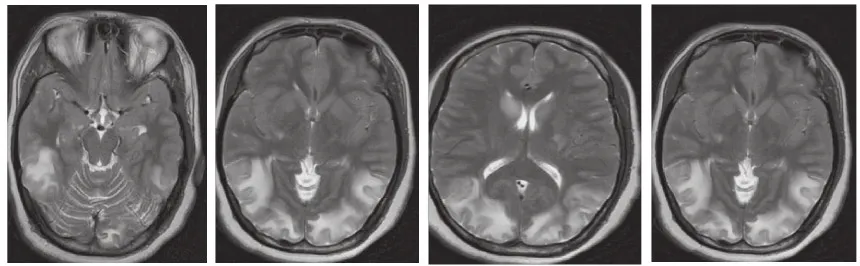
图2 孕妇术后1天头颅磁共振成像
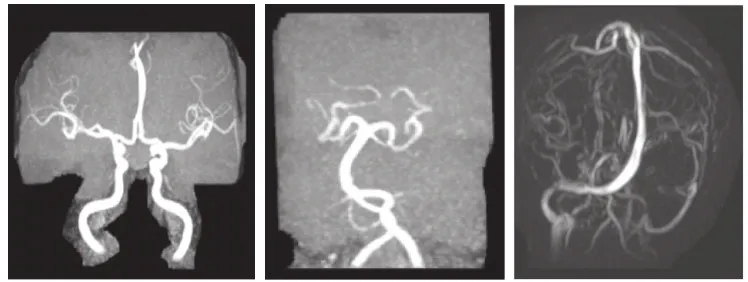
图3 孕妇术后1天头部血管静脉磁共振血管成像表现
根据病例并发于子痫前期及HELLP综合征后,左上肢肌张力消失,影像学提示血管源性水肿改变等特点诊断:HELLP综合征并发可逆性后部白质病脑病综合征。手术当日及术后第1天,腱反射和病理反射同入院时。术后第2天患者出现嗜睡,意识不清,呼之不应,不言语。患者病情加重,当日加大脱水利尿力度, 继续降压治疗。患者术后3d意识清楚,可言语,左上肢无力减轻。术后9d左上肢肌力恢复正常。患者经积极利尿后病情迅速好转,考虑病情加重与脑水肿加重有关。复查头颅核磁:左侧侧脑室旁及双侧额颞枕叶可见多发斑片状T1低信号,T2高信号,边缘不清,见图4。术后10d出院。术后1个月随访,患者血压20.0/12.0 kPa,左上肢肢体活动级及感觉均恢复正常。
2 讨论
RPLS是1996年Hinchey等[1]在《新英格兰杂志》首先报道,2000年Casey[2]等提出命名,是一种临床神经影像学概念的综合征,其病因较复杂,可见于不同基础疾病的患者[3-4]。文献报道发病率为0.01%[5],好发于孕妇,尤其是子痫前期或子痫孕妇。其他包括高血压脑病、尿毒症、系统性红斑狼疮、应用免疫抑制药或细胞毒性药物等[3-4]。另外有报道认为,剖宫产术后的患者也可以并发该病[6]。
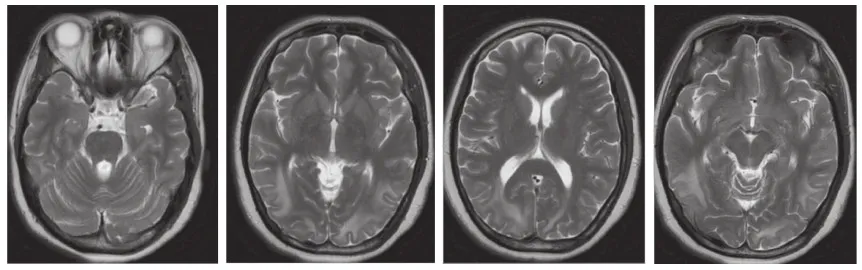
图4 术后9天头颅磁共振成像
RPLS的发病机制尚不完全清楚,目前有几种假说被广泛接受:①脑血管痉挛学说[7],常见于子痫患者,可能因为动脉或静脉痉挛导致血管收缩引起局部组织的缺血缺氧,从而导致局部组织的水肿所致。本病例继发于HELLP综合征,血管MRA和MRV表现均提示动静脉均存在痉挛。②脑高灌注学说[8]。③多种机制共同影响,包括血压升高、肾素血管紧张素系统活性增高、液体潴留、药物或致病因子对血脑屏障的损伤等因素[8-9]。本病例重度子痫前期、HELLP综合征可引起低蛋白血症、水钠潴留、血压升高,会直接损伤血管内皮,导致局部组织的血管源性水肿。
RPLS临床主要表现为急性或亚急性起病,症状包括头痛、精神行为异常、癫痫、皮质盲或其他视觉改变、小脑性共济失调等,局灶性神经功能缺损少见,经及时治疗预后较好,绝大多数患者在数周内明显好转,甚至完全恢复。本病例妊娠女性既往体健,以“肢体活动受限”就医,因其有智力障碍,有些症状无法叙述清楚。本次起病的主要原因为重度子痫前期、HELLP综合征,存在RPLS的病因。
RPLS的诊断主要依据临床表现和典型的影像学改变。典型的影像学改变主要表现为白质水肿,病变主要位于后循环系统,常见的部位为顶、枕叶皮质下白质,脑干、小脑、基底节和额叶亦可累及,少数患者皮质亦可受累。CT表现多为双侧顶枕叶的对称片状低密度影。MRI主要反映了脑组织结构和病理学改变,由于RPLS主要为血管源性脑水肿,所以T1像为等信号或低信号,T2、FLAIR像呈高信号,DWI为等信号或低信号,ADC为高信号[9]。本病例影像学符合上述典型的血管源性脑水肿改变,是确诊的主要依据。治疗后复查头颅MRI病变明显好转。
PRLS易发生在大脑后循环的脑梗死(如基底动脉尖综合征)及分水岭区脑梗死等,影像学表现为双侧枕叶皮质、丘脑、颞叶内下、小脑以及中脑梗死,梗死性病变以细胞毒性脑水肿为主,ADC呈现低信号,DWI呈现高信号,病变往往不可逆。本病需与脑静脉血栓形成等鉴别。静脉窦血栓形成的MRI表现为静脉窦流空信号消失,常见于脑水肿、脑梗死和脑出血, MRV可发现深静脉、浅静脉以及静脉窦狭窄、充盈缺损或闭塞,无RPLS典型的可逆性病程特点[10]。本病例,产科及神经内科医生对RPLS认识不充分,易与静脉窦血栓形成及脑梗塞混淆,影响患者的治疗。核磁共振可以很好的做出鉴别诊断。
RPLS治疗措施主要包括:①积极控制高血压,强调在数小时之内将血压降至正常水平以内。②加强对症治疗,如控制癫痫的频繁发作,同时适当使用脱水剂治疗,一方面以减轻血管源性脑水肿,另一方面有利于解除癫痫发作后存在的细胞性脑水肿;③原发病的治疗,原有严重基础疾病应针对性积极治疗,使用细胞毒性药物的患者应停用或根据情况减量,待病情缓解后可以继续使用。本病例产后在治疗过程中一度出现病情加重,考虑降压、脱水不足导致脑水肿加重,经过积极降压、脱水,病情迅速好转。
产科重度子痫前期患者具有RPLS诱因。以往常常被误认为高血压性颅内出血,虽然给于降颅压、脱水治疗,但也常伴随止血治疗,如不能及时正确诊断PRLS,在妊娠期高凝状态下再加以止血药物,可能会增加血栓性疾病的风险。因此在重度子痫前期突然出现精神行为异常、皮质盲或其他视觉改变、小脑性共济失调时应及时除外PRLS。本案病例与颅内出血、脑梗塞难以鉴别之处在于出现了一侧上肢肌力减退,在以往的病例报告中未见先例。
