缺血性脑卒中患者血浆MPO和Lp-PLA2的表达水平及临床意义
2018-08-18农贤刚程卫萍贵港市中西医结合骨科医院广西贵港537100
农贤刚,程卫萍 (贵港市中西医结合骨科医院,广西 贵港 537100)
缺血性脑卒中(ischemic strokes,IS)即脑梗死,是指因脑部血液循环障碍,脑实质缺血、缺氧所致的局限性脑组织的缺血性坏死或软化,以其高发病率、高复发率、高致残率及高病死率,严重威胁人类生命健康和生活质量[1]。及时有效的诊断和治疗是延缓病情,提高患者生命质量的关键。近年有研究表明,髓过氧化物酶(myeloperoxidase,MPO)水平与颈动脉斑块易损程度呈正相关[2],脂蛋白相关磷脂酶A2(lipoprotein-associated phospholipase A2,Lp-PLA2)可能是血管炎性反应的特定标记物,促进动脉粥样硬化的发生、发展[3]。本研究探讨血浆炎性因子MPO和Lp-PLA2在缺血性脑卒中患者的变化及其与颈动脉斑块稳定性及神经功能缺损程度的关系,旨在为缺血性脑卒中的临床诊断和治疗提供理论依据。
1 资料与方法
1.1 一般资料:选取2014年1月~2015年12月间本院神经内科住院诊治的96例缺血性脑卒中患者为病例组,其中男58例,女38例;年龄45~71岁,平均(61.4±5.7)岁。所有病例均符合《中国急性缺血性脑卒中诊治指南2010》诊断标准[4],并经详细的神经系统检查及颅脑CT或MRT证实诊断。排除标准:合并严重感染及肝肾功能不全;肿瘤及免疫系统疾病;血液病;腔隙性脑梗死、复发脑梗死、药源性缺血性脑卒中。根据颈动脉彩超显示的斑块性质将病例组患者分为不稳定斑块组41例,稳定性斑块组36例,无斑块组19例。根据美国国立卫生研究所卒中量表(NIHSS)评分进行神经功能缺损程度评估,将病例组患者分为轻型梗死亚组35例(NIHSS评分<5分),中型梗死亚组38例(NIHSS评分为5~15分),重型梗死亚组23例(NIHSS评分>15分)。另选取同期45例健康体检患者为对照组,男26例,女19例;年龄44~72岁,平均(61.7±6.1)岁。两组性别、年龄等指标比较,差异无统计学意义(P>0.05),具有可比性。研究经本院伦理委员会批准,所有入选者均知情同意并签订知情同意书。
1.2 方法
1.2.1 标本采集:所有患者均于入院次日清晨静息状态下抽取空腹肘静脉血6 ml,3 ml置于EDTA或肝素抗凝管中,混匀后4℃,3 000 r/min离心15 min,取血浆置-80℃冰箱保存备用,避免反复冻融,用于MPO、Lp-PLA水平检测。3 ml置于普通生化试管中,用于血脂TC、TG、HDL- C、LDL-C检测。
1.2.2 检测方法:血清MPO、Lp-PLA水平测定均采用酶联免疫吸附试验(ELISA),试剂由天津康尔克生物科技有限公司提供。酶法检测TC、TG、HDL- C、LDL-C,试剂由北京九强生物技术有限公司提供,采用日立7600全自动生化分析仪进行检测。所有操作均严格按照试剂盒说明书进行操作。
1.3 统计学处理:应用SPSS17.0软件进行数据分析处理,计量资料用均数±标准差()表示,多组间均数比较采用单因素方差分析,组间两两比较采用SNK-q检验,相关分析采用Spearman相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 病例组与对照组各项临床检测指标比较:病例组MPO、Lp-PLA2、TG、LDL-C水平均明显高于对照组,HDL-C水平低于对照组,差异有统计学意义(P<0.01);两组TC水平比较,差异无统计学意义(P>0.05),见表1。
表1 两组患者各项临床检测指标比较()
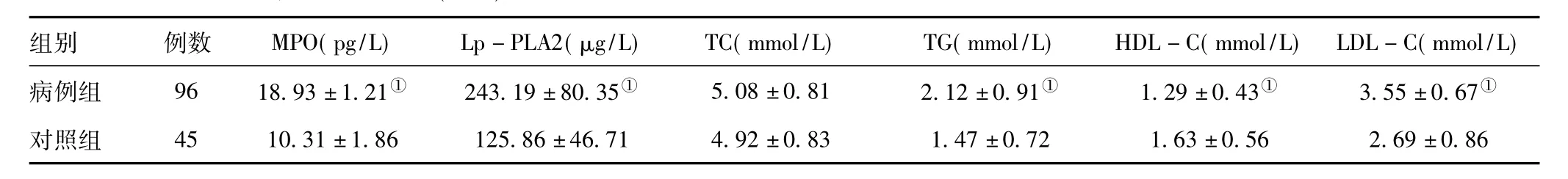
表1 两组患者各项临床检测指标比较()
注:与对照组比较,①P<0.01
组别 例数 MPO(pg/L) Lp-PLA2(μg/L) TC(mmol/L) TG(mmol/L) HDL-C(mmol/L) LDL-C(mmol/L)病例组 96 18.93±1.21① 243.19±80.35① 5.08±0.81 2.12±0.91① 1.29±0.43① 3.55±0.67①对照组 45 10.31±1.86 125.86±46.71 4.92±0.83 1.47±0.72 1.63±0.56 2.69±0.86
2.2 不同性质斑块组MPO、Lp-PLA2水平比较:斑块稳定组、斑块不稳定组的MPO、Lp-PLA2水平高于无斑块组,并且斑块不稳定组的MPO、Lp-PLA2水平高于斑块稳定组,差异均有统计学意义(P<0.05)。见表2。
表2 不同性质斑块组MPO、Lp-PLA2水平比较()

表2 不同性质斑块组MPO、Lp-PLA2水平比较()
注:与无斑块组比较,①P<0.05;与稳定斑块组比较,②P<0.05
组别 例数 MPO(pg/L) Lp-PLA(μg/L)19 12.59±2.67 137.64±56.05稳定斑块组 36 16.83±4.31① 214.01±59.14①不稳定斑块组 41 22.64±5.12①② 307.76±74.63无斑块组①②
2.3 不同程度神经功能缺损患者血浆MPO、Lp-PLA2水平比较:神经功能缺损程度随血浆MPO、Lp-PLA2水平增加而呈递增趋势,差异有统计学意义(P<0.05),见表3。
表3 缺血性脑卒中不同程度神经功能缺损患者血浆MPO、Lp-PLA2水平比较()

表3 缺血性脑卒中不同程度神经功能缺损患者血浆MPO、Lp-PLA2水平比较()
注:与轻型组比较,①P<0.05;与中型组比较,②P<0.05
组别 例数 MPO(pg/L) Lp-PLA(μg/L)35 12.26±3.61 139.56±30.12中型组 38 18.13±8.41① 232.67±38.25①重型组 23 34.74±9.72①② 375.89±59.72轻型组①②
2.4 相关性分析:Spearson相关分析显示,缺血性脑卒中患者血浆MPO、Lp-PLA2水平与NIHSS评分均呈正相关,差异有统计学意义(r=0.861,0.849,P <0.05)。
3 讨论
近年来缺血性脑卒中已经成为中老年人群的常见疾病。流行病学调查显示,我国现有脑血管病患者700余万人,其中约70%为缺血性脑卒中[5]。缺血性脑卒中疾病的重要病理基础是动脉粥样硬化(AS),而AS本质上是一个慢性炎性反应过程,炎性反应因子在AS的发生及发展过程中起重要作用[6],炎性反应参与AS的发生、发展,导致斑块形成及不稳定化。通过对血液中的炎性介质的检测,可以有效地了解动脉粥样硬化斑块的炎性反应程度以及斑块的稳定性,从而预测以及判断缺血性脑卒中的发生、转归。
MPO是亚铁血红素过氧化物酶超家族成员,是由活化的中性粒细胞、单核细胞等在炎性反应发生时释放到细胞外液的白细胞酶,可氧化修饰人动脉壁内的LDL,促进动脉粥样硬化的形成,参与粥样斑块的破裂[7-8]。有研究表明,MPO作为体内的一种炎性指标,贯穿于颈动脉粥样硬化斑块形成的各个阶段,与缺血性脑卒中的发生、发展密切相关[9]。本研究中血浆MPO水平在病例组中明显高于对照组,无斑块组,稳定斑块组和不稳定斑块组之间比较,差异具有统计学意义(P<0.05)。提示MPO水平的升高与缺血性脑卒中的发生、发展相关,斑块种类不同,MPO的表达程度不同,MPO水平可在某种程度上反映颈动脉粥样硬化斑块的性质,观察血浆MPO水平变化可能对评估缺血性脑卒中事件风险具有一定的临床意义。与任建兵等的研究结果[10]基本一致。本研究分别检测不同神经功能缺损程度的缺血性脑卒中患者的血浆MPO水平,结果发现,神经功能缺损中型组、重型组的MPO水平高于轻型组,并且重型组高于中型组,差异有统计学意义(P<0.05)。提示MPO对反映患者病情有着指示的作用。
Lp-PLA2又称为血小板活化因子乙酰水解酶,由成熟的巨噬细胞和淋巴细胞合成和分泌,可附着在低密度脂蛋白(LDL)颗粒上,通过水解氧化低密度脂蛋白(ox-LDL-C)上的卵磷脂,生成促炎物质溶血卵磷脂和游离脂肪酸,具有促炎和促动脉粥样硬化作用[11]。既往研究表明,Lp-PLA2是一种炎性反应标志物,与动脉粥样硬化发生和缺血性脑卒中的发生密切相关[12],是预测缺血性脑卒中的独立预测因子[13-14]。本研究结果显示,病例组血浆Lp-PLA2水平明显高于对照组,不稳定斑块组、稳定斑块组Lp-PLA2明显高于无斑块组,且不稳定斑块组Lp-PLA2高于稳定斑块组,差异均具有统计学意义(P<0.05)。表明Lp-PLA2参与了缺血性脑卒中的病理生理过程,可能是预测颈动脉不稳定斑块的生物学指标,这与文献报道[15]一致。NIHSS评分能较好的评价脑卒中患者神经功能缺损情况,而神经功能缺损也能很好的反应脑卒中的严重程度。相关性分析显示,Lp-PLA2水平与NIHSS评分呈正相关,缺血性脑卒中患者随着Lp-PLA2水平的升高,神经功能缺损程度也越严重,与王磊等研究结果[16]相似,说明血浆Lp-PLA2水平对缺血性脑卒中的诊断、分期及预后判断均有重要参考价值,在一定程度上可以指导临床用药。同时,Lp-PLA2检测简单快捷,患者痛苦少,操作方便,技术要求不高,在基层医院都较易于实施,便于临床推广应用。
综上所述,缺血性脑卒中患者血浆MPO和Lp-PLA2水平明显升高,与颈动脉斑块稳定性和神经功能缺损程度相关,动态观察二者水平变化可预测斑块稳定性,对缺血性脑卒中的临床分型和病情监测具有重要意义。
