短期高强度间歇训练对中老年男性原发性高血压患者安静时和握力运动中交感缩血管反应的影响
2018-08-17许绍哲朱荣
许绍哲 朱荣
温州医科大学体育科学学院(浙江温州 325035)
高血压是一种微血管功能障碍造成外周血管阻力增加、组织器官灌注减少的心血管疾病。由于交感神经系统异常激活,高血压患者安静时全身血管阻力增加,运动时血压过度升高、血管阻力仍处于较高水平,当肌肉代谢需求增加(如运动)时,患者可能会出现严重后果(如心血管意外、猝死等)[1]。运动能够激活交感神经系统,表现为心率升高、心肌收缩力增强,同时内脏以及非运动肌血管床收缩(即交感缩血管反应)[2]。非运动肌血管收缩有利于血流量向运动肌重新分配以及维持血压水平;运动肌血管亦受交感神经支配,但对于年轻健康个体,运动肌血管收缩反应明显减弱,这一生理过程对于保证工作肌充足血流量以及防止运动中血压过度升高具有重要意义,学者们将肌肉收缩抑制交感缩血管反应的现象称为“功能性抗交感”(functional sympatholysis)[3],其机制与工作肌释放的一氧化氮(nitric oxide,NO)、前列腺素等血管舒张因子以及多种代谢产物如氢离子、钾离子等介导交感缩血管反应下调有关。Vongpatanasin等[4]证实,高血压患者安静时的交感缩血管反应与正常血压者无显著性差异,但肌肉收缩时的交感缩血管活动性异常增加、功能性抗交感受损,这可能是高血压患者运动时骨骼肌血流灌注不良的重要原因。
持续有氧运动(简称有氧运动)是预防和治疗多种慢性病的重要康复手段[5-7]。对于高血压患者,有氧运动除具有降压效果外,还能够改善运动中异常的血液动力学反应,增加工作肌的血流灌注[8,9],其机制未明。Mortensen等[10]证实,规律有氧运动可改善增龄导致的功能性抗交感受损。有趣的是,运动能够上调NO含量[11]、抑制血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)表达[12]、改善氧化应激状态[13],而NO下调、Ang Ⅱ和自由基增多则与高血压患者功能性抗交感受损密切相关[14,15]。基于此,我们推测,运动训练可能是改善原发性高血压患者功能性抗交感的重要非药物手段。Mortensen等[16]的一项研究证实,8周有氧运动能够降低高血压患者安静时的交感缩血管反应并改善功能性抗交感,但该研究利用股动脉灌注酪胺激活交感神经,具有一定创伤,受试者一般不易接受(该研究最终样本量n=8)。
高强度间歇训练(high-intensity interval training,HIIT)是近些年来竞技体育与大众健身领域新兴起的一种省时有效的运动模式。诸多报道以及本课题组多项研究均显示,HIIT在改善运动能力和骨骼肌代谢等方面与有氧运动相当甚至更佳[17-21],而所需运动时间较短使一般人更易接受和长期坚持,其安全性亦得到广泛证实。Ciolac等[20]针对高血压患者不同运动方式的meta分析指出,HIIT在改善心血管适能、内皮功能、胰岛素敏感性、交感神经活性以及血管硬度等方面均优于传统有氧运动。长期HIIT对于高血压患者的降压作用与有氧运动相似,但HIIT对自主神经系统以及运动中血压反应的改善效果明显优于有氧运动[21],其机制是否与功能性抗交感改善有关尚不得而知。本研究以中老年男性原发性高血压患者与正常血压者为受试对象,分别于安静时以及握力运动中利用冷加压实验(cold pressor test,CPT)(无创方法)激活交感神经,观察前臂血液动力学的变化以及短期(4周)HIIT的影响,旨在对比原发性高血压患者与正常血压者安静时和运动中交感缩血管反应以及功能性抗交感是否存在差异并探讨短期HIIT的干预效果。我们假设,原发性高血压患者安静时和运动中的交感缩血管反应异常、功能性抗交感受损,而HIIT则可改善这一病理状态。
1 研究对象和方法
1.1 研究对象
20名诊断为轻度(Ⅰ级)原发性高血压[收缩压(systolic blood pressure,SBP)/舒张压(diastolic blood pressure,DBP):140~159/90~99 mmHg]患者(高血压组,hypertension group,H组)以及20名年龄、身高、体重相匹配的正常血压(SBP/DBP:90~120/60~80 mmHg)者(正常血压组,normotension group,N组)自愿参加本实验。受试者均为40~65岁的中老年男性,无规律运动习惯,无心脏病、糖尿病以及靶器官损害如左室肥大、慢性肾脏疾病等。排除继发性高血压(嗜铬细胞瘤、Cushing综合征、肾性高血压等)以及服用β受体阻断剂的患者。H组受试者口服降压药包括利尿剂(n=13)、血管紧张素转换酶抑制剂(n=16)以及钙通道阻断剂(n=8),实验前至少4周嘱受试者逐渐停药以避免对交感缩血管反应的影响[4]。由于H组受试者为轻度高血压患者且无靶器官损害及其他并发症,因此短期停药不会造成血压剧烈波动以及其他副作用[4]。实验前说明本研究目的、意义以及可能存在的不良反应,受试者签订知情同意书。
1.2 整体实验流程
包括4次实验室测试和4周HIIT运动干预。第1次实验室测试:熟悉实验室环境和相关设备仪器的操作流程,测试身高、体重、体重指数(body mass index,BMI)以及血糖、血脂等基线变量参数。第2次实验室测试(与第1次间隔3天):利用递增负荷功率车运动实验测定最大摄氧量(maximal oxygen uptake,VO2max),利用握力计测试优势手最大握力,即前臂肌群最大随意收缩(maximal voluntary contraction,MVC)。第3次实验室测试(与第2次间隔1周):分别于安静时(rest,R)以及握力运动中(handgrip exercise,HG)利用CPT激活交感神经,观察前臂血液动力学的变化。随后受试者实施4周HIIT运动方案,于末次运动后48 h进行第4次实验室测试,内容同第1次和第3次。所有测试前24 h清淡饮食,禁止剧烈运动,忌烟酒和咖啡等。整体实验流程见图1。
1.3 血糖、血脂含量测定
空腹状态下肘正中静脉取血3 mL(肝素抗凝),3000 RPM、4℃离心20 min,取上清(血浆)。采用全自动生化分析仪(日立7060型,日本)测定空腹血糖(fasting blood glucose,FBG)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesferol,HDL-c)和低密度脂蛋白胆固醇(low density lipoprotein cholesferol,LDL-c)。
1.4 VO2max测定
采用递增负荷功率车(Monark 839E,瑞典)运动实验测试受试者VO2max[8,22]。先进行10 min准备活动(慢跑4 min,拉伸4 min,20 W蹬车2 min),然后开始测试。起始负荷为60 W,每3 min递增30 W,保持60 rpm蹬车频率。用运动心肺代谢系统(Cosmed K4b2,意大利)测定摄氧量(oxygen uptake,VO2)、二氧化碳呼出量(volume of carbon dioxide output,VCO2)、HR等参数。出现以下4个标准中的3个即终止实验:(1)HR超过最大预测心率的90%(最大预测心率=220-年龄);(2)呼吸商(respiratory quotient,RQ=VCO2/VO2)≥1.15;(3)随着功率增加出现摄氧量平台,即VO2的变化幅度不超过5%或150 ml/min或2 ml/kg/min;(4)受试者不能维持预定负荷或主诉力竭。将最后一次持续超过30 s的VO2作为VO2max。整个实验在心电监护及2名急诊医师陪护下进行。
1.5 前臂肌群MVC测定
握力计(EKJ094,日本,测力范围0~100 kg)通过传感器连接数字显示器(TD-510,日本)并可实时显示数据。受试者先做好充分的准备活动(指关节、掌指关节和腕关节的伸展运动),测试前双手下垂置于体侧,掌心向内,测试臂(非优势臂)稍向外展(但不超过30°),测试时抓握仪器的握力部分,最大用力3 s,手臂不得摆动,测试3次,每次间歇5 min,取均值。
1.6 血液动力学参数测定
受试者取仰卧位,利用多导生理记录仪(RM-6000,日本)监测心率(heart rate,HR)和血压(blood pressure,BP),后者包括 SBP、DBP 和平均动脉压(mean arterial pressure,MAP);利用呼吸监测仪(GY-6620,中国)监测呼吸,嘱受试者避免引起交感兴奋反射的动作(如Valsalvas动作、呼气延长等)。随后分别于安静时和握力运动中利用CPT激活交感神经,共进行4个实验(相邻实验间隔30 min),每个实验持续时间为6 min,依次为:(1)安静时(R)。受试者安静休息6 min;(2)R+CPT。受试者处于安静状态下6 min,于2~4 min时双脚浸入3℃的冰水混合物中,水面达到踝关节位置,持续进行2 min[23]。CPT属于交感神经激发实验,通过中枢神经机制提高交感神经活性,在增加肌肉交感溢出(即肌肉交感神经活性)的同时并不改变皮肤交感神经活性,具有简便、无创以及较高稳定性和信效度等特点,常用于功能性抗交感的研究[24];(3)HG。受试者用非优势手以30%MVC强度进行6 min间歇握力运动,利用节拍器对运动节奏进行实时调控(频率为20次/min,运动时间与间歇时间为1:1)。由传感器连接的显示器实时显示握力数值以便受试者通过视觉反馈调整握力大小[25]。Hansen等[25]证实,该握力运动负荷并未显著增加肌肉交感神经活性。(4)HG+CPT。受试者以30%MVC强度进行6 min间歇握力运动,于2~4 min时进行2 min CPT。分别于各实验2~4 min时采用彩色多普勒超声诊断仪(飞利浦CX50,荷兰)测定前臂血液动力学,探头频率为10 MHz,指标包括肱动脉收缩期峰值血流速度(cm/s)、舒张末期血流速度(cm/s)、平均血流速度(cm/s)以及股动脉直径(cm),测定5~6个心动周期并取均值。前臂血流量(forearm blood flow,FBF)(mL/min)=平均血流速度×血管横断面积=平均血流速度×[π×(肱动脉直径/2)2]×60。前臂血管电导(forearm vascular conductance,FVC)(mL/min/100 mmHg)=FBF/MAP×100。血液动力学测定实验见图2。
1.7 HIIT方案
两组受试者均进行3次/周、共4周的HIIT,方式为蹬车运动,方案为:先以90%VO2max强度对应的功率蹬车1 min后休息1 min,重复4次为1组,共4组,组间间歇4 min。研究证实[20,26],该HIIT方案适用于高血压人群,患者运动时耐受性良好且无不良事件发生。运动过程中由医护人员全程监控。
1.8 数据分析与统计学处理
各实验中取第2~4 min血液动力学(HR、MAP、FBF和FVC)的平均值作为原始数据。安静时的交感缩血管反应用R+CPT时的FVC与R时的变化率(%△FVC)表示,即安静时%△FVC=(FVCR+CPT-FVCR)/FVCR×100%;握力运动中的交感缩血管反应用HG+CPT时的FVC与HG时的变化率表示,即握力运动中%△FVC=(FVCHG+CPT-FVCHG)/FVCHG×100%;抗交感幅度(magnitude of sympatholysis,MS)用安静时与握力运动中%△FVC的差值表示,即MS(%)=安静时%△FVCR-握力运动中%△FVCHG[27],代表肌肉收缩抑制交感缩血管反应的能力(功能性抗交感)。
图2 血液动力学测试流程
所有数据以均数±标准差表示。对基线变量以及安静时的血液动力学参数,组内(实验前vs.实验后)比较使用配对t检验,组间(H组vs.N组)比较使用独立样本t检验;对CPT诱导的血液动力学变化,使用双因素重复测量的方差分析,若主效应具有统计学意义,则使用Bonferroni检验进行多重比较。P<0.05定为具有显著性差异。
2 结果
2.1 本研究最终纳入受试者样本量
由于中途服药、未完成运动方案和测试以及其他个人原因等失访6名受试者,其中N组4名、H组2名,因此最终纳入受试者样本量为:N组(n=16)、H组(n=18)。整个实验过程中未出现与运动相关的不良反应(肌肉损伤、异常疲劳、晕厥、心悸、心绞痛、血压异常波动、恶心、呕吐、呼吸困难、心电图异常等)。
2.2 HIIT前后基线特征以及安静时血液动力学变化
受试者基线特征变量见表1,HIIT前,两组受试者各基线变量无显著性差异(P>0.05),4周HIIT后各变量均无显著性变化(P>0.05)。受试者安静时血液动力学参数见表2,HIIT前,H组SBP、DBP和MAP高于N组(P<0.05),FBF和FVC低于N组(P<0.05),HR无显著性差异(P>0.05)。HIIT后组内与实验前比较,N组SBP和MAP显著下降(P<0.05),H组SBP、DBP和MAP显著下降(P<0.05)、FBF和FVC显著升高(P<0.05);HIIT后组间比较,H组SBP、DBP和MAP显著高于N组(P<0.05),FVC显著低于N组(P<0.05)。

表1 HIIT前后基线变量的比较
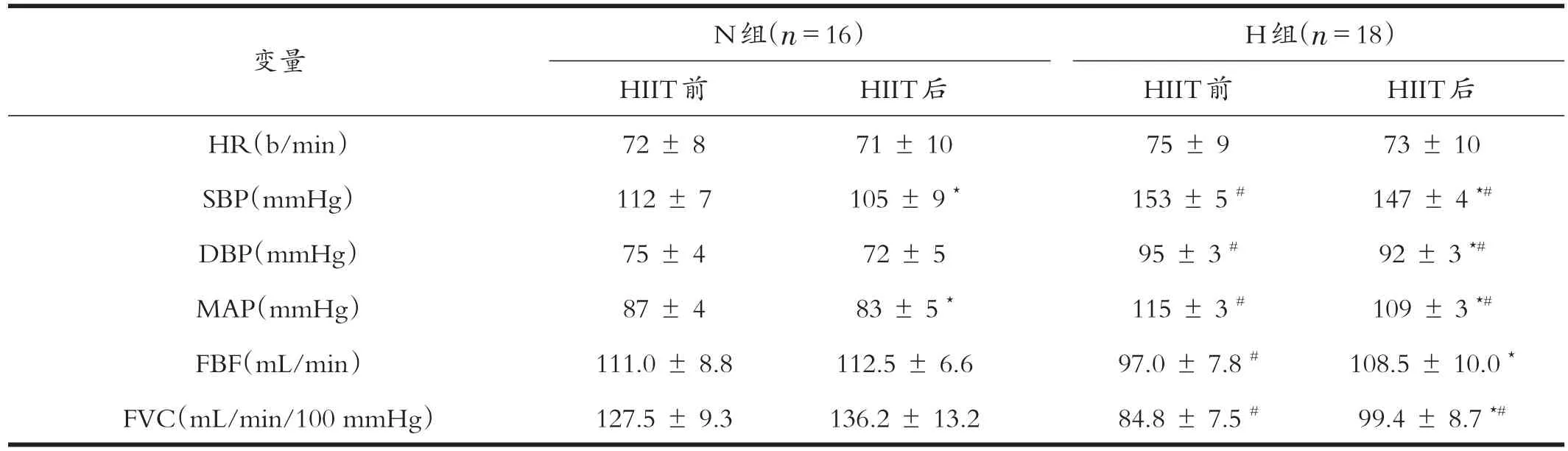
表2 HIIT前后安静时血液动力学的变化
2.3 HIIT前后安静时CPT诱导的血液动力学变化
HIIT前:安静状态下激活交感神经(R+CPT)时,与R比较,N组和H组HR和MAP无显著性变化(P>0.05)、FBF和FVC显著降低(P<0.05);组间比较,H组MAP显著高于N组(P<0.05),FBF和FVC显著低于N组(P<0.05)。HIIT后:安静状态下激活交感神经(R+CPT)时,与R比较,N组和H组HR和MAP无显著性变化(P>0.05)、FBF和FVC降低(P<0.05);组间比较,H组MAP高于N组(P<0.05),FBF和FVC显著低于N组(P<0.05);与HIIT前比较,N组和H组FBF和FVC均显著升高(P<0.05)。见表3。
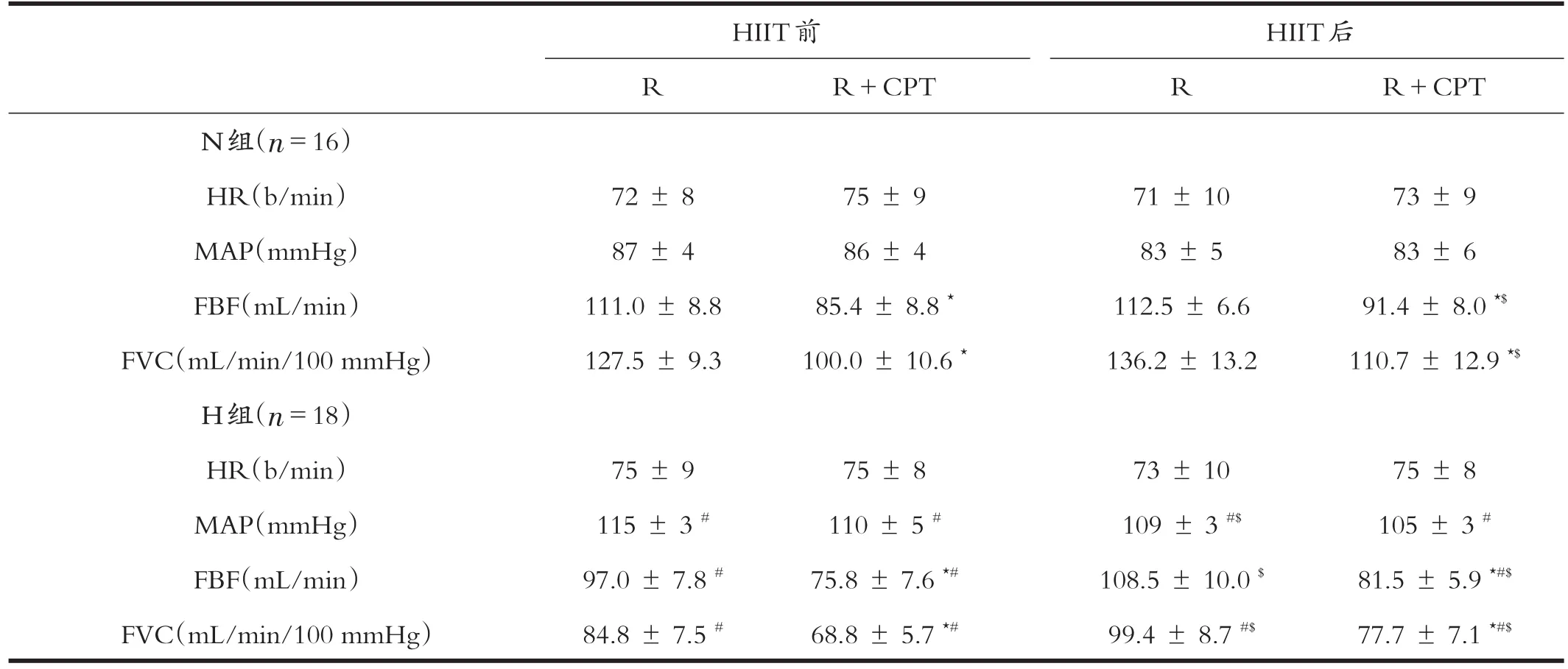
表3 HIIT前后安静时CPT诱导的血液动力学的变化
2.4 HIIT前后握力运动中CPT诱导的血液动力学变化
HIIT前:握力运动中(HG),组间比较,H组MAP显著高于N组(P<0.05),FBF和FVC显著低于N组(P<0.05)。握力运动同时激活交感神经时(HG+CPT),与HG比较,N组和H组FBF和FVC均显著下降(P<0.05);组间比较,H组MAP显著高于N组(P<0.05),FBF和FVC显著低于N组(P<0.05)。HIIT后:握力运动中(HG),组间比较,H组MAP显著高于N组(P<0.05),FBF和FVC显著低于N组(P<0.05);与HIIT前比较,H组MAP显著下降(P<0.05)。握力运动同时激活交感神经时(HG+CPT),与HG比较,N组和H组FBF、FVC显著下降(P<0.05);组间比较,H组MAP显著高于N组(P<0.05),FBF和FVC显著低于N组(P<0.05);与HIIT前比较,N组和H组FBF和FVC均显著升高(P<0.05)。见表4。

表4 HIIT前后握力运动中CPT诱导的血液动力学的变化
2.5 HIIT前后安静和握力运动中交感缩血管反应以及功能性抗交感的变化
HIIT前后,安静时以及握力运动中的交感缩血管反应(%△FVC,即FVC对于交感神经激活的变化率,计算方法详见1.8)见图3。HIIT前,组内与安静时比较,N组和H组握力运动中%△FVC均无显著性差异(P>0.05);组间与N组比较,H组安静时、握力运动中%△FVC均无显著差异(P>0.05)。HIIT后,组内与HIIT前比较,N组和H组安静时%△FVC无显著性差异(P>0.05),握力运动中%△FVC显著性下降(P<0.05);与安静时比较,N组和H组握力运动中%△FVC显著降低(P>0.05);组间与N组比较,H组安静时、握力运动中%△FVC均无显著性差异(P>0.05)。
为进一步探讨功能性抗交感的变化,用安静时与握力运动时%△FVC的差值(即MS)表示功能性抗交感(详见1.8),见图4。HIIT前,N组和H组MS无显著性差异(P>0.05);HIIT后,N组和H组MS均较HIIT前显著升高(P<0.05),而组间比较则无显著性差异(P>0.05)。
图3 HIIT前后安静时以及握力运动中的交感缩血管反应

图4 HIIT前后功能性抗交感的变化
3 讨论
本研究结果发现,原发性高血压患者与正常血压者安静时和握力运动中的交感缩血管反应以及功能性抗交感并无显著性差异,两组受试者经过4周HIIT后安静时的交感缩血管反应无显著性变化,而握力运动中的交感缩血管反应减弱,功能性抗交感增强,提示短期HIIT能够降低中老年原发性高血压患者以及血压正常者握力运动中的交感缩血管反应并改善功能性抗交感,对安静时的交感缩血管反应则无显著影响;此外,血压升高可能并不是高血压患者功能性抗交感活性受损的主要原因。
3.1 实验前H组和N组安静时血液动力学和交感缩血管反应的比较
在本研究中,实验前安静状态下,H组血压(SBP、DBP和MAP)水平高于N组,而FBF和FVC则低于N组,说明高血压患者安静状态下外周阻力增加,骨骼肌血流灌注不良。多项研究采用下身负压[4]或灌注拟交感神经药[16]激活交感神经并诱导缩血管反应,本研究利用无创方法CPT活化交感神经并发现,R+CPT时N组和H组FBF和FVC均显著降低,而%△FVC在两组间无显著性差异,提示高血压患者安静时的前臂交感缩血管反应较正常血压者并无改变。Egan等[28]利用肱动脉灌注去甲肾上腺素(norepinephrine,NE)并测定%△FVC的变化,Vongpatanasin等[4]通过下身负压激活交感神经并利用近红外线光谱术测定前臂指浅屈肌肌氧含量,两项研究结果同样证实,中年高血压患者安静时的交感缩血管反应与正常血压者无显著性差异。动物实验亦得到相似结果[14],即AngⅡ诱导的高血压大鼠安静时%△FVC与正常血压大鼠并无显著性差异。
3.2 实验前H组和N组功能性抗交感的比较
人体实验[4]与动物实验[14]均证实,与正常血压比较,高血压患者/大鼠功能性抗交感受损。运动时交感缩血管反应钝化甚至增加则导致功能性抗交感异常,破坏了肌肉血流量和氧运输之间的动态平衡,进而影响肌肉功能以及运动表现,因此功能性抗交感受损可能是高血压患者运动时血压反应异常升高的重要原因。先前的研究认为血压升高是导致高血压患者功能性抗交感受损的直接原因[4],然而本研究却发现,实验前HG+CPT时%△FVC以及MS在N组和H组间均无显著性差异,提示高血压患者功能性抗交感较血压正常者并无变化。进一步研究则证实[14,29],血压升高本身并不能破坏功能性抗交感,而肾素-血管紧张素系统(renin-angiotensin system,RAS)激活诱导的氧化应激引起内皮损伤以及NO合成/利用减少则是高血压患者功能性抗交感受损的主要原因。
需要提及的是,本研究并未设置健康青年作为对照,因此无法确定纳入的受试者功能性抗交感是否正常。然而研究发现[23,27,30,31],健康青年握力运动中%△FVC较安静时显著下降,且多数文献报道MS大致为-20%~-50%,而在本研究中,N组和H组握力运动中%△FVC与安静时并无显著性差异,且MS分别为-3.4%(N组)和-2.8%(H组),提示两组受试者功能性抗交感可能均存在异常。研究证实,功能性抗交感随增龄以及肢体制动而下降[30],而本研究纳入的受试者均为无规律锻炼的中老年人,故此推测,由于增龄以及久坐生活方式等因素,其功能性抗交感可能较青年人显著降低。
3.3 短期HIIT对H组和N组安静时血液动力学和交感缩血管反应的影响
关于长期HIIT对血压水平的影响,多数研究证实[26,32],其降压效果与有氧运动基本一致。本研究则证实,即使短期(4周)HIIT仍可使轻度高血压患者BP水平下降,且无不良反应发生。结合前人的研究我们推测,若进一步延长干预时间,H组受试者BP水平将进一步下降。此外,本研究还发现,HIIT后安静状态下H组FBF和FVC升高,N组则无显著性变化,提示经过4周HIIT,高血压患者安静时骨骼肌血流灌注得到改善。
安静时的交感缩血管反应随增龄而下调,但规律运动的影响并不肯定。由于运动除对神经系统以及心血管系统产生整体效应外,不同运动方式诱导的生理适应(如血管结构与功能)还具有部位特异性[33],因此推测安静时的交感缩血管反应同样具有运动方式和部位依赖性。横断面研究证实[34],无训练者与长期下肢训练者,其安静时前臂交感缩血管反应无显著性差异。然而Wray等[27]针对自行车运动员(长期下肢运动)和无训练者的横断面研究发现,两组受试者安静时上肢和下肢交感缩血管反应均无显著性差异。纵向研究表明,运动训练对安静状态下交感刺激诱导缩血管反应的影响可能增加[35-39]、降低[16,31]或无变化[40]。研究结论不一致可能与实验对象、运动方案、测试部位以及实验方法等因素有关。在本研究中,HIIT后安静状态下交感激活时(R+CPT),虽然H组MAP仍高于N组,FBF和FVC低于N组,但两组%△FVC与实验前比较并无显著性变化,与Wray等[27]的研究一致,提示安静时的交感缩血管反应并不受运动训练的影响。此外,动物实验亦证实[42],随意跑轮运动对正常血压大鼠和自发性高血压大鼠安静时交感缩血管反应的影响并无显著性差异,与本研究结论类似,然而由于种属、年龄以及运动方案等差异,因此与本研究结果不具可比性。由于HIIT主要为下肢运动,但本研究并未测定下肢交感缩血管反应,因此HIIT对安静时交感缩血管反应的影响是否具有部位特异性尚不得而知。早期研究显示[41],运动员与无训练者进行CPT时肌肉交感神经活性以及血浆NE含量升高的幅度并无显著性差异,说明安静时的交感激活与训练水平无关,这在一定程度上也支持本研究结果。
3.4 短期HIIT对H组和N组功能性抗交感的影响
横断面研究(规律运动者vs.久坐人群)[10]显示,功能性抗交感与骨骼肌功能水平显著正相关。动物实验证实,耐力训练能够改善正常血压[36-38]以及自发性高血压大鼠[42]功能性抗交感并呈现运动强度依赖性。然而在人体研究中,运动能否改善功能性抗交感尚不能确定[10,16,27,43]。在本研究中,实验后N组和H组握力运动中(HG+CPT)%△FVC均较实验前显著性下降,且均较安静时降低,MS则均显著性升高,提示4周HIIT能够降低中老年原发性高血压患者以及血压正常者握力运动中的交感缩血管反应并改善功能性抗交感,与Mortensen等[10]的横断面研究一致。由于高血压患者交感神经活性升高,故改善功能性抗交感对于维持充足的组织灌注具有重要意义,4周HIIT后H组握力运动中FBF和FVC显著性增加进一步证实了这一点。然而以运动员为受试对象的研究则显示[27,43],长期下肢训练能够降低上肢功能性抗交感和上肢血流量,同时对下肢功能性抗交感并无影响,但下肢血流量却显著性增加,其生理作用在于保证代谢活跃的运动肌得到最佳的血流灌注。本研究结果则证实,下肢运动(HIIT)亦可改善上肢功能性抗交感,提示运动对功能性抗交感的作用不存在部位特异性。总之,运动对功能性抗交感的影响与受试对象的运动经历、体能水平、测试肢体、健康状况等多种因素有关。值得注意的是,在Mortensen等[16]的研究中,8周有氧运动能够增强高血压患者功能性抗交感,而本研究受试者的运动时间较短(4周),但两组受试者功能性抗交感均得到改善,分析原因可能与运动方式(HIIT)有关。Ciolac等[21]的研究显示,HIIT可显著下调高血压患者安静时、运动中以及运动后血浆NE(交感神经末梢分泌的激素,可代表全身交感活性)含量,而有氧运动则只能降低安静时和运动中NE水平,且HIIT诱导NE下降的幅度明显高于有氧运动,提示HIIT在改善高血压患者交感神经活性方面明显优于传统有氧运动方式。Meta分析[20]指出,与传统有氧运动方式相比,HIIT对内皮功能和血管硬度的改善效果更佳。此外,运动改善功能性抗交感的效应与运动强度成正比[36],而HIIT属于高强度运动。鉴于在自主神经系统以及血管功能等方面更具时效性且运动强度较高,因此短期HIIT即可对功能性抗交感产生积极作用。
在本研究中,H组安静血压下降而N组无显著性变化,但两组受试者功能性抗交感均得到改善,进一步证实血压水平与功能性抗交感并无直接关联。药理学研究显示[4,44],1型AngⅡ受体阻断剂厄贝沙坦或3代β 1-肾上腺素受体阻断剂奈必洛尔(改善氧化应激)等降压药能够恢复高血压患者功能性抗交感,但噻嗪类利尿剂氯噻酮或传统β1-肾上腺素受体阻断剂美托洛尔却并无效果,提示单纯降低血压对功能性抗交感并无改善作用。前面提到,AngⅡ→氧化应激→内皮功能紊乱→NO合成/利用减少是高血压患者功能性抗交感受损的重要病理生理机制[14,15],而运动能够下调AngⅡ表达[12]、提高抗氧化能力[13]、上调一氧化氮合酶(nitric oxide synthase,NOS)表达[11],因此我们推测,4 周HIIT可能通过抑制RAS、下调氧化应激以及增加NO含量等途径对高血压患者产生降压和改善功能性抗交感的双重效应。Mizuno等[42]的动物实验发现,自主跑轮运动能够改善自发性高血压大鼠功能性抗交感,其机制与NO释放增加及其介导的舒血管作用有关。然而人体研究却发现[45,46],提高NO利用率并不能改善青年男性功能性抗交感。除NO等舒血管物质外,近年的研究证实,内皮依赖性超极化(endothelium-dependent hyperpolarization,EDH)[47]以及血管平滑肌α-肾上腺素受体(α-adrenoreceptor,α-AR)的分布、数量及功能(敏感性)[48]均参与了功能性抗交感的生理过程,因此HIIT改善功能性抗交感还可能与EDH增强以及α-AR脱敏(即对NE的反应性下降)等因素有关,然而这一假设尚需实验研究进一步证实。
4 结论与临床意义
短期(4周)HIIT能够降低中老年原发性高血压患者以及血压正常者握力运动中的交感缩血管反应并改善功能性抗交感,而安静时的交感缩血管反应则不受运动训练的影响;此外,血压升高可能并不是高血压患者功能性抗交感活性受损的主要原因。本研究结果有助于进一步理解运动降压以及改善骨骼肌血流灌注的机制。
高血压患者功能性抗交感受损,运动时的血压反应异常增高,因此运动中和运动后即刻心脑血管不良事件发生率将增加。中等强度持续运动作为高血压患者非药物治疗手段已达成共识,本研究进一步证实,短期HIIT即可明显改善高血压患者功能性抗交感。可以推测,功能性抗交感改善在一定程度上能够抑制高血压患者运动中异常的血压反应,降低心血管不良事件发生;高血压患者在规律运动后能够逐渐提高运动强度和运动时间,进而提升运动能力并改善生活质量。此外,增龄、氧化应激以及疾病状态下,肌肉收缩抑制交感缩血管作用的能力降低。本研究结果说明,运动中的交感缩血管调节能力具有较强的可塑性和适应性,同时也提示,运动训练是防治以交感神经活性增强、血管阻力增加以及功能性抗交感受损为主要特点相关疾病(如高血压、肥胖、代谢综合症等)的重要辅助手段。深入理解功能性抗交感的分子机理以及规律运动的良性效应有助于为上述患者制定新的治疗策略提供依据。
