神经元和混合性神经元-神经胶质肿瘤的影像学表现
2018-08-17福建医科大学附属协和医院影像科福建福州350000
福建医科大学附属协和医院影像科(福建 福州 350000)
孙祎繁 段 青 耿莹茜
神经元和混合性神经胶质肿瘤属于中枢神经系统较少见的一类肿瘤,约占颅内肿瘤的1%~3%,组织学分级多为I~II级,一般预后较好,无需放化疗[1]。本研究通过对经手术病理证实的神经元和混合性神经胶质肿瘤的临床、影像资料并结合文献进行综合分析,探讨其特征性表现,旨在提高对该肿瘤术前诊断的准确性。
1 资料与方法
1.1 研究对象收集2014年1月~2017年6月福建医科大学附属协和医院经手术病理证实且临床及影像资料完整的33例神经元和混合性神经胶质肿瘤,依据世界卫生组织中枢神经系统肿瘤分类和分级标准(2016年)[2],其中中枢神经细胞瘤(central neurorytoma,CNC)5例,胚胎发育不良性神经上皮瘤(dysembryoplastic neuroepithelial tumor,DNET)5例,节细胞胶质瘤14例,间变型节细胞胶质瘤6例,婴儿促纤维增生型星形细胞瘤/节细胞胶质瘤(esmoplastic infantile astrocytoma/ganglioglioma,DIA/DIG)3例,主要症状包括发作性癫痫、头痛、头晕、呕吐等;病程1周~14 年。 33例神经元和混合性神经胶质肿瘤不同分类患者一般资料见表1。
1.2 仪器与方法采用Siemens Magnetom Trio Tim 3.0T超导型MRI装置,使用12通道相控阵头线圈,均行平扫及增强检查,扫描序列包括轴位T1WI、T2WI,轴位液体衰减反转恢复(fluid attenuated inversion recovery,FLAIR)序列。增强扫描采用经肘静脉注射对比剂钆喷酸替葡甲胺(Gd-DTPA),剂量为0.1mmol/kg,分别行轴位、矢状位及冠状位扫描。扩散加权成像(DWI)采用单次激发平面回波成像(EPI)序列,TR 5100ms,TE 90ms,b值=1000s/mm2,所有序列层厚5.0mm,层间距1mm。
2 结 果
2.1 CNCCNC 5例,1例肿瘤位于左侧额颞叶,占位效应明显,邻近脑室受压变形,中线结构向右侧移位;其余4例肿瘤位于侧脑室前中部,与室间孔关系密切,肿块以宽基底与透明隔相连或分界不清,均使透明隔不同程度移位、变形,双侧侧脑室扩大,以患侧为著,且伴有不同程度梗阻性脑积水。肿瘤表现为类圆形或不规则形肿块,可见分叶,边缘清楚,最大径3.7~4.8 cm,均呈囊实性,实性部分T1WI呈等或稍低信号,T2WI呈等或稍高信号,DWI呈稍高或高信号;囊性部分多位于肿瘤的周边,呈T1低T2高信号。1例肿瘤多发囊变之间见细网状分隔而呈“蜂窝”状或“丝瓜瓤”样改变,增强扫描实性部分轻中度强化,囊性部分未见强化;3例瘤体内或边缘见迂曲的流空血管影,增强后血管明显强化。3例病灶见条索状、幕状粘连于侧脑室壁,MRI矢状位显示最佳(图1-3)。4例脑室内肿瘤均未见侵犯邻近脑实质,无明显瘤周水肿;1例左侧额颞叶肿瘤见轻度瘤周水肿。
2.2 DNETDNET 5例,均为单发,4例位于幕上大脑半球皮层及皮层下,1例位于右侧小脑半球。4例表现为类圆形,1例呈脑回状(图4-6)。病灶T1WI呈低信号,T2WI呈高信号,DWI呈低信号,FLAIR序列上呈低信号,其中2例病灶周围见环状高信号,1例病灶可见分隔存在,呈多囊状。增强扫描3例病灶无强化,1例见小结节样强化,1例见分隔状强化。5例肿瘤周围无明显水肿,未见占位效应。5例病灶均未见钙化,1例小脑半球病灶继发出血。
2.3 节细胞胶质瘤节细胞胶质瘤20例,均为单发,其中间变型6例;主要累及皮层及皮层下白质,位于或主要位于颞叶9例,额叶3例,枕叶2例,顶叶1例,脑干1例,幕下4例。20例中,呈实性表现为局部脑回增厚6例(图7-9),平扫呈均匀性T1低T2高信号,增强后呈轻-中度强化;呈实性伴有囊变坏死7例,囊变部分位于病灶边缘或中央,单发或多发,多发可见分隔,增强后实性成分及分隔轻-中度强化;呈囊性并有壁结节5例,平扫壁结节呈T1等或低信号、T2高信号,增强后壁结节明显强化,囊壁呈环形强化;另2例仅行CT平扫表现为钙化灶。6例间变型节细胞胶质瘤均表现为实性或实性伴有囊变坏死。20例中16例表现为瘤周无或轻度水肿,4例间变型表现为中度水肿。
2.4 DIA/DIGDIA/DIG 3例,均为单发,2例位于颞叶,1例位于额叶内,位置均较表浅。3例均表现为囊实性,囊性部分T1WI呈低信号,T2WI呈高信号,2例表现为多个囊腔;实性部分T1WI呈等信号,T2WI呈稍高信号,增强扫描囊壁及实性部分明显均匀强化(图10-12)。3例肿瘤周围轻度水肿,见占位效应。
3 讨 论
根据2016年WHO中枢神经系统肿瘤分类,神经元和混合性神经胶质肿瘤分为DNET、节细胞瘤、节细胞胶质瘤、间变型节细胞胶质瘤、小脑发育不良性节细胞瘤、DIA/DIG、乳头状胶质神经元肿瘤、形成菊形团的胶质神经元肿瘤、CNC、脑室外CNC、小脑脂肪神经细胞瘤、副神经节瘤,并新增了1种类型:弥漫柔脑膜胶质神经元肿瘤[2]。本研究只包含其中5种,虽然病理类型较少,但均具有一定的特征性影像学表现,了解这些特征有助于提高诊断的准确性。
3.1 CNCCNC发病率占颅内肿瘤的0.25%~0.50%,好发于中青年,20~40岁多见,属于WHO II级,分为脑室内CNC和脑室外CNC。主要临床表现为头痛、恶心、呕吐及视物模糊等颅内压增高的症状。目前倾向于CNC起源于室管膜下具有向神经元和神经胶质细胞双向分化潜能的生殖源性细胞。典型发病部位为侧脑室前2/3部近室间孔区,以宽基底与透明隔相连,本研究中侧脑室病灶均与透明隔或室间孔关系密切;脑室外CNC较罕见,多为个案报道,本研究1例发生在左侧额颞叶。CNC多呈边缘清楚分叶状肿块,一般不侵犯邻近脑实质,瘤周水肿罕见。肿瘤易囊变,文献报道CNC囊变形式多样,其囊变的大小、形态可能与肿瘤体积或血供有关[3],本研究囊变多位于肿瘤周边,可能与病例数过少有关;CNC钙化和出血少见,多呈囊实性病灶,李威等[4]认为肿瘤内多发囊变之间见细网状分隔而呈“蜂窝”状或“丝瓜瓤”样为CNC较特征性改变,增强扫描分隔及实性部分轻中度强化。CNC血供较丰富,病灶内或边缘可见血管流空影,也被认为是其特征性表现,本研究3例病灶内可见此征象。侧脑室病灶与脑室壁及透明隔间常可见幕状、条索状相连,周万军等[5]认为肿瘤边缘的这种绳索样改变也较具有特征性。脑室内CNC的MRI表现具有一定的特征,但需与室管膜瘤、室管膜下巨细胞型星形细胞瘤、脉络丛乳头状瘤等相鉴别。
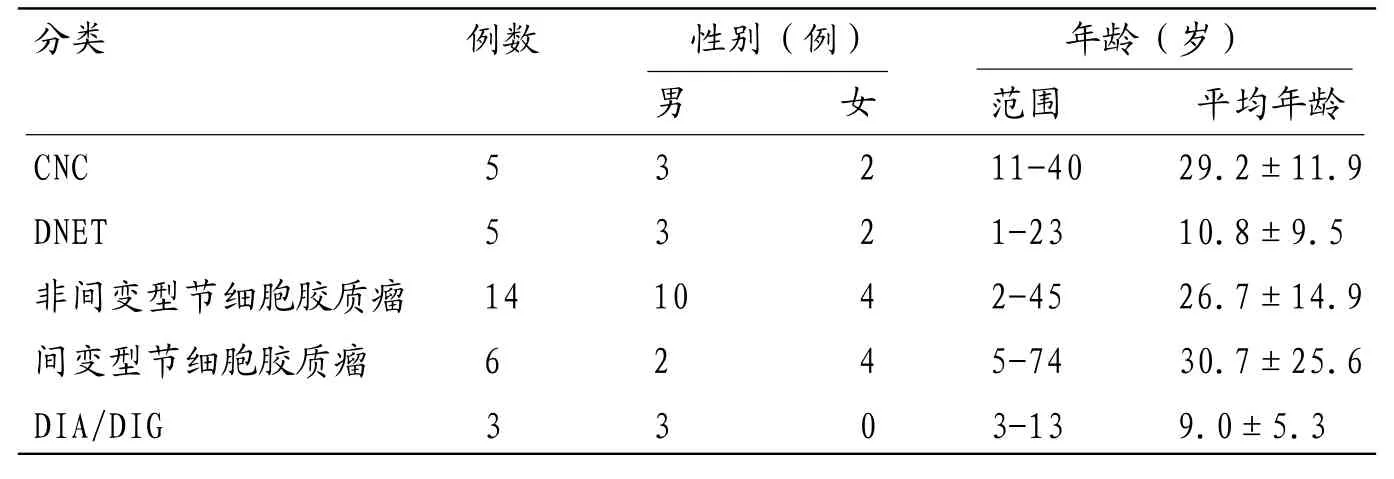
表1 33例神经元和混合性神经胶质肿瘤不同分类患者一般资料比较
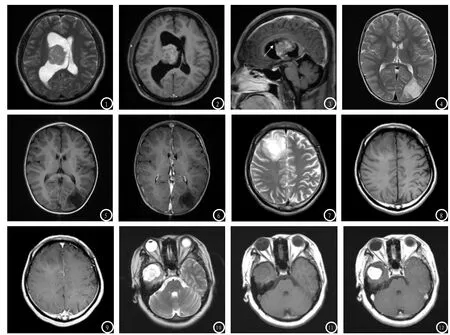
图1-3 男,39岁,中枢神经细胞瘤,WHO II级。T2WI示右侧侧脑室体部肿瘤,呈等信号,见多发小囊变影(图1);增强扫描轴位图像示病灶实性部分中度强化,侵及侧脑室壁,可见牵拉索条状影(图2);增强扫描矢状位图像示病灶见蒂状与侧脑室壁相连,箭号所示肿瘤蒂状粘连于侧脑室壁(图3)。图4-6 男,2岁,胚胎发育不良性神经上皮瘤,WHO I级。左枕叶皮层区囊性病灶,T2WI呈高信号(图4);T1WI呈低信号(图5);瘤周轻度水肿,增强扫描未见强化(图6)。图7-9 男,30岁,节细胞间质瘤,WHO I级。右侧额叶实性肿瘤,边界尚清,T2WI呈高信号(图7);T1WI呈等低信号(图8);瘤周轻度水肿,增强扫描肿瘤轻度强化(图9)。图10-12 男,13岁,婴儿促纤维增生型星形细胞瘤/节细胞胶质瘤。右侧颞叶囊实性肿瘤,边界清楚,T2WI呈混杂高信号(图10);T1WI呈等低信号(图11);瘤周无水肿,增强扫描肿瘤实性部分明显强化(图12)
3.2 DNETDNET属于WHO I级,好发于儿童及青少年,年龄多<20岁,临床上多有药物难治性癫痫病史。本研究中80%患者在20岁前出现症状,5例中4例有癫痫发作病史,与文献报道[6]一致。目前认为DNET起源于中枢神经系统发育过程中的中间生发层,典型病理特征是具有特殊胶质神经元成分,由不同比例的少突胶质样细胞、神经元及星形细胞构成,可伴有邻近皮质发育不良[6]。DNET多发于幕上大脑皮层或累及皮层下白质,颞叶和额叶多见。可呈三角状、脑回状或类圆形,MRI上,T1WI呈低信号,T2WI呈高信号,肿瘤内可见类似皮质信号的线状分隔或结节灶,Fernandez等[7]认为“分隔征”和“三角征”(指肿瘤基底部位于大脑表面,尖端指向大脑深部)具有特异性,有助于与低级星形细胞瘤鉴别,本研究未见典型的三角征,1例瘤内见分隔,考虑与样本数量少有关。FLAIR上病灶内部呈低信号,周围可见环状高信号,Parmar等[8]认为这种改变具有特征性,其病理基础为肿瘤周围疏松的神经胶质成分,表现出DNET的良性生物学行为,本研究2例可见此征象。增强扫描大部分无明显强化,部分病灶内见小结节样、分隔状强化。瘤内钙化、出血少见,本研究1例肿瘤继发出血,此类肿瘤的血管由弧形的枝芽毛细血管组成,血管直接穿越黏液基质而无星形细胞支撑,此为导致肿瘤出血的病理基础[9]。DNET多无或有轻度占位效应,无瘤周水肿。该肿瘤需与低级别星形细胞瘤、节细胞胶质瘤、少突胶质细胞瘤等相鉴别。
3.3 节细胞胶质瘤节细胞胶质瘤多为WHO I级或II级,间变型节细胞胶质瘤为WHO III级;好发于儿童和青年,30岁以下占80%,性别无明显差异。主要由不同比例的增生胶质细胞和成熟神经节细胞组成,肿瘤可生长于中枢神经系统任何部位,最好发于颞叶,文献报道发生于颞叶的肿瘤多在病灶较小时就能引起明显症状,原因在于其本身含有致癫痫区[10]。本研究20例中9例位于颞叶,与报道一致。张序昌等[11]认为囊变和钙化是节细胞胶质瘤常见表现,本研究影像表现多分为囊性伴壁结节病灶和实性伴囊变坏死病灶,有2例CT仅表现为钙化灶,与文献报道基本一致;节细胞胶质瘤瘤周水肿与WHO病理分级相一致,WHO I~II级肿瘤无水肿或轻度水肿,WHO III级则多表现为中重度水肿,可能是肿瘤恶性程度越高,瘤周血脑屏障破坏越甚,导致细胞液外渗增加所致[12];增强扫描节细胞胶质瘤强化方式亦与肿瘤信号特点及恶性程度密切相关,一般恶性程度越高,强化程度越明显。间变型节细胞胶质瘤与高级别的星形细胞瘤多难以鉴别。。
3.4 DIA/DIGDIA/DIG是一种中枢神经系统罕见的肿瘤,1993年确立为中枢神经系统新的肿瘤类型,属于WHO I级,至今文献报道仅60余例,是一种位于幕上的胚胎性肿瘤,多好发于2岁以内的婴幼儿,本研究中3例年龄偏大,可能与病例数过少有关,其预后一般较好,外科手术可治愈。该肿瘤大体上由质地坚实的实性部分和多囊性部分组成,镜下见明显纤维组织增生伴神经上皮成分,根据神经上皮成分的分化类型分别用婴儿促纤维增生型星形细胞瘤(DIA)或婴儿促纤维增生型节细胞胶质瘤(DIG)作为诊断名称[13]。肿瘤位置多较表浅,位于幕上大脑皮质及软脑膜,常与硬脑膜相连,肿瘤位置表浅且贴近脑膜认为是DIA的特征性表现[14]。典型影像表现肿瘤由实性和囊性两部分组成,且囊性占肿瘤的大部分,多个囊腔组成肿瘤的囊性部分,囊壁、分隔及实性部分明显强化。本研究3例病灶均表现为囊实性,与文献报道基本一致。
总之,颅内神经元及混合性神经胶质肿瘤是颅内少见肿瘤,病程多较长,肿瘤边界多清楚,瘤周水肿轻微或无水肿,瘤体内常有囊变或钙化,增强扫描多轻度强化或无强化,不同类型各具其好发部位并且多有一定的特征性表现,结合年龄和临床表现,常可做出倾向性诊断。
