美洛昔康片对比格犬的靶动物安全性评价
2018-08-15徐恩民冯言言吴连勇
林 红,徐恩民,郑 莉,冯言言,孟 芳,孔 梅,吴连勇
(1.齐鲁动物保健品有限公司,济南250100;2.山东省兽药质量检验所,济南250022)
美洛昔康[1]是一种新型烯醇酰胺类的非甾体类抗炎药物(Non-Steroidal Anti-Inflammatory Drug,NSAID),作用机制主要是抑制前列腺素(Prostaglandins,PGs)环氧化酶,阻止花生四烯酸转化为PGs而发挥抗炎、止痛和解热作用,而且毒副反应小。袁占奎等[2]报道,股骨头切除术是宠物临床上常见的手术,可继发骨关节炎等,其手术过程中及术后恢复期均会对犬产生很大的疼痛应激。李凯年报道,骨关节炎[3]是犬的一种退行性骨关节疾病,也是犬的一种比较多发的疾病。李彦等报道,犬髋关节发育不良(Canine Hip Dysplasia CHD)是一种以遗传性为基础的后天发育畸形,是由多种病因导致的复合性疾病。炎症和疼痛是其临床适应症之一。美洛昔康作为一类常用的NSAID,在临床上广泛用于骨关节炎、类风湿性关节炎、多种发热和各种疼痛症状的缓解,与其他非甾体类抗炎药相比,严重胃肠道等不良反应的发生率明显降低。
美洛昔康于2000年6月获FDA批准,用于缓解骨关节炎症状。德国Boehringer Ingelheim Vetmedica, Inc作为原研厂家,FDA和欧盟先后批准了多家公司生产的美洛昔康注射液、口服溶液、片剂等一系列产品,从批准上市以来,在靶动物犬等兽医临床上广泛应用,未见不良反应报道。通过本研究可了解比格犬对美洛昔康片的临床不良反应和中毒剂量对犬的组织病理学和生理生化指标的影响,提出美洛昔康片的不良反应、防治措施及临床应用时的注意事项,以确保临床用药的安全性。
1 材料与方法
1.1 受试药物和试剂 美洛昔康片,规格2.5 mg/片;批号:1307002,由齐鲁动物保健品有限公司提供。生理生化分析配套试剂,结晶紫染液,中性红染液,蒸馏水等。
1.2 仪器设备 ARCO PC型全自动生化分析仪,意大利BIOTECNICA公司;Hemastar II型血液分析仪,法国Yoder公司;RM2235切片机,德国莱卡公司。
1.3 试验动物 三色健康比格犬24只,12~16月龄,体重11.4~14.2 kg左右,雌雄各半,由北京海淀区苏家坨比格犬试验场提供。所有比格犬均已经多联苗免疫和驱虫处理。基础日粮不含任何药物添加剂,饲养笼内封闭式饲养,自由采食和饮水。
1.4 试验分组及给药[4]将比格犬随机分成4个组,每组6只,雌雄各半,试验前预饲7 d,临床观察健康后,各试验组犬按试验设计给药,试验周期21 d。每日上午8点给药,试验分组及给药如表1。
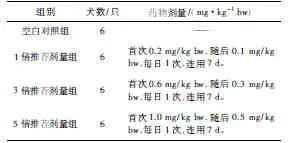
表1 试验分组及给药Tab 1 The test group and drug administration
1.5 试验检测指标
1.5.1 采食量、日增重及饲料转化率 在试验开始给药前(0 d)和最后一次给药后(给药第7天)分别按组别称量犬只体重,称重均在早晨空腹进行,同时记录各组犬的采食量,计算平均日耗料量,进而计算其饲料转化率(耗料/增重)。
1.5.2 临床表现(大小便、外观行为,体温、呼吸频率和脉搏) 试验前观察一周,观察犬的行为、活动、饮水、摄食、毛发、精神、体重等,稳定后进行试验。整个试验期,每日于给药后观察并记录各组犬的健康状况和临床表现(大小便、外观行为、体温、呼吸频率和脉搏等),记录死亡数,并计算各组的死亡率和成活率。一般观察:每天上午和下午给药后观察记录犬的一般体征,并于给药前测定犬的体温、呼吸频率和脉搏,发现有反应的犬重点观察。
1.5.3 血液生理指标 犬血液生理指标委托动物医学院国家兽药安全评价中心进行实验室检测分析。在试验开始给药前(0 d)、给药后3 d和最后一次给药后7 d对各组犬进行臂头静脉采血,进行白细胞计数(WBC)、红细胞计数(RBC)、血红蛋白(HGB)、红细胞压积(HCT)、血小板计数(PLT)等血液生理指标测定。
1.5.4 血液生化指标 犬血液生化指标委托动物医学院国家兽药安全评价中心进行实验室检测分析。在试验开始给药前(0 d)、给药后3 d和最后一次给药后7 d对各组犬进行臂头静脉采血,进行丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总蛋白(TP)、白蛋白(ALB)、尿素氮(BUN)、肌酐(CREA)、血糖(GLU)、总胆红素(TBIL)等血液生化指标测定。
1.5.5 大体剖检 对试验过程中的死亡犬,以及试验结束后全部5×推荐剂量组和空白对照组(必要时包括3×推荐剂量组)的犬进行安乐死,进行大体剖检。
1.5.6 组织病理学检查 对于空白对照组和5×推荐剂量组犬实施安乐死,分别取心脏、肝脏、肾脏、肺脏、脾脏、胃等组织进行固定、包埋,使用切片机进行常规石蜡切片,之后进行H.E.染色和组织病理学检查。
1.6 数据统计处理 用统计学软件SPSS14.0进行方差分析和X2(卡方)检验分析各组之间的日增重、饲料转化率、血液生理生化指标的差异显著性。P<0.05表示差异显著,P<0.01表示差异极其显著。
2 结果与分析
2.1 各剂量组犬采食量、日增重及饲料转化率比较 药物对动物体重的影响:整个试验期间,空白对照组、1×推荐剂量组和3×推荐剂量组、5×推荐剂量组比格犬体重增加无明显影响,体重随时间延长而增加,与空白对照组犬相比差异不显著(P>0.05),说明连续大剂量给予美洛昔康片不会较大程度改变动物体重,对饲料转化率影响不大,说明动物的机体代谢水平仍维持在正常生理状态。结果见表2。
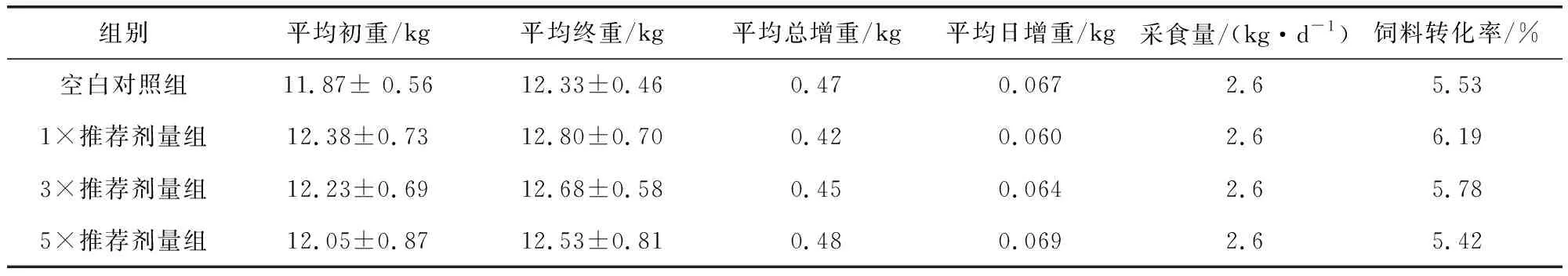
表2 各组比格犬在给药前后的采食量、日增重和饲料转化率Tab 2 Food intake, weight gain, feed conversion ratio of beagle dogs in each group before and after treatment
2.2 各剂量组犬临床表现(体温、脉搏和呼吸频率)比较 对所有比格犬连续给药7 d期间,观察其行为未见异常、活动自如、皮毛光亮、口眼鼻耳无分泌物、摄食饮水正常、大便正常、尿颜色正常,未见任何明显毒副作用,也未发现动物死亡。不同组别比格犬体温、脉搏和呼吸频率均在正常参考值范围之内,见图A~图C。
2.3 各剂量组犬血液生理、生化指标比较 血液学指标检查:在试验开始给药前(0 d)、给药后3 d和最后一次给药后7 d的采血进行血液学生理指标检查,结果表明:试验组与对照组犬血液学指标均在犬正常生理指标范围之内,因此未进行统计学分析(表3~表5)。
血清生化指标检查:在试验开始给药前(0 d)、给药后3 d和最后一次给药后7 d进行血清生化指标检查,数据采用SPSS14.0统计软件计算各指标的平均值与标准差,结果表明:试验组与对照组生化指标均在正常范围之内,之间无显著差异(见表6~表8)。
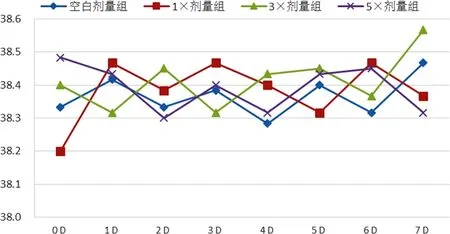
图A 各组比格犬给药后不同时间点体温情况Fig A Body temperature of dogs at different time after treatment
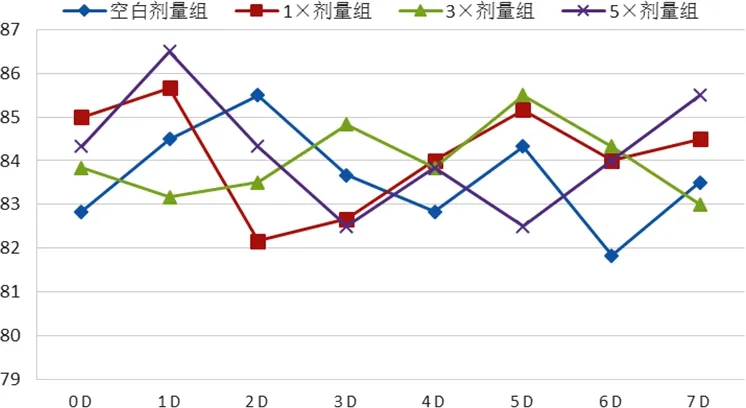
图B 各组比格犬给药后不同时间点脉搏情况Fig B Pulse of dogs at different time after treatment
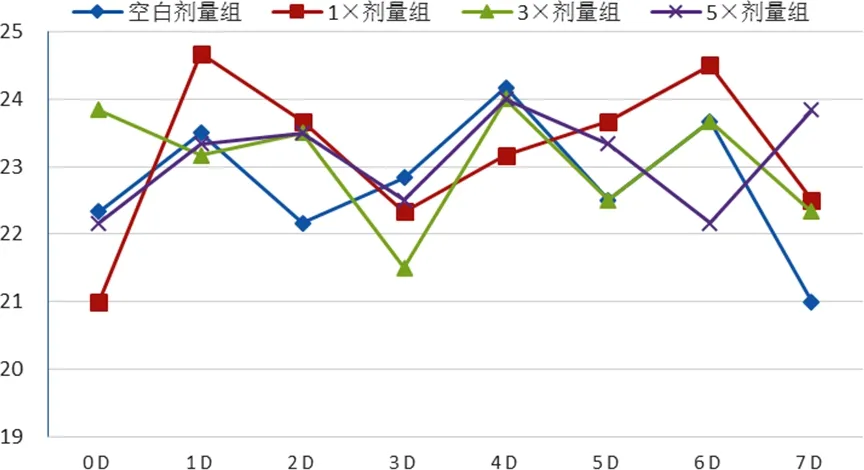
图C 各组比格犬给药后不同时间点呼吸频率情况Fig C Respiratory rate of dogs at different time after treatment
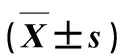
表3 各组比格犬在试验开始给药前(0 d)时血液生理指标值Tab 3 Hematology index value of beagle dogs before treatment(day 0)
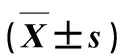
表4 各组比格犬在给药后3 d时血液生理指标值Tab 4 Hematology index value of beagle dogs after treatment(day 3)
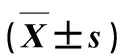
表5 各组比格犬在最后一次给药后(7 d)时血液生理指标值Tab 5 Hematology index value of beagle dogs after treatment(day 7)

续表
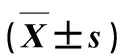
表6 各组比格犬在试验开始给药前(0 d)时血液生化指标值Tab 6 Biochemistry parameters value of beagle dogs before treatment(day 0)
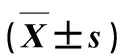
表7 各组比格犬在给药后3 d时血液生化指标值Tab 7 Biochemistry parameters value of beagle dogs after treatment(day 3)
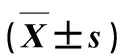
表8 各组比格犬在最后一次给药后(7 d)时血液生化指标值Tab 8 Biochemistry parameters value of beagle dogs after treatment(day 7)
2.4 空白对照组和5×推荐剂量组犬大体剖检结果
从正常比格犬与5×推荐剂量组比格犬大体剖检来看,心包膜和心脏、肺脏、脾脏、肝脏、肾脏等,被膜颜色正常,脏器表面无异常,边缘整齐,无出血点或坏死病症,说明5×推荐剂量连续给药7 d对犬脏器无肉眼可见的不良影响。
2.5 空白对照组和5×推荐剂量组犬组织病理学检查结果
2.5.1 空白对照组犬不同组织病理学观察 组织病理学观察发现,空白对照犬的各个主要内脏器官结构完整清晰,可作为对照使用。
2.5.2 5 ×推荐剂量组犬组织病理学观察 对采集的6只5×推荐剂量犬的心脏、肺脏、肝脏、肾脏、脾脏、胃(共6种)组织进行固定、包埋,使用切片机进行常规石蜡切片,之后进行H.E.染色,其结果见表9。
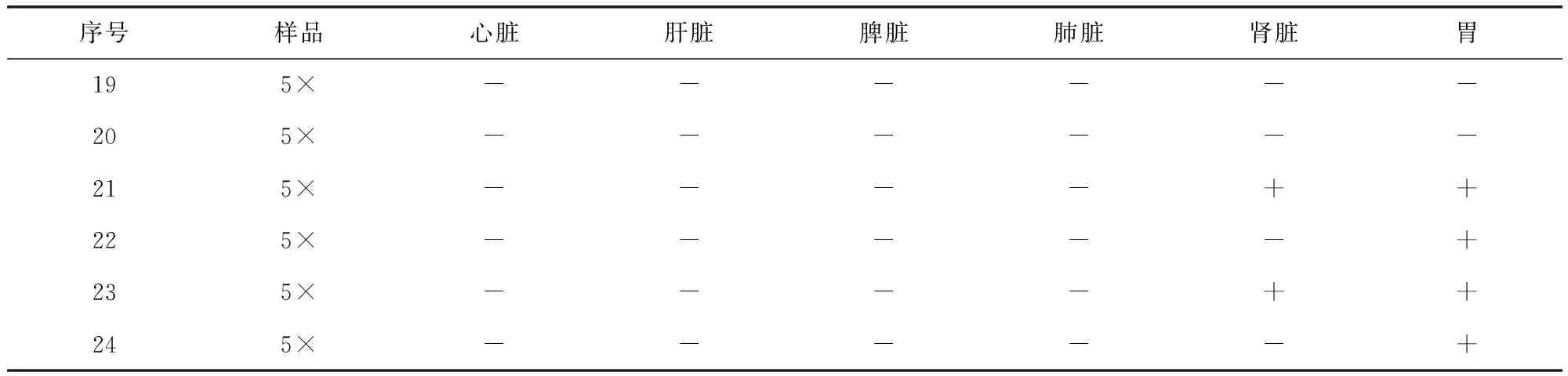
表9 5×推荐剂量组犬组织病理学观察结果Tab 9 Histopathological observation of dogs of 5 times recommended dosage group
经观察可见,该犬心肌纤维排列致密整齐,心肌细胞细胞核完整(图D);肝脏有一定程度的肝细胞空泡化(图E);肺脏的肺泡壁完整,肺泡腔内透亮(图F);脾脏结构清晰,可见脾小梁、白髓区的脾小结、中央动脉和红髓区的血窦等结构(图G);肾小管管腔中有絮状物质沉着(图H);胃黏膜上皮细胞上有炎性物质渗出(图I)。
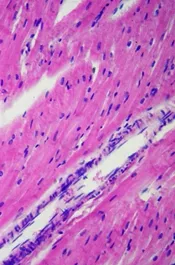
图D 19号犬心脏(40X)Fig D Heart of No.19 dog(40X)
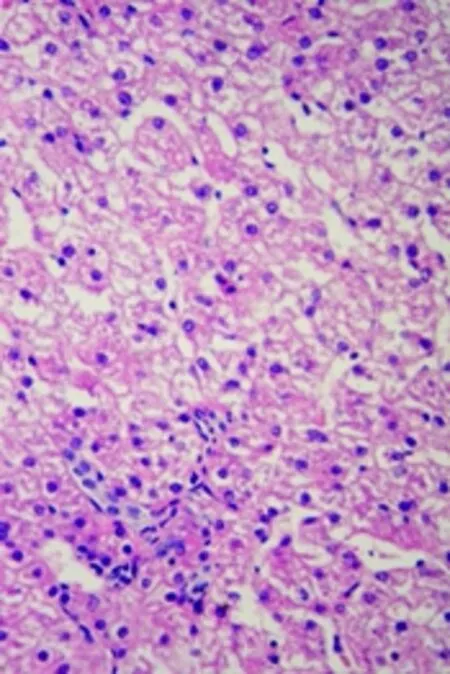
图E 20号犬肝脏(40X)Fig E Liver of No.20 dog(40X)
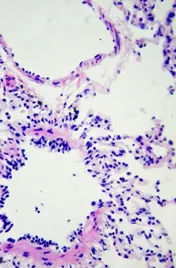
图F 21号犬肺脏(40X)Fig F Lung of No.21 dog(40X)
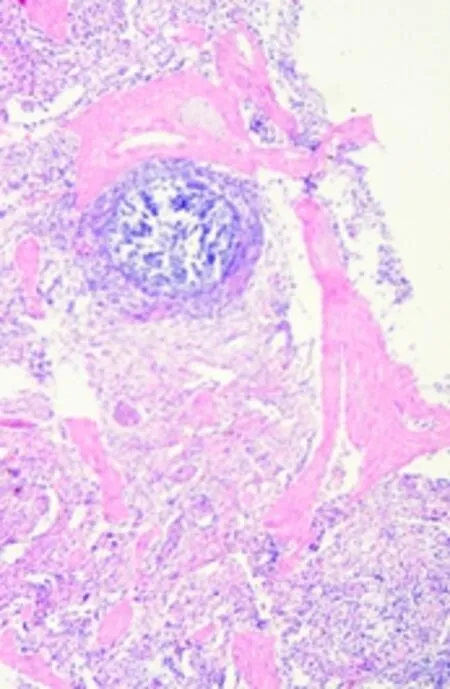
图G 22号犬脾脏(10X)FigG Spleen of No.20 dog(40X)
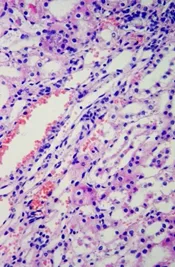
图H 22号犬肾脏(40X)Fig H Kidney of No.22 dog(40X)
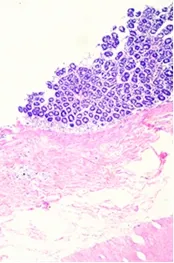
图I 23号犬胃(10X)Fig I Stomach of No.23 dog(40X)
3 讨论与结论
原研单位报道了6~8月龄的比格犬使用美洛昔康后的安全性,将犬随机分成4组,首次皮下注射0、0.2、0.4、0.6 mg/kg bw的美洛昔康注射液,然后按0.1mg/kg bw剂量每天内服美洛昔康混悬液,连用6 d。观察并记录犬的临床症状、体重、采食和饮水量,7 d后所有犬进行尸体剖检。结果发现,犬未表现临床不良反应,体重、采食量、饮水量未受影响;第4 d对照组的一只母犬和第5天中剂量组的一只公犬的粪便测定为潜血阳性,其他样品均为阴性,这与该品种和年龄犬的预期情况一致。血液生理学和生化参数中未发现与临床治疗有关的变化。尸检时,胃肠道中未观察到溃疡和出血;治疗前后,犬表现短暂的胃肠道症状,如呕吐、粪便变软和腹泻,这与EMA的报道一致,但因清洗期也出现了类似症状,因此认为这与治疗无关。综上说明美洛昔康在犬注射和内服应用的安全性较高。美洛昔康片作为内服剂型,经试验证明其与内服混悬液是生物等效的,推断美洛昔康片在犬应用是安全的。
刘宏[5]研究了美洛昔康片对犬的安全性。试验选取24只10 kg左右的健康中华田园成年犬,公母各半,随机分为4组,每组6只。试验设空白对照组(0 mg/kg bw)、临床推荐剂量组(0.1 mg/kg bw)、3倍临床推荐剂量组(0.3 mg/kg bw)、5倍临床推荐剂量组(0.5 mg/kg bw)。每天给药1次,连续给药28 d。通过与刘宏的研究发现,给药7 d后,我们测定的红细胞数与其数据一致,但白细胞数量偏低,这可能与所用试验动物的种类不同有关,但都在正常生理范围内,且正常生理范围值一致。血液生化测定指标中,1、3、5倍的天门冬氨酸氨基转移酶(AST)的测定结果虽然略有差别,但与空白对照组相比,都有升高的趋势。这两个试验结果都表明,犬服用美洛昔康片后各项生理生化指标均在正常生理范围内,说明其临床应用是安全的。
袁震[6]报道了美洛昔康口服液对犬的安全性评价,首次剂量加倍,从第二天开始剂量减半,每天一次,连用5 d,给药后第7 d与其第6 d的测定结果相比,无论是生理指标中的红细胞数、白细胞数,还是生化指标中的丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)和总蛋白(TP)的测定结果均在试验犬的正常生理范围内,且与对照组相比,差异均不显著。
本研究表明,美洛昔康片按推荐剂量使用,对靶动物犬是安全的。
