猪瘟抗体胶体金快速定量检测卡的研制
2018-08-13李成洪宋青龙王晓中杨春柳
李成洪,宋青龙,王晓中,唐 达,傅 巍,杨春柳
(1.重庆市畜牧科学院,重庆 402460,2.北京龙科方舟生物工程技术有限公司,北京 100193; 3.国家饲料工程技术研究中心,北京 100193)
猪瘟是由猪瘟病毒(CSFV)引起的一种急性、发热、具有高度传染性的疫病,在自然条件下只感染猪,不同年龄、性别、品种的猪和野猪都易感,一年四季均可发生,且病死率高,传播迅速,蔓延地区广,对养猪业构成了极大威胁。本病在1833年首次发现于美国,之后其流行遍及全球,给养猪业造成巨大的经济损失[1]。20世纪50年代,我国猪瘟兔化弱毒疫苗问世后,对猪瘟的控制主要依赖于疫苗免疫,因此,疫苗免疫效果的优劣对猪瘟防控起了决定性作用,而猪瘟抗体水平的监测是疫苗免疫效果评价的主要方法[2]。目前市场上检测猪瘟抗体的产品主要是进口的ELISA试剂盒[3],但其价格昂贵,需要专业人员操作,且检测时间长[4]。而现有的猪瘟抗体胶体金及荧光免疫层析检测卡,只能做定性检测[5],即根据T线的有无判定样本中猪瘟抗体的阴阳性[6-8]。这种判定凭肉眼观察[9-10],主观性较强,且结果对于疫苗免疫效价的评定意义不大。因此,应用胶体金免疫层析技术,结合胶体金定量读数仪,进行了快速定量猪瘟抗体检测卡的研制,以期可快速定量检测猪血清中猪瘟抗体水平。
1 材料与方法
1.1 材料
1.1.1 实验材料 氯金酸(HAuCl4·4H2O),国药;猪瘟重组E2蛋白,北京龙科方舟生物工程技术有限公司;羊抗鼠IgG、小鼠IgG,上海金标生物科技有限公司;硝酸纤维素膜,Millipore;胶体金结合垫、样品垫、吸水纸,上海金标生物科技有限公司;猪瘟病毒抗体检测试剂盒(ELISA),IDEXX;猪圆环病毒病阳性血清、猪伪狂犬病阳性血清、猪繁殖与呼吸综合征阳性血清、猪乙型脑炎阳性血清、待检血清,重庆市畜牧科学院。
1.1.2 仪器设备 三维平面点膜喷金仪HM3030,上海金标生物科技有限公司;微电脑自动斩切机ZQ2000,上海金标生物科技有限公司;高速冷冻离心机H-2050R,长沙湘仪离心机仪器有限公司;紫外连续扫描分光光度计,Thermo;数显磁力搅拌电热套,天津市莱玻特瑞仪器设备有限公司;手持式胶体金定量读数仪,深圳元秦科技有限公司;电热恒温鼓风干燥箱,上海一恒科学仪器有限公司。
1.2 方法
1.2.1 胶体金溶液的制备 在圆底烧瓶中加入1 L超纯水加热至煮沸,加入10 mL 1%氯金酸溶液,2 min后加入12 mL 1%柠檬酸三钠溶液,此时溶液颜色由黑色逐渐变为酒红色。继续煮沸15 min后停止加热,冷却至室温,4 ℃贮存。紫外扫描检测胶体金溶液质量。
1.2.2 抗原最佳标记pH值的确定 取1 mL胶体金溶液,分别加入1、3、5、8、10、15、20 μL浓度为0.2 mol/L的碳酸钾(K2CO3)溶液调节pH值[11],猪瘟重组E2蛋白按照0.02 mg/mL标记,终浓度1% BSA封闭,离心去上清液后用磷酸盐缓冲溶液(PBS)洗涤一次,再次离心后用150 μL悬浮液悬浮。小鼠IgG按照0.01 mg/mL标记后,与标记好的抗原等体积混匀。混合液按10 μL/cm喷金量包被在胶体金结合垫上,37 ℃干燥2 h。
猪瘟重组E2蛋白和羊抗鼠IgG分别稀释到1.0 mg/mL,按1 μL/cm划膜量包被到NC膜上,37 ℃干燥1 h。组装大板、切条,用猪瘟病毒弱阳性血清检测,观察T线显色情况,选择没有死金的且显色最强的K2CO3溶液用量作为最佳标记pH值。
1.2.3 抗原最佳标记浓度与最佳包被浓度的确定
用确定的最佳标记pH值,猪瘟重组E2蛋白分别按照0.01、0.02、0.03、0.04 mg/mL标记,小鼠IgG按照0.01 mg/mL标记。猪瘟重组E2蛋白分别按照0.2、0.4、0.8、1.0 mg/mL包被在T线位置,进行正交实验,检测猪瘟病毒阳性血清、弱阳性血清和阴性血清。选择弱阳性血清显色明显且阳性血清与弱阳性血清显色差异最大的组合为最佳条件。在此条件下,羊抗鼠IgG按照分别按照0.8、1.0、1.2、1.4 mg/mL包被在C线位置,检测猪瘟病毒阳性血清,选择C线显色强度与T线相当的包被浓度为最佳条件。
将包被有猪瘟重组E2蛋白和羊抗鼠IgG的硝酸纤维素膜、喷有猪瘟重组E2蛋白偶联胶体金的聚酯垫、玻璃纤维滤纸与吸水纸组装在PVC底板上,用切条机切成4.0 mm宽的试纸条,装入检测卡壳中,即为最终的检测卡。
1.2.4 样品检测方法的确定 将猪瘟阳性血清、弱阳性血清、阴性血清分别取50、80、100、150 μL加到加样孔中,室温反应10、13、15、20 min观察结果,确定加样量及反应时间。
1.2.5 标准曲线的建立 用猪瘟阴性血清按梯度稀释阳性血清,用ELISA试剂盒检测并计算其阻断率,分别取80 μL加到检测卡的加样孔中,室温反应15 min,放入胶体金定量读数仪中,读取T线与C线的峰面积比值即T/C值,每个浓度重复检测5次,计算平均值。以T/C值平均值为横坐标、血清样本阻断率为纵坐标,制作标准曲线。
1.2.6 结果判定方法的建立 检测卡检测20份猪瘟抗体阴性血清,用定量读数仪读取T/C值,计算cutoff值。检测临床样本的T/C值小于该值判定为阴性,大于该值同时小于阻断率为40血清样本对应的T/C值为灰区,大于阻断率为40血清样本对应的T/C值的样本则以定量读数仪结果为最终结果。
1.2.7 检测卡特异性检测 猪瘟检测卡分别检测猪圆环病毒病阳性血清、猪伪狂犬病阳性血清、猪繁殖与呼吸综合征阳性血清、猪乙型脑炎阳性血清,确定本检测卡的特异性。
1.2.8 检测卡重复性及加速稳定性检测 检测卡分别检测猪瘟抗体阴性、弱阳性、阳性血清,每份血清样本重复检测5次,考察其重复性。将检测卡放置于45 ℃温箱中,分别于第0、2、4、6、8周检测猪瘟抗体阴性、弱阳性、阳性血清,考察检测卡的稳定性。
1.2.9 样本检测 随机选取71份猪血清样本,分别用ELISA试剂盒和本检测卡检测猪瘟抗体水平,比较检测结果。
2 结果与分析
2.1 胶体金溶液扫描结果 以双蒸水为对照,用紫外分光光度计在400~700 nm连续扫描,测定吸收曲线和吸收峰,结果为:λmax=527 nm,ODmax=0.109。所制备的胶体金溶液颗粒大小在40 nm左右,颜色为透明的酒红色,液面无油质类漂浮物,可用于试纸条制备。
2.2 抗原最佳标记pH值 胶体金中加入5 μL 0.2 mol/L K2CO3溶液调节pH值时,标记抗原没有死金现象,且显色最强,调节后的胶体金溶液的pH值在8.0左右。
2.3 抗原最佳标记浓度与最佳包被浓度 通过正交实验,确定猪瘟重组E2蛋白和小鼠IgG分别按0.01 mg/mL标记、T线猪瘟重组E2蛋白按照0.8 mg/mL包被、C线羊抗鼠IgG按照1.0 mg/mL包被为最佳条件组合。
2.4 样品检测方法的确定 取血清样本80 μL加到加样孔中,室温反应10 min,为样本的检测条件。
2.5 标准曲线的建立 通过检测梯度稀释的阳性血清,确定线性范围及对应的T/C值。以T/C值平均值为横坐标、阳性样本阻断率为纵坐标,建立标准曲线如图1。
2.6 结果判定方法的建立 检测卡检测20份猪瘟抗体阴性血清,用定量读数仪读取T/C值,计算cutoff值为0.035。确定检测临床样本的T/C值小于0.035判定为阴性,大于0.035同时小于0.331判定为灰区,大于0.331的则以定量读数仪结果为最终结果。
2.7 检测卡的特异性 本检测卡检测猪圆环病毒病阳性血清、猪伪狂犬病阳性血清、猪繁殖与呼吸综合征阳性血清、猪乙型脑炎阳性血清,结果均为阴性(图2),说明检测卡与以上疫病抗体无交叉反应。
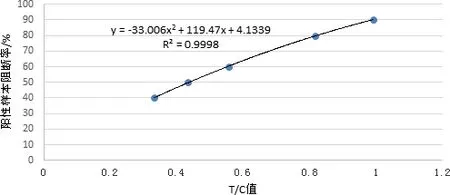
图1 猪瘟抗体快速定量检测卡标准曲线Fig 1 Standard curve of CSF rapid and quantitative test card

a.猪瘟阳性对照,CSF;b.猪圆环病毒病,PC;c.猪伪狂犬病,PR;d.猪繁殖与呼吸综合征,PRRS;e.猪乙型脑炎,JE
2.8 检测卡重复性结果 用同批次检测卡分别检测猪瘟抗体阴性、弱阳性、阳性血清,每个浓度重复检测5次,批内重复性结果见表1。结果表明,猪瘟抗体检测卡的批内重复性好,无明显差异。

表1 检测卡批内重复性Tab 1 Intra repeatability of CSF rapid and quantitative test card
2.9 检测卡加速稳定性结果 将检测卡放置于45 ℃温箱中,于第0、2、4、6、8周检测猪瘟抗体阴性、弱阳性、阳性血清,其稳定性结果见表2。可以看出,检测卡在45 ℃下保存8周其检测结果无明显差异,可依此确定检测卡室温保质期最少为6个月。
2.10 样品检测结果 检测卡和ELISA试剂盒检测71份样本中猪瘟抗体结果见表3。部分样本具体对比结果见表4。

表2 检测卡稳定性Tab 2 Stability of CSF rapid and quantitative test card

表3 检测卡与ELISA检测猪瘟抗体结果符合情况Tab 3 The detected results of the test card and ELISA
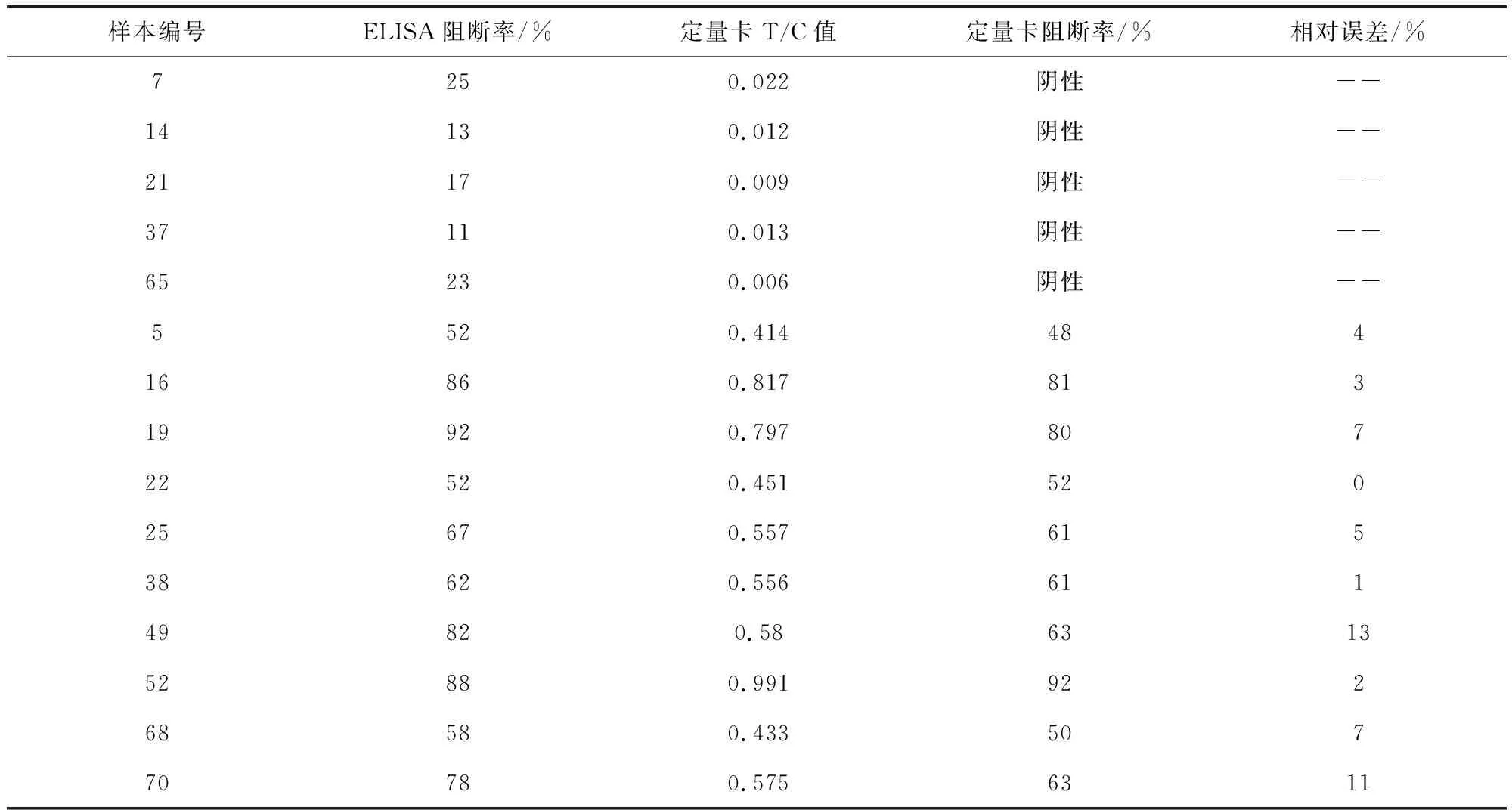
表4 猪瘟抗体定量检测卡检测样本结果Tab 4 Detection results of CSF rapid and quantitative test card
由表3可见,相对ELISA检测法,定量检测卡检测阳性为40份,阴性为31份,假阳性为2份,假阴性为5份。定量检测卡的灵敏度为88.4%,特异性为92.9%,总符合率为90.1%。
由表4可见,定量检测卡检测猪瘟抗体阳性样本的阻断率与ELISA结果有较好的符合度,相对误差在15%以内。
3 讨 论
猪瘟是妨碍养猪业发展的主要疫病之一,在猪瘟的防疫中,猪瘟抗体水平的检测是十分必要的,其高低反应了猪对猪瘟病毒的抵抗能力及疫苗免疫效果。目前主要用ELISA试剂盒检测猪瘟抗体水平,但其检测时间通常需要1.5~3 h[12-13]。实验研制的胶体金定量检测卡结合手持式定量读数仪,其操作简便、步骤单一,加样80 μL后反应只需10 min,即可读取T/C值及对应的阻断率,避免了人为主观判断造成的差异,适用于单个及多个样本的检测。与ELISA结果相比,检测卡灵敏度为88.4%,特异性为92.9%,总符合率为90.1%。检测阳性样本的阻断率与ELISA结果的相对误差在15%以内,符合度较好。同时检测卡只需常温储存,加速稳定性实验结果表明45 ℃条件下8周其结果差异仍小于15%,相当于常温放置6个月。实验研制的猪瘟抗体快速定量检测卡使用方便、快速,成本低,可用于猪瘟抗体的快速检测,适合基层兽医站和养殖企业使用。
