一株牛病毒性腹泻/黏膜病毒株的分离与鉴定
2018-08-13吴华伟郎洪武郝雪斌陈晓春刘国英高金源赵丽霞范秀丽
范 娟,吴华伟,郎洪武,郝雪斌, 陈晓春,刘国英,高金源,赵丽霞,邓 永,范秀丽
(1.扬州优邦生物药品有限公司,扬州,225008 ;2.中国兽医药品监察所,北京,100081;金宇保灵生物药品有限公司,呼和浩特,010030)
牛病毒性腹泻/黏膜病(Bovine viral diarrhea/Mucosal Disease,BVD/MD)是黄病毒科瘟病毒属牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)引起的以发热、粘膜糜烂溃疡、白细胞减少、腹泻、咳嗽及怀孕母牛流产或产出畸形胎儿为主要特征的一种传染病[1-2]。目前,该病在世界范围内广泛流行。我国于1983年首次分离到了BVDV[3]。近年来,流行病学调查表明我国牛、羚羊、鹿、猪等均不同程度的感染BVDV[1,4,5],该病已严重影响着我国畜牧业的健康发展。本研究从云南某牛场疑似感染BVDV病例的牛肿大出血的肠系膜淋巴结和脾脏样品中成功分离一株BVDV毒株,并对该病毒进行了病原学和分子生物学研究。
1 材料与方法
1.1 材料
1.1.1 病料和细胞 从云南省某牛场采集的疑似BVDV感染发病牛肿大出血的肠系膜淋巴结和脾脏,于灭菌MEM营养液中冻存,低温运至实验室;MDBK细胞和Vero细胞由中国微生物菌种保藏管理委员会兽医微生物中心提供;绵羊睾丸细胞由中国兽医药品监察所提供。
1.1.2 毒种与血清 牛病毒性腹泻病毒(BVDV)标准毒株Oregon C24V株、BVD标准阳性血清和标准阴性血清,由中国微生物菌种保藏管理委员会兽医微生物中心提供。
1.1.3 主要试剂 DMEM营养液为Gibco公司产品;胎牛血清为Hyclone公司产品;Ex-Taq酶为宝生物工程(大连)有限公司产品;Trizol为Invitrogen公司产品;IPTG、X-gal为北京索莱宝科技有限公司;低熔点琼脂糖、中性红溶液为Sigma公司;BVDV抗原检测ELISA试剂盒为IDEXX公司产品;DNA凝胶回收试剂盒为天根生化科技(北京)有限公司;T载体和感受态细胞为Tansgen公司;BVDV 间接免疫荧光试剂盒为中国微生物菌种保藏管理委员会兽医微生物中心产品;抗蓝舌病病毒(BTV)FITC结合荧光抗体为美国VMRD公司。
1.1.4 主要仪器 PCR仪(Biometra)、1500型酶标仪(Thermo)、电泳仪、紫外成像仪、倒置荧光显微镜(莱卡)等。
1.2 方法
1.2.1 病料的处理 将肿大出血的肠系膜淋巴结和脾脏混合样品反复冻融3次,经组织研磨匀浆后,10000 r/min离心15 min,取上清,用孔径为0.22 μm滤膜过滤除菌,将滤过液-70 ℃冻存备用。
1.2.2 病料的初步检测 取1.2.1处理好的病料,按IDEXX BVDV抗原检测ELISA试剂盒进行检测和判定,检测结果为BVDV阳性的病料用以病毒分离。
1.2.3 病毒的分离 将经1.2.2检测结果为BVDV阳性的上清液3.0 mL,接种已长成单层的MDBK细胞培养瓶(75 cm2),37 ℃吸附1 h,补加含2%胎牛血清的DMEM维持液(庆大霉素200 μg/mL、两性霉素10 μg/mL)至30.0 mL,置37 ℃、5%二氧化碳的培养箱培养5日,每天观察细胞病变。如此盲传15代,如未出现细胞病变效应(Cytopathic Effect, CPE),且经IDEXX牛病毒性腹泻/黏膜病病毒抗原检测试剂盒和RT-PCR检测结果均为阳性,则视为非致细胞病变型BVDV;如有CPE,则视为致细胞病变型BVDV。
1.2.4 病毒分离株的病毒含量测定 将1.2.3病毒株细胞F15代培养液,用不含血清的DMEM营养液进行10倍系列稀释,取10-1~10-9九个稀释度,每个稀释度接种4孔已长成单层的96孔细胞板,每孔0.1 mL,37 ℃吸附1 h,补加2%胎牛血清的DMEM营养液培养5日,同时设正常细胞对照,采用间接荧光方法判定是否感染,按Reed-Muench法[6]计算TCID50。
1.2.5 纯净性检测 按照《中国兽药典》2015年版三部附录方法分别进行无菌检验、支原体检验和外源病毒检验。
1.2.6 特异性检测
1.2.6.1 鉴别试验 将毒种用DMEM营养液稀释为100 TCID50/0.1 mL,与等量BVDV特异性阳性血清混合,在37 ℃下中和作用1 h后,接种96孔板单层MDBK细胞各8孔,每孔100 μL,同时设立正常细胞对照和病毒对照各8孔。接种后在37 ℃下吸附1 h,再补加含2%新生牛血清的DMEM维持液100 μL,置37 ℃二氧化碳培养箱培养96 h,采用间接荧光抗体法判定结果。
1.2.6.2 间接荧光抗体检测 按1.2.4方法培养72 h,弃去培养液,用80%冷丙酮乙醇溶液固定30 min,然后按照BVDV间接荧光试剂盒说明书进行荧光抗体检测,倒置荧光显微镜下观察。
1.2.6.3 RT-PCR检测 根据BVDV国际标准毒株基因序列,在其最保守的5'端非编码区序列设计合成一对引物,引物序列如下:
上游引物:5'-CATGCCCATAGT AGGAC-3';
下游引物:5'-CCATGTGCCATGTACAG-3'。
引物由北京六合华大基因科技股份有限公司合成,预期片段为288 bp。
按病毒基因组RNA提取试剂盒说明,从分离毒株的细胞培养液和BVDV标准毒株Oregon C24V株细胞培养物中提取RNA。反转录合成cDNA反应体系为:AMV RT 5×Buffer 4 μL、dNTP(各2.5 mmol/L)2.5 μL、RNasin(40 U/μL)1 μL,反转录酶(5 U/μL)1 μL、下游引物(25 μmol/L)各1 μL、模板RNA 5 μL,补充DEPC水至20 μL,混匀后瞬离,42 ℃反转录60 min。PCR扩增反应体系为:模板cDNA 1 μL,Taq酶(5 U/μL)1 μl,dNTP(各2.5 mmol/L)1 μL,上游引物和下游引物(25 μmol/L)各1 μL,10×Buffer(含Mg2+)2.5 μL,补充DEPC水至25 μL,混匀后瞬离。PCR循环条件为:94 ℃ 5 min,94 ℃ 30 s, 50 ℃ 40 s,72 ℃ 1 min,35个循环;72 ℃ 5 min;最后4 ℃保温。用1.5%琼脂糖平板(溴化乙铵终浓度0.5 μg/mL)凝胶电泳检测PCR扩增结果。
1.2.7 基因型序列测定 将1.2.6.3的 PCR产物目的片段的凝胶块切下后,按商品化DNA凝胶回收试剂盒说明书进行DNA回收,克隆到pMD18-T载体上,送北京六合华大基因科技股份有限公司进行序列测定,然后与Genbank中已发表的30株BVDV毒株的5'端非编码区序列使用MEGA软件进行遗传进化分析。采用的BVDV参考毒株信息见表1。
1.2.8 电镜形态观察 取F15代病毒培养物200 mL,反复冻融三次后10000 r/min离心30 min,取上清液50000 r/min离心5 h,弃上清液,沉淀物用0.5 mL去离子水溶解,用2%磷钨酸钠负染30 min,室温下自然干燥后,在透射电镜下观察。
1.2.9 动物回归试验 选取BVDV抗原、BVDV 抗体均为阴性(血清中和抗体效价不高于1:4)的牛7头,分为2组,1组2头,1组5头。将分离到的牛病毒性腹泻/黏膜病病毒细胞毒(病毒含量为103.0TCID50/mL)接种牛(5头),每头牛接种10.0 mL(滴鼻腔左右各2.0 mL,滴口腔2.0 mL,颈部肌肉左右各注射2.0 mL)。同时设定2头牛作为健康对照。两组牛隔离饲养,攻毒后观察14日,每日饲养、观察,测定体温(从攻毒前2日开始测定体温)并采集深层鼻腔拭子接种MDBK细胞进行病毒分离,攻毒后14日剖杀作病理解剖学观察。
表1 序列分析用BVDV参考毒株Tab 1 BVDV reference strains for sequence analysis
2 结果与分析
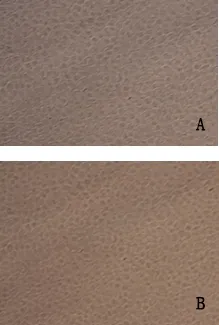
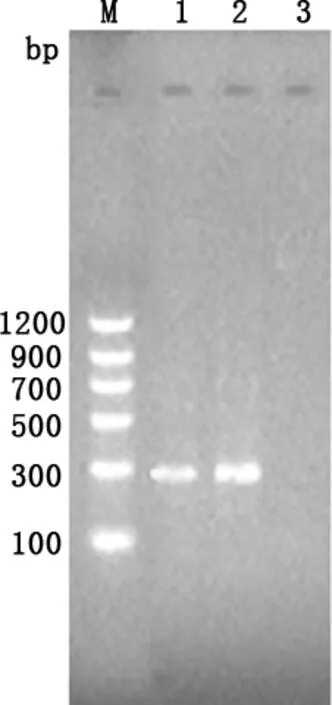
2.1 BVDV的分离 将IDEXX BVDV抗原检测ELISA试剂盒检测结果为阳性的肠道样品接种MDBK细胞连传15代,均未出现CPE(图1)。将F1~F15代病毒培养物用IDEXX牛病毒性腹泻/黏膜病病毒抗原检测试剂盒检测均为阳性。将F15代细胞培养物进行PCR,结果为阳性(见图2)。
A:BVDV F15代在MDBK上未产生CPE B:MDBK细胞对照A: None CPE appeared on MDBK cell infected with the 15th generation BVDV; B: Normal MDBK control
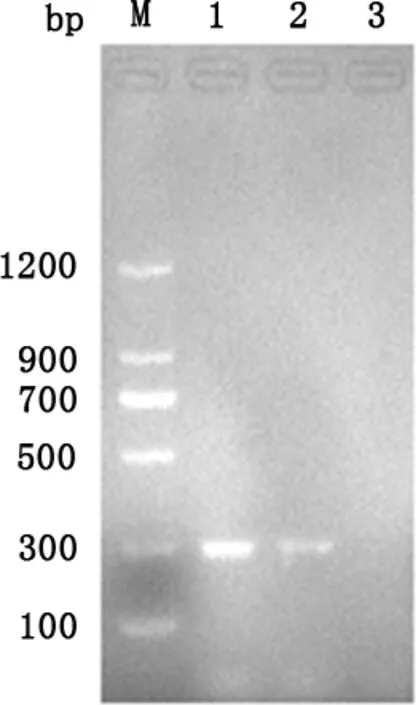
M:蛋白分子量标准;1: BVDV Oregon C24V株的PCR产物;2: BVDV F15代培养物的PCR产物; 3: MDBK细胞的PCR产物M:Protein Marker;1: PCR result of BVDV strain Oregon C24V;2: PCR result of the 15th generation BVDV;3: PCR result of MDVK cells
2.2 BVDV病毒含量测定 BVDV病毒分离物连传15代,仍未出现CPE。将第5代病毒培养物收获、冻融并分装,经IFA病毒含量测定结果为104.5TCID50/ml。
2.3 纯净性检测 按照2015年版《中国兽药典》三部附录方法进行无菌检验、支原体检验和外源病毒检验,结果为无菌生长、无支原体生长和无外源病毒污染,说明该分离毒株纯净性良好。
2.4 特异性检验
2.4.1 鉴别检验 将BVDV毒种稀释为100 TCID50/0.1 mL后与等量BVDV标准阳性血清中和后接种MDBK细胞,经IFA染色未出现特异性荧光,BVDV病毒对照出现特异性荧光,正常细胞对照未出现特异性荧光(图3),说明分离的毒株为BVDV。
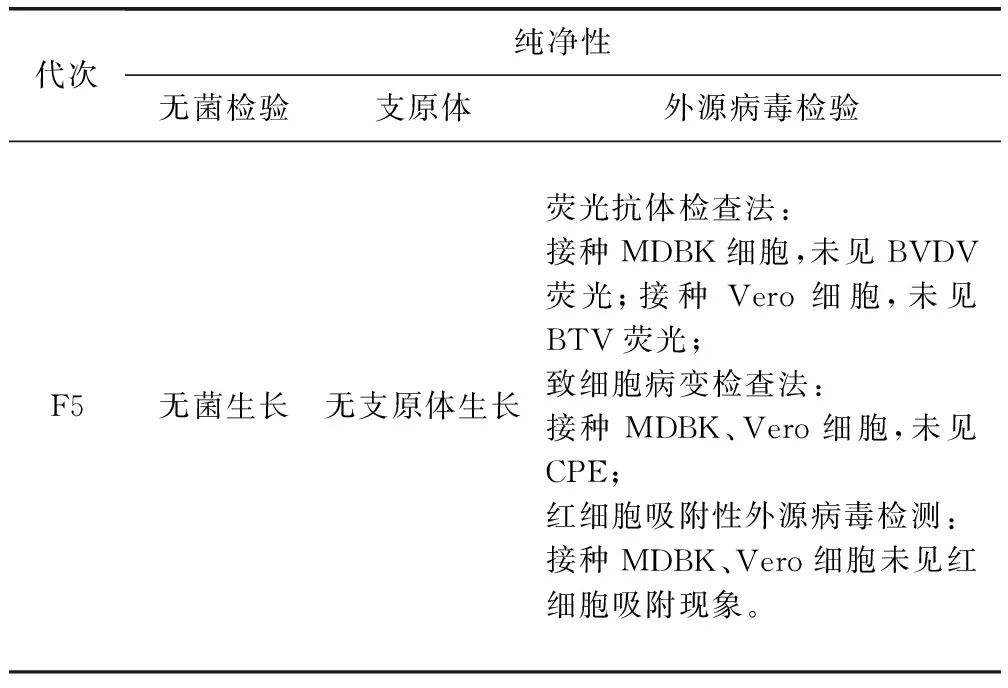
表2 F5代BVDV毒种外源病毒检测结果Tab 2 Test of exogenous virus on 5th generation BVDV

A:中和样品;B:病毒对照;C:细胞对照A: neutralized sample; B: Virus positive control; C: Normal cell control.
2.4.2 荧光抗体检测 将分离的BVDV培养物在MDBK细胞上培养72小时,然后采用BVDV间接荧光试剂盒进行染色,在感染细胞的胞浆可观察到典型的绿色荧光(图4 A),而细胞对照未出现绿色荧光(图4 B)。
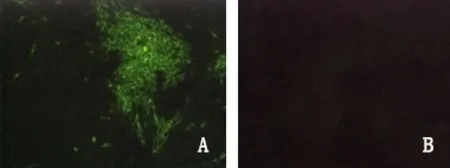
A:BVDV感染MDBK;B:MDBK对照A: Virus-infected MDBK cell;B: MDBKl cell control.
2.4.3 RT-PCR检测 用设计的特异性引物,对分离培养物及BVDV Oregon C24V标准毒株进行RT-PCR扩增,发现分离培养物与BVDV 国际标准毒株Oregon C24V株均能扩增出288 bp的片段(图5),与预期目的片段一致,扩增结果清晰,无杂带,而培养用MDBK细胞无任何条带。
2.5 基因型序列测定 将所测的目的片段与Genbank中已发表的30株BVDV序列的5'端非编码区序列进行同源性比较,同源性为68.7%~89.2%。其中与我国分离的BJ1202株(登陆号:KF925514.1)和Y2株(登陆号:KY964311.1)同源关系最近,均为89.2%。与BVDV I型经典毒株Oregon株、Singer株、NADL株的同源性为83.8%~86.9%(图6),与BVDV 2型经典毒株890株同源性仅为73.4%;与2014年以来我国北京、吉林、四川、山东等地分离的BVDV 毒株亲缘关系在88%左右。基因序列系统进化树分析结果显示同样的结果(图7)。
2.6 电镜形态观察 BVDV分离株细胞培养液经离心浓缩,负染,电镜下观察发现,病毒离子略呈圆形,有囊膜,直径约40~60 nm。
M: 蛋白分子量标准;1: BVDV Oregon C24V株的PCR产物;2: BVDV分离株的PCR产物; 3: MDBK细胞的PCR产物;M: Protein Marker; 1: PCR result of BVDV strain Oregon C24V;2: PCR result of BVDV strain;3: PCR result of MDBK cell.

图6 BVDV/W株与Genbank中BVDV基因序列进行同源性比较Fig 6 Homology analysis between BVDV/W and the sequences from GenBank
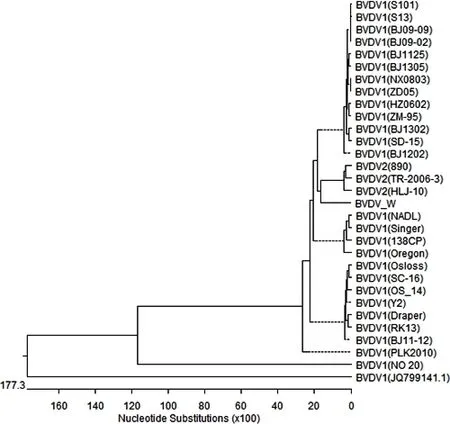
图7 BVDV W株与Genbank中BVDV基因序列系统进化树Fig 7 Phylogenetic analysis of BVDV/W and sequences from GenBank

图8 BVDV/W株电镜照片Fig 8 The electronic microscope photo of strain BVDV/W.
2.7 动物回归试验结果 将BVDV分离毒株接种阴性敏感牛,从临床观察症状看,攻毒后第3日开始有3头牛陆续出现典型的腹泻症状(稀便,严重时甚至呈水样),3头牛的口腔、鼻腔、阴道、肛门或眼结膜等黏膜组织出现充血或溃疡等症状,2头牛的鼻腔或眼睛还伴有黏液性或脓性分泌物,发病牛精神沉郁、食欲减退;出现腹泻的3头牛体温升高到40 ℃以上,最高可达到41.6 ℃,其中2头均持续高温2日以上。另外的2头牛体温未见异常,但伴有浆液性或脓性眼鼻分泌物。1头牛连续腹泻后第10日死亡。对照牛未见任何异常。从攻毒牛鼻拭子病毒分离情况看,攻毒后有3头牛从攻毒后第5~8日开始向外排毒,可持续至第10~14日(1头持续至14日),2头牛仅攻毒后5~6日和5~7日可检测到病毒。
3 讨 论
据可否使培养细胞产生细胞病变,可将BVDV分为两种生物型[1-2]:一种为病毒在细胞中复制不引起细胞病变,称为非致细胞病变型(Noncytopathogenic,NCP),如NY-1株;另一种为引起细胞形成空泡、核固缩、溶解和死亡等病变,称为致细胞病变型(Cytopathogenic,CP),如OregonC24V株、NADL株等。NCP型能引起持续感染,CP型BVDV在体内不能引起持续感染。从国内外已批准的BVDV弱毒疫苗和灭活疫苗(包括含BVDV 成分的二联或多联疫苗)看,仅有4个疫苗为NCP生物型,其余均为CP型[7]。本研究利用MDBK细胞,成功从疑似感染BVDV牛肿大出血的肠系膜淋巴结和脾脏样品中分离出1株BVDV,该毒株在MDBK细胞上连传15代,均不产生CPE,证明该分离毒株为NCP型。从动物回归结果看,该分离毒株接种健康易感牛,可引起体温升高(超过40 ℃)、腹泻、黏膜病、眼鼻黏性或脓性分泌物等典型BVD症状,从而进一步证明分离到的毒株为BVDV。
BVDV 5'-UTR在BVDV基因组中相对保守的,常用作合成引物来检测BVDV或作为BVDV分型鉴定引物[8-9]。根据5'-UTR的序列可将BVDV分为BVDV-1和BVDV-2两种基因型,但这两种基因型均属于同一个血清型,存在一定的交叉保护[10-11]。Fei Xue等[12](2010)研究表明:目前我国流行优势株以BVDV-1型为主。本研究根据国际标准毒株的5'-UTR序列设计出特异性引物,经PCR反应可扩增出288bp特异性条带,并经5'-UTR序列分析,与我国分离的BJ1202株(登陆号:KF925514.1)和Y2株(登陆号:KY964311.1)同源关系最近,均为89.2%,与2014年以来我国北京、吉林、四川、山东等地分离的BVDV毒株亲缘关系在88%左右。系统进化树也显示分离的毒株与国内主要流行分支相同,均属于BVDV-1型。说明该毒株具有一定的代表性。
BVD的根除方法是病畜的检验与捕杀,但成本较高。疫苗接种是目前多数国家控制和预防该病的主要方法,常规灭活疫苗和活疫苗是主要的疫苗类型[13]。弱毒疫苗虽可刺激机体产生较高滴度的抗体,但其存在毒力不稳定,可诱发免疫抑制、持续感染以及可能存在外源病原污染等安全隐患。相比较而言,灭活疫苗安全性方面的优势更为明显,并且其免疫原性相对较差的缺点可通过选用有效的佐剂加以改进。针对目前BVD较为严重的流行形势,采用流行优势毒株制备安全高效的灭活疫苗应为防控这BVD的首选。 因此,本研究所分离到的BVDV/W株具有开发灭活疫苗的潜力。
