新疆葡萄酒中赭曲霉毒素A含 量分析
2018-08-10马文瑞王雪薇王舸楠蒲秋莲
全 莉,马文瑞,王雪薇,王舸楠,蒲秋莲,宋 钰,武 运*,薛 洁
(1.新疆农业大学 食品科学与药学学院,新疆 乌鲁木齐 830052;2.中国食品发酵工业研究院有限公司酒类品质与安全国际联合研究中心,北京 100015;3.吐鲁番市质量与计量检测所,新疆 吐鲁番 838000)
赭曲霉毒素是曲霉属和青霉属的某些菌种产生的有毒代谢产物,包括A、B、C、D(α)四种化学结构非常相似的化合物,其中,赭曲霉毒素A(ochratoxin A,OTA)在自然界中最常见、毒性最强,对人类和动物的健康威胁最大[1]。OTA在许多食品和饮料(如葡萄酒和葡萄汁)中普遍存在[2],OTA对多种动物具有肾脏毒性、肝脏毒性、免疫毒性、致畸毒性和致癌性[3],被国际癌症研究机构(international agency for research on cancer,IARC)定为2B类致癌物[4]。OTA易溶于极性有机溶剂和碳酸氢钠溶液,微溶于水;OTA具有热稳定性,加工过程只能去除一小部分的OTA,甚至在250℃高温条件下都不能完全降解[5]。1995年,ZIMMERLI B等[6]首次在葡萄酒和葡萄汁中发现含有OTA,目前OTA已被认为是葡萄及其深加工产品中主要真菌毒素[7]。
鉴于OTA的潜在危害,2002年欧盟对人们日常饮食中摄取的OTA情况进行了调查,调查结果发现除谷物及谷物产品外,葡萄酒是人们摄取OTA的主要来源[8],因此2005年1月1日欧盟规定了葡萄酒以及用于饮料制作的葡萄汁中OTA的限量标准为2.0 μg/L[9];国际葡萄与葡萄酒组织(international vine and wine organization,OIV)也推荐葡萄酒中OTA的最大限量为2.0 μg/L[10]。我国于2017年3月17日发布的国标GB 2761—2017《食品安全国家标准 食品中真菌毒素限量》中同样对赭曲毒素(OTA)做出规定,该规定限制葡萄酒中OTA含量低于2 μg/L并于2017年9月17日生效,可见葡萄酒质量控制尤其是葡萄酒OTA含量的控制已经成为亟待解决的问题[11]。
研究表明,葡萄酒中的OTA问题主要与葡萄原料是否感染真菌病害有关,OTA含量的高低取决于葡萄酒的类型、原产地以及采收时间[12]。一般来讲。由于酿酒工艺的差异,红葡萄酒中OTA含量显著高于白葡萄酒和桃红葡萄酒[13]。酿酒葡萄产区纬度越低,葡萄酒中的OTA含量也相对比较高,这主要由于气候、葡萄栽培方式和贮存条件不同所致[14]。目前葡萄酒中OTA检测主要有高效液相法(high performanceliquidchromatography,HPLC)和酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)[15]。HPLC法所用仪器昂贵、对样品的预处理步骤复杂、检测成本高、耗时长。ELISA法因具有特异性强、灵敏度高、操作简便、适于大批量样品检测的特点被采用。新疆是中国酿酒葡萄十大产区之一,具有种植优质酿酒葡萄得天独厚的地理资源优势,自古以来就是中国主要的酿酒葡萄及葡萄酒产地,而作为西部产区,目前有关新疆葡萄酒中OTA含量的研究还比较少,生产过程中又缺乏严格的产品质量保证措施,产品质量安全有待提升,因此跟踪生产中潜在安全影响因素是保证新疆葡萄酒质量安全的控制要素。本研究建立了分析OTA的快速检测方法,并对新疆葡萄酒中的OTA含量现状进行了调查分析,跟踪了生产过程中OTA含量的变化规律,以期为提升新疆葡萄酒质量提供参考。
1 材料与方法
1.1 材料与试剂
葡萄酒样品(32种):来自新疆天山北麓、伊犁河谷、焉耆盆地和吐哈盆地四大产区酒庄的葡萄原酒;甲醇(色谱纯)、OTA液体标准品(纯度99%):上海安普试验科技股份有限公司;2-16N高速微量离心机:湖南恒诺仪器设备有限公司;盐酸、氯化钠(均为分析纯):北京化工厂;AgraQuant赭曲霉毒素A酶联免疫试剂盒:北京集束科技有限公司。
1.2 仪器与设备
AL204电子天平:梅特勒-托利多公司;Multiskan FC酶标仪:上海天能科技有限公司;VORTEX-S涡旋振荡器:海门市其林贝尔仪器制造有限公司;PHS-3C雷磁pH计:上海精密科学仪器有限公司。
1.3 方法
1.3.1 标液的制备
准确移取10 mg/L OTA标准液1 mL至100 mL容量瓶中,用甲醇定容,得到100 μg/L的OTA储备液,置于-20℃避光保存。
1.3.2 AgraQuant赭曲霉毒素A酶联免疫试剂盒检测方法
准确移取3 mL葡萄酒样品至一个检测试管中,加入5.7 mL无水甲醇,涡旋振荡30 s,用1 mol/L NaOH或HCl将pH值调至6.5~7.5。吸取200 μL酶联偶合物至稀释孔,加入100μL标准品或样品提取液至稀释孔,充分混合后移取100μL至有抗体包被的微孔里,室温条件下放置10 min,用去离子水清洗5次,拍干微孔板,吸取100 μL底物至每个微孔中,室温条件下放置5 min,吸取100 μL终止液至每个微孔板,用酶标仪在波长450 nm滤镜及波长630 nm示差滤镜下读取结果。
1.3.3 新疆葡萄酒中OTA的含量分析
(1)新疆葡萄酒中OTA含量的分析
考察了32种新疆葡萄酒样品(白葡萄酒14种,红葡萄酒18种)中OTA含量。
(2)新疆四大产区红葡萄酒和白葡萄酒中OTA含量分析考察了新疆四大产区(焉耆盆地、吐哈盆地、伊犁河谷、天山北麓)葡萄酒中OTA含量。
(3)葡萄酒酿造过程中OTA含量的变化研究
对新疆某葡萄酒企业工业化酿造期间(白葡萄:霞多丽;红葡萄:美乐)葡萄酒中OTA进行全方位的跟踪测定,研究OTA在葡萄酒酿造各个过程中的变化情况。
2 结果与分析
2.1 方法有效性的验证
2.1.1 标准曲线的制作
配制OTA标准液质量浓度分别为0、2 μg/L、5 μg/L、20 μg/L和40 μg/L,按上述试验条件处理,以质量浓度的对数值(lg Conc.)为横坐标,吸光度值差值的对数值(B为吸光度值,Bo为零点吸光度值)为纵坐标绘制OTA标准曲线,结果见图1。
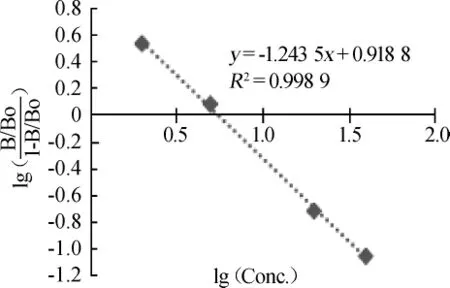
图1 酶联免疫法法检测OTA标准曲线Fig.1 Standard curve of OTA analysis by enzyme-linked immunoassay
由图1可知,OTA在0~40 μg/L范围内线性关系良好,回归方程为y=-1.243 5x+0.918 8,R2=0.998 9。
2.1.2 精密度试验
在5份3 mL空白葡萄酒样品中,分别添加100 μg/L的OTA标品储备液60μL,使葡萄酒样品中OTA含量为2μg/L,重复测定5次,结果见表1。由表1可知,试验结果的相对标准差(relative standard deviation,RSD)为3.54%,表明该方法精密度良好。
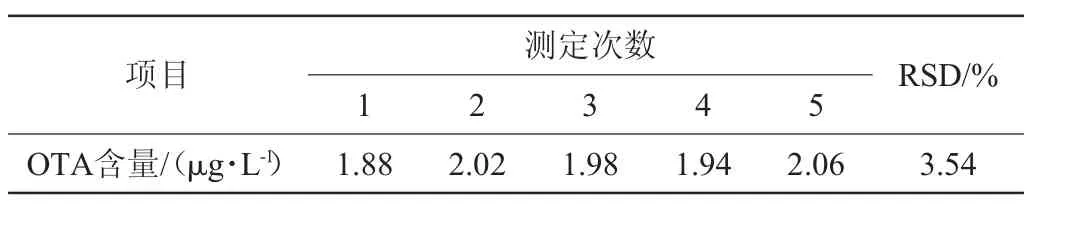
表1 OTA检测精密度试验结果Table 1 Results of precision tests for OTA determination
2.1.3 重复性试验
在2份3mL空白葡萄酒样品中,分别添加30μL、60μL、150 μL 100 μg/L的OTA标品储备液,使葡萄酒样品中OTA含量为1μg/L、2μg/L、5μg/L,在两个不同的日期进行测定,比较差异,以评价方法的稳定性,结果见表2。

表2 OTA检测重现性试验结果Table 2 Results of repeatability tests for OTA determination
由表2可知,重现性试验结果的相对标准偏差为4.34%,表明该方法重现性良好。
2.1.4 加标回收率试验
在5份3mL空白葡萄酒样品中,分别添加30μL、60μL、120μL、180μL、240μL100μg/L的OTA标品储备液,使葡萄酒样品中OTA含量为1 μg/L、2 μg/L、4 μg/L、6 μg/L、8 μg/L,每个水平作5次平行试验,计算平均回收率和相对标准偏差。
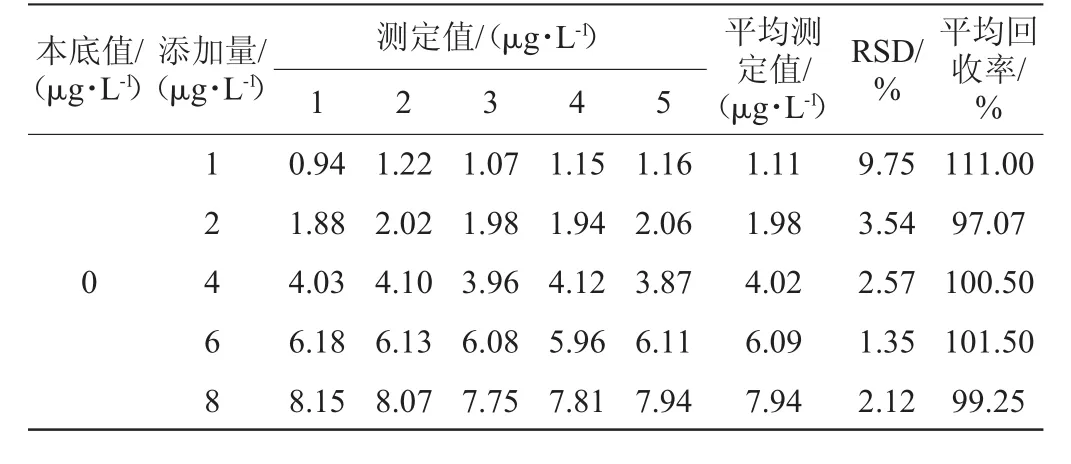
表3 OTA检测加标回收率试验结果Table 3 Results of adding standard recovery rates for OTA determination
由表3可知,添加标品范围为1~8 μg/L时,平均回收率为97.07%~111.00%,RSD均<10%,说明该方法的准确度符合要求。
2.2 新疆葡萄酒中OTA含量的分析
2.2.1 新疆葡萄酒中OTA含量的分析

图2 新疆葡萄酒中OTA检出样品含量分析Fig.2 Analysis of OTA content in Xinjiang wine
32种葡萄酒样品中,18种样品(56.25%)检出OTA,14种样品(43.75%)未检出OTA。检出OTA的样品中OTA含量分析结果如图2所示。
由图2可知,检出OTA的葡萄酒有9种样品的OTA含量在0~0.5 μg/L;6种样品的OTA含量在0.5~1.0 μg/L;3种样品的OTA含量在1.0~1.5μg/L;所有样品的OTA含量均未超过GB2761—2017《食品中真菌毒素限量》规定的2μg/L,说明新疆地区葡萄酒中的OTA是符合国家标准的。
2.2.2 新疆四大产区红葡萄酒和白葡萄酒中OTA含量分析
考察了新疆四大产区白葡萄酒与红葡萄酒中OTA的平均含量,结果如图3所示。
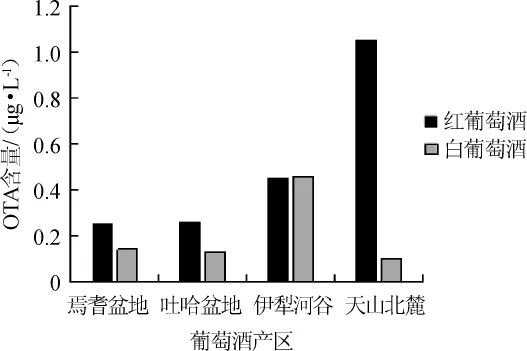
图3 不同产区红葡萄酒和白葡萄酒中OTA含量分析Fig.3 Analysis of OTA content in red and white wines from different producing areas
由图3可知,检测到OTA的样品中,红葡萄酒有12种,白葡萄酒有6种,且红葡萄酒中的OTA含量显著高于白葡萄酒,这主要是由于红葡萄酒是带皮发酵,而白葡萄酒是清汁发酵,葡萄生长期间感染霉菌产生的OTA均在葡萄皮中,因此发酵前的清洗工艺有助于降低葡萄酒中的OTA含量。
其次,产区不同,葡萄酒中的OTA含量也不同,本研究中焉耆盆地和吐哈盆地产区葡萄酒中OTA检出量较低,平均含量分别为0.19μg/L、0.20μg/L,而伊犁河谷和天山北麓产区葡萄酒中OTA检出量较高,平均含量分别为0.46μg/L、0.60μg/L,根据资料报道,焉耆盆地和吐哈盆地的年平均降雨量不足100 mm[16],这也说明了葡萄产区的气候条件与OTA污染密切相关。
2.3 葡萄酒酿造过程中OTA含量的变化研究
对新疆某葡萄酒企业工业化酿造期间葡萄酒中OTA进行全方位的跟踪测定,研究OTA在葡萄酒酿造各个过程中的变化情况,测定结果如图4所示。
由图4A可知,白葡萄酒酿造过程中,OTA含量呈显著的下降趋势,从初始的0.047 6 μg/L下降至发酵结束前的0.001 4 μg/L,下降了97.06%,其中下降幅度最大的是发酵前葡萄汁的澄清过程,下降了51.68%,而发酵前葡萄汁整个处理过程OTA含量的下降了89.08%,因此说明了澄清剂对控制葡萄酒中的OTA含量至关重要。

图4 白(A)、红(B)葡萄酒生产过程中OTA含量的变化情况Fig.4 Variation of OTA content in red(A)and white(B)wines during production process
由图4B可知,红葡萄酒酿造过程中OTA含量的变化规律不同于白葡萄酒,呈先升高后降低的趋势,在葡萄酒满罐循环后至加酵母前,由于葡萄皮渣与葡萄汁充分接触,为了浸提单宁、色素和其他风味物质,OTA也随之浸提到发酵葡萄汁中,从而导致发酵醪液中较高的OTA含量[17]。红葡萄酒酿造过程中OTA含量从初始的0.022 μg/L增加至加酵母前的0.097 μg/L,增加了104.5%。而添加酵母后,葡萄酒中OTA含量呈现下降趋势,主要原因有两点:一是酵母的降解作用[18];其次是由于酵母细胞壁的负电荷的吸附机制,以及OTA的酸性特点[19],随后在澄清过程被去掉。
3 讨论
近年来,国内外对OTA的研究越来越多,酶联免疫法(ELISA)已成为小麦、玉米等谷物OTA含量检测的常用方法,时瑾等[20]采用ELISA方法检测小麦样品中的OTA,方法回收率为95%~110%,方法重现性良好,变异系数小于10%。本试验回收率为97.07%~111.00%,RSD<10%,说明采用ELISA方法检测OTA对葡萄酒进行测定,该方法能够达到GB 2761—2017《食品中真菌毒素限量》中方法的检测限,并且该方法有准确、简便、无复杂的前处理的优点。试验发现红葡萄酒中OTA含量高于白葡萄酒,与康健对葡萄酒中赭曲霉毒素的研究一致[21],这可能和葡萄酒的酿造工艺有关。GAMBUTI A等[22]研究了葡萄酒酿造工艺对葡萄酒中OTA含量的影响,研究认为澄清和过滤可以降低其含量;FERNANDES A等[23]的研究显示,在浸渍过程中OTA的含量开始升高,在液固分离时,OTA大部分随皮渣流失。本试验结果与GAMBUTI A等[22]的研究结果一致,葡萄酒酿造浸渍过程中OTA含量会有所升高,但大部分OTA会随着皮渣被除去,最终葡萄酒中OTA含量很低。原因可能是在发酵过程中,OTA结合在葡萄蛋白质和酵母细胞壁上,因此去除皮渣时,绝大多数OTA可以随着皮渣被除去。
4 结论
建立了试验室酶联免疫快速检测饮料酒中OTA含量的方法,该方法的精密度试验结果RSD为3.54%,回收率为97.07%~111.00%,精密度及准确度符合要求。该方法可以满足OTA的定量分析。
本试验所检测的32种葡萄酒样品中,18种样品(56.25%)检出OTA,14种样品(43.75%)未检出OTA,所有样品的OTA含量均未超过国标2 μg/L,说明新疆地区葡萄酒中OTA含量是符合国家标准的。
天山北麓、伊犁河谷、焉耆盆地和吐哈盆地四个产区的葡萄酒中OTA含量存在差异性,大多数红葡萄酒中OTA含量高于白葡萄酒,焉耆盆地和吐哈盆地葡萄酒OTA含量(平均含量为0.19 μg/L、0.20 μg/L)低于天山北麓和伊犁河谷(平均含量为0.46 μg/L、0.60 μg/L),而焉耆盆地和吐哈盆地又是温度较高降雨量较少的产区,这也说明了葡萄产区和葡萄产区的气候条件与OTA污染密切相关。
白葡萄酒酿造过程中,OTA含量呈显著的下降趋势,下降幅度最大的是发酵前葡萄汁的澄清过程。然而红葡萄酒酿造过程中OTA含量的变化规律不同于白葡萄酒,呈先升高后降低的趋势,在葡萄酒满罐循环后至加酵母前这个期间,为了浸提单宁、色素和其他风味物质,葡萄皮渣中的OTA也随之浸提到发酵葡萄汁中,而添加酵母后,OTA又呈下降趋势。
