鹰嘴豆纳豆优良发酵菌株的筛选与初步鉴定
2018-08-10张俊杰尚益民刘毅飞
张俊杰,郭 晨,尚益民,刘毅飞,方 彩
(郑州轻工业学院 食品与生物工程学院,河南 郑州 450000)
纳豆是盛行于日本的传统发酵大豆食品,至今已有近2 000年的历史[1]。其特点为表面覆有一层粘性物质,挑起时有拉丝现象[2]。日本民间自制纳豆的现象产生于江户时代,如今纳豆已经成为大多数日本人生活中必不可少的食物之一[3],也涌现出了一大批纳豆品牌,如北海道产圆粒大豆纳豆、本场水户极小粒纳豆、御城纳豆等。
传统纳豆是大豆通过接种枯草芽孢杆菌(Bacillus subtilis)发酵而成。纳豆芽孢杆菌(Bacillus subtilisnatto)最早由日本学者SAWAMURA从发酵食品纳豆中发现并筛选出来[4]。纳豆芽孢杆菌属细菌科芽孢杆菌属,属于枯草芽孢杆菌的一个亚种[5]。除了大豆可用于纳豆的制作外,其他豆类同样可以用于发酵制作纳豆。鹰嘴豆是世界第二大种植豆类,仅次于大豆[6],也是世界第三大作为膳食蛋白质来源的豆类作物[7]。鹰嘴豆含有18种氨基酸,其中人体必需的8种氨基酸全部具备[8]。因此,以鹰嘴豆为原料制作纳豆同样具有很高的营养价值。
纳豆激酶(natto kinase,NK)是枯草芽孢杆菌代谢时产生的一种碱性丝氨酸蛋白酶[9],最早于1987年由日本科学家须见洋行博士发现并命名[10]。它是一种可以分泌到细胞外的、具有高效溶栓能力的蛋白酶,其高纤溶活性可用于预防和治疗各种血栓类疾病。因此,对纳豆激酶活性的测定有着重要意义。纳豆激酶活性常见的测定方法有纤维蛋白平板法、纤维蛋白块溶解时间法、四肽底物法、酶联免疫吸附法、血清板法及Folin-酚法等[11]。纤维蛋白平板法以其特异性高、操作简单易行等突出优点,成为国内外研究者最普遍使用的方法,但易受孵育时间影响,另外在测量的过程中也有一定的误差,且平板制作和点样的技术十分关键;纤维蛋白块溶解时间法迅速、快捷,分辨率较高,但时间的判定存在主观误差,难于同时测定多个样品;四肽底物法所得到的蛋白酶活性并不能完全表示其溶纤维活性[12];酶联免疫吸附法和血清板法应用较少。Folin-酚法是测定枯草芽孢杆菌的蛋白酶活力经典的方法,该法简单易行,可以同时测多个样品,成本低,经实验证明此法测得的蛋白酶活力与纤溶活力之间存在一定的相关性[13]。本研究在筛选菌株的基础上进一步发酵制作了鹰嘴豆纳豆,并采用Folin-酚法测定了纳豆激酶活性,旨在挑选出纳豆激酶活力高且在鹰嘴豆纳豆制作中有优秀表现的菌株,为生产高纳豆激酶活性的鹰嘴豆纳豆提供菌种基础。
1 材料与方法
1.1 材料与试剂
1.1.1 试验样品
土壤样品:采集于学校周边树林里地表5 cm以下的土样,用无菌袋装好后带回备用。
纳豆样品:市购北海道产圆粒大豆纳豆、本场水户极小粒纳豆、北海道大粒纳豆、燕京纳豆和御城纳豆共5种。置于4℃冰箱备用。
1.1.2 试验试剂
胰蛋白胨、酪蛋白(均为生化试剂):北京奥博星生物技术有限责任公司;琼脂粉(生化试剂)、Folin-酚试剂(分析纯):北京索莱宝科技有限公司;酵母浸粉(生化试剂):北京双旋微生物培养基制造厂;HCl、NaCl、Na2HPO4、CuSO4·5H2O、KH2PO4、Na2CO3、MgSO4(均为分析纯):天津市永大化学试剂有限公司;L-酪氨酸(分析纯):合肥博美生物科技责任有限公司。
1.1.3 培养基
LB固体培养基:胰蛋白胨10 g/L,酵母浸粉5 g/L,NaCl 5g/L,琼脂20 g/L,pH 7.0,121 ℃灭菌20 min。
LB液体培养基:胰蛋白胨10 g/L,酵母粉5 g/L,NaCl 5 g/L,pH 7.0,121℃灭菌20 min。
酪蛋白平板培养基[14]:葡萄糖1 g,酵母粉1 g,磷酸二氢钠1 g,磷酸氢二钠2 g,硫酸镁 0.1 g,干酪素5 g,琼脂粉20 g,去离子水1 000 mL,pH 7.2,121℃灭菌20 min。
1.2 仪器与设备
DH-600A电热恒温培养箱:北京中兴伟业仪器有限公司;SW-CJ-2D超净工作台:苏州净化设备有限公司;DMEX30生物显微镜:宁波舜宇仪器有限公司;FORMA-86C超低温冰箱:郑州金友宁仪器有限公司;ZWY-100H摇床:上海智城分析仪器制造有限公司;AE224分析天平:北京赛多利斯天平有限公司;TGL-16G离心机:上海安亭科学仪器厂;SC-15恒温水浴锅,SCIENTZ-10N真空冷冻干燥机:宁波新芝生物科技有限公司;101型电热鼓风干燥箱:北京中兴伟业仪器有限公司;T6紫外可见光分光光度计:北京普析通用仪器有限责任公司。
1.3 方法
1.3.1 芽孢杆菌的分离纯化
(1)土壤中芽孢杆菌的分离纯化
将5.0 g土壤样品加入到45 mL无菌生理盐水中,煮沸10 min杀死土壤中的营养体细胞[15],取上清液梯度稀释到10-6,用涂布平板法每个梯度(10-1~10-6)涂两块LB平板,每块平板涂布0.15 mL,然后37℃倒置培养至长出菌落。然后在菌落密度合适的平板上挑取菌落形态与枯草芽孢杆菌相似的单菌落,划线接种到LB平板上,37℃倒置培养,至再次长出单菌落后,进行革兰氏染色和显微细胞形态观察,然后保存于LB斜面备用。
(2)纳豆中芽孢杆菌的分离纯化
取大约5.0 g纳豆样品加到45 mL无菌生理盐水中,置于摇床上充分振荡至生理盐水变浑浊,让纳豆成分充分分散在生理盐水中,然后静置10 min,取上清液,用梯度稀释法稀释到10-7,用涂布平板法每个梯度涂两块酪蛋白平板,每块平板涂布0.15 mL液体,37℃倒置培养。
培养到平板上长出明显菌落时,在菌落密度合适的平板上挑取产透明圈较大的单菌落,用平板划线法接种到LB平板上,37℃倒置培养。用相同方法可多次纯化培养,直到显微观察没有杂菌,并挑取单菌落接种到LB斜面上,将革兰氏染色结果为阳性的菌接种于LB斜面备用。
(3)菌种的保藏
将得到的纳豆芽孢杆菌接种到5 mL LB液体培养基中,于37℃、转速180 r/min的条件下培养24 h,在无菌甘油管中将培养好的菌液与50%的无菌甘油以体积比1∶1充分混合后,于-80℃超低温冰箱中保存。
(4)革兰氏染色
参考国标GB 4789.28—2013《食品微生物学检验培养基和试剂的质量要求》[16]对所分离的菌株进行染色、镜检。
2.教师疏于感情投入和美好的形象塑造,学生对语文教师缺乏好感,把对教师的好恶迁移到学习之中,从而对语文学科缺少兴趣。
1.3.2 酪蛋白平板初筛
将菌体接入LB液体培养基中,37℃条件下以180 r/min的转速摇菌24 h后,在波长600 nm处测菌液的OD600nm值。根据OD600nm值加入无菌LB液体培养基将菌液OD600nm值调节至相同以保证接种的菌液浓度相同。分别吸取5 μL菌液于酪蛋白平板上,37℃培养24h后观察透明圈直径。每株菌做3个平行。对菌液在酪蛋白平板上产生的透明圈直径进行排序,分别从纳豆食品样品中选出了透明圈直径排前3的菌株,以及从土壤样品中选出了透明圈直径排前10的菌株,共计13株菌用于发酵鹰嘴豆纳豆制备。
1.3.3 鹰嘴豆纳豆的加工工艺流程及操作要点

操作要点:
种子液的活化:取筛选保存的纳豆芽孢杆菌甘油管,先在LB平板上划线活化,37℃培养过夜,待长单菌落后,挑取单菌落接种于50 mL液体LB培养基中,37℃条件下以180 r/min的转速培养24 h。
原料预处理:挑选颗粒饱满,大小均匀的鹰嘴豆,清洗干净后室温下清水浸泡24 h。
蒸煮与接种:浸泡后的鹰嘴豆在0.13 MPa的压力下蒸煮20 min。无菌条件下按原料质量的4%的接种量接种纳豆芽孢杆菌。
1.3.4 鹰嘴豆纳豆的感官评价
感官评价小组由10人组成(男女各半),年龄均在20岁至50岁之间。评价小组在专业的感官评价室中进行感官评价。样品由统一容器盛装,编码与取样过程均为随机。要求评价小组成员评价前12 h内不得饮酒,不得食用刺激性食物,评定过程中禁止相互讨论。每次评定之间以10 min为时间间隔,评定完每份样品后以清水漱口。鹰嘴豆纳豆感官评价的特征描述在金爽等[2]的研究上略做改进,具体感官评分标准见表1。鹰嘴豆纳豆各项指标满分为10分,其中,拉丝和口感的权重分别为30%,色泽和气味各的权重分别为20%,最终得到的一个满分为10分的综合评分。

表1 鹰嘴豆纳豆感官评分标准Table 1 Sensory evaluation standards of chickpea natto
1.3.5 纳豆激酶酶活的测定
(1)纳豆激酶粗酶液的获得
发酵后的新鲜纳豆送入预冷室-40℃冷冻,冷冻干燥后用粉碎机粉碎成含纳豆激酶的纳豆样品粉末。在每克纳豆样品粉末中加入质量分数为0.9%生理盐水5 mL,4℃浸提4 h,4℃条件下4 500 r/min离心20 min,所得上清液即为纳豆激酶粗酶液[17]。
(2)酪氨酸标准曲线的绘制
配制质量浓度为50mg/mL的酪氨酸(tyrosine,Tyr)标准溶液,精密吸取标准溶液0、0.025 mL、0.050 mL、0.075 mL、0.100 mL、0.150 mL、0.200 mL,分别加入蒸馏水0.500 mL、0.475 mL、0.425 mL、0.400 mL、0.350 mL、0.300 mL,加入0.4 mol/L的Na2CO3和Folin-酚试剂混匀后,放入40℃水浴保温20 min,进行比色测定(波长680 nm)。然后以Tyr标准溶液的质量浓度(x,μg/mL)为横坐标,吸光度值A680nm(y)为纵坐标,绘制酪氨酸标准曲线。
(3)纳豆激酶酶活测定
参考商业行业标准SB/T 10317—1999《蛋白酶活力测定》[18]中的方法,在1.5 mL的离心管中加入300 μL纳豆激酶粗酶液,再加入300 μL的1%酪蛋白溶液,混匀,40℃水浴加热10 min,再加入300 μL 10%的三氯乙酸溶液终止反应。室温4 500 r/min离心10 min。取上清滤液20 μL,用上述Folin-酚法测定吸光度值A680nm。纳豆激酶酶活计算公式如下:

纳豆激酶酶活定义:在40℃条件下每克样品每分钟水解酪蛋白产生1μg酪氨酸,定义为1个蛋白酶活力单位(U/g)。
1.3.6 数据处理
使用SPSS 24.0对测定结果进行相关性分析。
2 结果与分析
2.1 革兰氏染色结果
按照1.3.1中的方法从土壤中共分离出了23株菌(编号S-1~S-23)。按照1.3.2中的方法分别从北海道产圆粒大豆纳豆样品中分离出7株菌(编号为F-1-1~F-1-7);本场水户极小粒纳豆样品中分离出5株菌(编号为F-2-1~F-2-5);北海道大粒纳豆样品中分离出5株菌((编号为F-3-1~F-3-5);燕京纳豆样品中分离出5株菌(编号为F-4-1~F-4-5;御城纳豆样品中分离出5株菌(F-5-1~F-5-5),共27株菌。经过革兰氏染色镜检结果表明所分离的50株菌均为革兰氏阳性菌。
2.2 酪蛋白平板筛选
分别测量从纳豆样品中得到的27株菌与从土壤中分离出的23株菌在酪蛋白平板上形成透明圈的直径,并对其排序,结果如表2、表3所示。
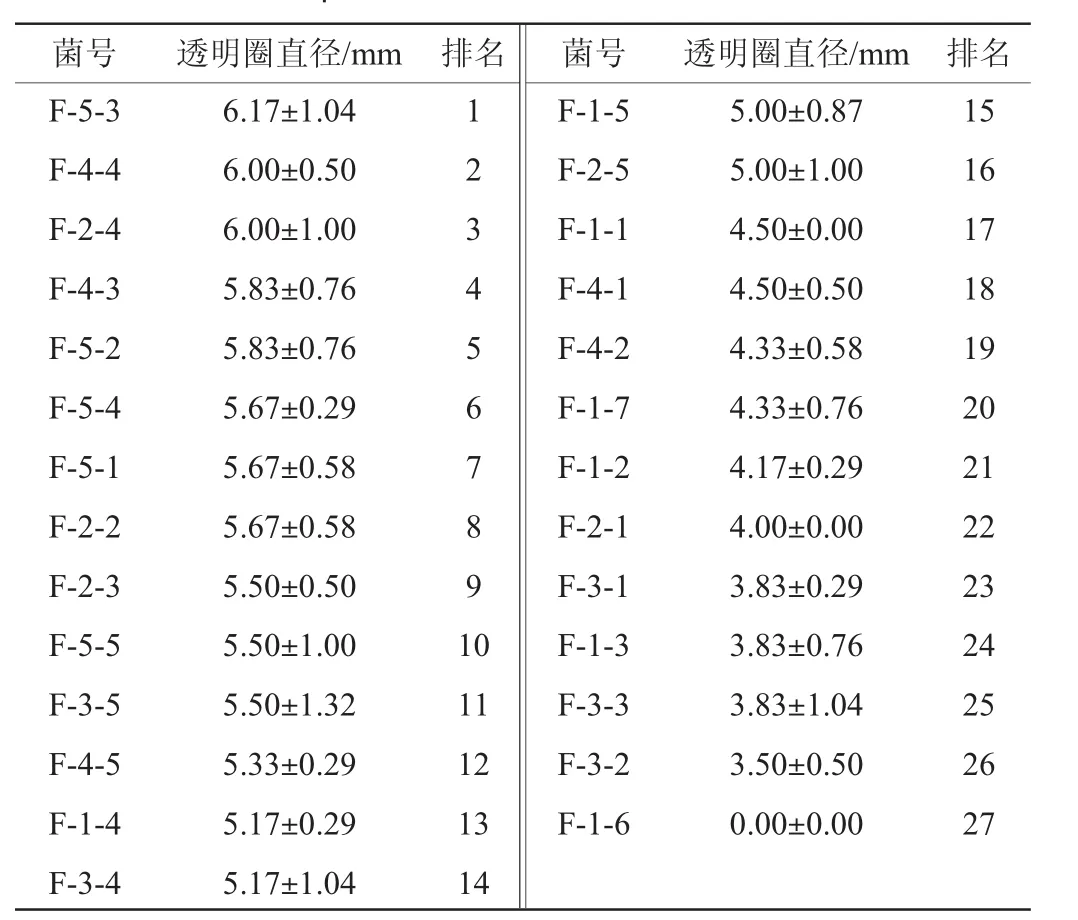
表2 纳豆样品中27株菌酪蛋白平板产透明圈排序Table 2 Ranking of transparent zones produced by 27 strains in natto samples
由表2可知,从纳豆样品中分离出来的菌株在酪蛋白平板上产生的透明圈直径达5 mm以上(含5 mm)的菌株有16株,占纳豆样品中食品中分离菌株总数的59.26%;由表3可知,从土壤中分离出来的菌株分解酪蛋白产透明圈直径达5 mm以上(含5 mm)的菌株有5株,仅占土壤中分离菌株的21.74%。从纳豆样品中分离出的菌株在分解酪蛋白产透明圈能力上极显著高于从土壤中分离出的菌株(P<0.01)。值得注意的是,尽管从土壤中分离出的菌株分解酪蛋白的能力差异较大,仍出现了个别菌株分解酪蛋白的能力强于分离自纳豆样品的菌株(如菌株S-12)。因此,很有可能从土壤中分离出可以用于纳豆制作的高酶活力菌株。

表3 土壤样品中23株菌酪蛋白平板产透明圈排序Table 3 Ranking of transparent zones produced by 23 strains in soil samples
2.3 鹰嘴豆纳豆感官评价
根据2.2中得到的结果,从土壤样品中挑选出了水解酪蛋白能力最强的10株菌(S-12、S-18、S-16、S-19、S-5、S-6、S-11、S-15、S-1及S-8)和纳豆样品中水解酪蛋白能力最强的3株菌(F-5-3、F-4-4及F-2-4),共计13株菌,将其接种到鹰嘴豆上,发酵制备鹰嘴豆纳豆,并对得到的鹰嘴豆纳豆成品打分,结果如图1及表4所示。

图1 鹰嘴豆纳豆成品性状Fig.1 Characters of chickpea natto products
由图1可知,发酵成熟的鹰嘴豆纳豆表面为金黄色,覆有一层白色的分泌物,湿润且有光泽,挑起后有长长的拉丝。由表4可得,在感官评价方面,纳豆样品中分离出的菌株占据了前三名的位置。经方差分析,从纳豆样品中分离出的菌株发酵制作的鹰嘴豆纳豆在感官评分上显著高于从土壤中分离出来的菌株发酵制成的纳豆(P<0.05)。同时,土壤中分离出来的菌株S-15、S-19、S-11在感官评分上也很接近纳豆样品中分离出的菌株F-4-4。

表4 鹰嘴豆纳豆感官评分结果Table 4 Results of sensory evaluation scores of chickpea natto
2.4 纳豆激酶活力的测定
2.4.1 酪氨酸标准曲线的绘制
以Tyr标准溶液的质量浓度(x,μg/mL)为横坐标,吸光度值(y)的平均值为纵坐标,绘制Tyr的标准曲线,结果如图2所示。由图2可知,标准曲线回归方程为y=0.056 6x+0.001 8,相关系数R2=0.999 6,表明Tyr质量浓度与吸光度值线性关系良好。

图2 酪氨酸标准曲线Fig.2 Standard curve of tyrosine
2.4.2 纳豆激酶活力的测定
将测得不同样品的吸光度值带入酪氨酸标准曲线的回归方程,可得到对应的酪氨酸质量浓度,计算出样品纳豆激酶活性的大小,具体结果如表5所示。
由表5可知,从土壤中分离出的菌株S-18平均酶活力最高,达到了(3 269.38±52.59)U/g,从纳豆中分离出的菌株F-2-4次之,酶活力为(2 931.12±172.74)U/g。从不同品牌纳豆样品中分离得到的菌株在制作鹰嘴豆纳豆中获得纳豆激酶活力差别较大,分别位列2、9、12位。经过方差分析,用这13株菌发酵得到鹰嘴豆纳豆的纳豆激酶活力差异性显著(P<0.05)。用土壤中分离出的S-18、S-19和S-5三株菌发酵得到的鹰嘴豆酶活力均>2 500 U/g。
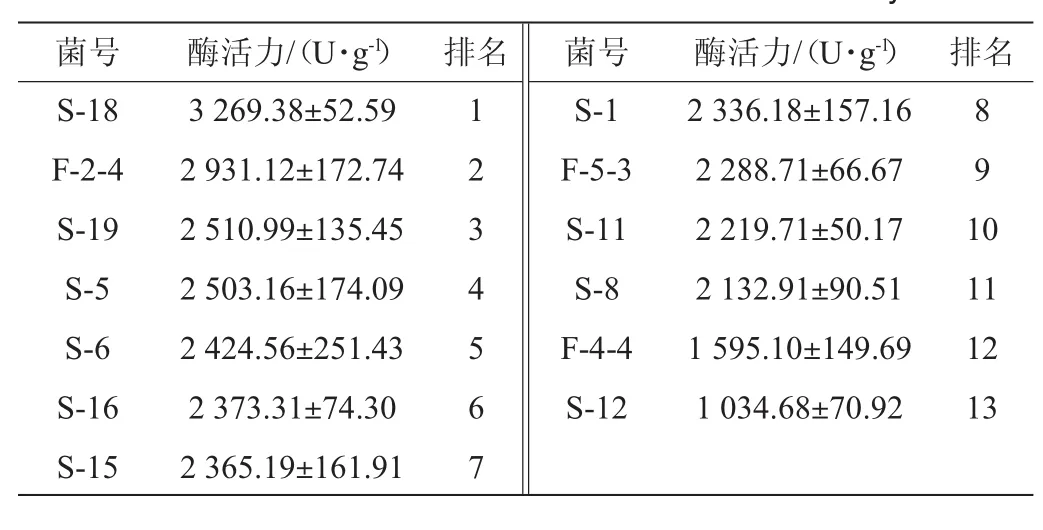
表5 纳豆激酶酶活力测定结果Table 5 Determination results of nattokinase activity
3 结论
本研究对来自5种不同品牌的纳豆样品与土壤中的50株芽孢杆菌进行了分离筛选,从土壤中得到了用于发酵鹰嘴豆纳豆有较高感官评分同时纳豆激酶活性较高的菌株S-18。综合考虑,土壤中分离出的最优三株菌分别为S-19、S-18和S-5。其中,菌株S-18酶活力最高,达到了(3 269.38±52.59)U/g,该菌属于纳豆激酶高产菌株。
综合来看,分离自纳豆样品中的菌株无论是在酪蛋白分解实验还是在鹰嘴豆纳豆发酵的感官评价中都有着明显的优势,而且整体能力十分均衡。但是,从土壤样品中分离出部分菌株在这些方面也有着接近于食品中分离出菌株的优良能力,甚至在发酵鹰嘴豆纳豆产纳豆激酶的活力上还要更胜一筹,对高纳豆激酶活性的鹰嘴豆纳豆的开发具有良好的应用前景。
