温度对有水保活石斑鱼代谢与鱼肉品质的影响
2018-08-10范秀萍秦小明章超桦陈建平朱乾峰陈鹏文
范秀萍,秦小明,章超桦,2,陈建平,朱乾峰,陈鹏文
温度对有水保活石斑鱼代谢与鱼肉品质的影响
范秀萍1,秦小明1※,章超桦1,2,陈建平1,朱乾峰1,陈鹏文1
(1. 广东海洋大学食品科技学院, 广东省水产品加工与安全重点试验室,广东普通高等学校水产品深加工重点试验室,湛江 524088;2.南海生物资源开发与利用协同创新中心,广州 510275)
为探讨温度对有水保活珍珠龙胆石斑鱼代谢与肌肉品质的影响,该文对不同温度有水保活珍珠龙胆石斑鱼的存活率、保活前后的水质变化、血液生化指标与肌肉理化性质等进行了测定。将体质量为(503±31)g的石斑鱼暂养48 h后,以平均1~2℃/h的速度程序降温至13~14℃,分别在15,20,25℃的条件下保活。结果显示:珍珠龙胆石斑鱼在15、20和25℃下保活96 h后的存活率分别为100%,75%和17%。低温保活显著降低水体中代谢产物含量,15 组与25℃组相比,珍珠龙胆石斑鱼在24~96 h内的总氨氮产量降低量在38.12%~57.76%。表明低温通过降低鱼体的呼吸代谢,减少水体中总氨氮与非离子氨氮的浓度而减缓水质恶化。休眠后鱼体受到低温应激作用血清皮质醇与血糖水平均显著上升(<0.05)。保活72 h后,与25 ℃组相比,15 ℃处理组鱼体血清皮质醇含量显著降低,但血糖水平显著增加(<0.05),表明低温能降低鱼体在保活过程中的应激反应,同时出现显著的高血糖症状。与新鲜的珍珠龙胆石斑鱼相比,保活72 h后,15℃处理组血清中谷丙转氨酶、谷草转氨酶和肌酸激酶活性均无显著性变化(>0.05),乳酸脱氢酶活性、尿素氮、尿酸、总蛋白含量均显著上升(<0.05);而甘油三酯含量显著下降(<0.05);且肌肉中糖原与粗脂肪质量分数分别下降32.50%和36.32%,水分、粗蛋白、乳酸含量、以及持水力和pH值均无显著变化(>0.05),总体优于25℃处理组。表明25℃保活条件下珍珠龙胆石斑鱼通过增强机体代谢酶活性,增加能量物质代谢,而导致肌肉品质下降;而在15℃保活鱼体能维持较低的代谢水平,生存能力提高,保活72 h后肌肉品质无显著变化。因此15℃适合珍珠龙胆石斑鱼的长途保活运输。该研究结果为珍珠龙胆石斑鱼的有水保活运输提供参考。
鱼;酶活性;理化性质;珍珠龙胆石斑鱼;低温保活;血清生化
0 引 言
鲜活水产品因其新鲜、美味、营养价值高等特点而受到消费者的青睐。珍珠龙胆石斑鱼(♀×♂),俗称龙虎斑,是棕点石斑鱼()与鞍带石斑鱼()杂交培育的一种海水名贵经济鱼类,是海南、广东、福建等南海地区养殖的主要品种,养殖量大,价格高[1]。
由于海水鱼类的产销地域跨度大、保活技术不成熟以及运输设备配置不完善等原因,导致活鱼运输成本高、远距离运输耗损率大(超过10%)以及目前市场中活鱼运输过程所带来的食用安全等问题。因此,研究石斑鱼的保活技术对解决生产中石斑鱼的运输问题具有重要意义。目前开放式系统保活运输仍然是鱼类运输的主要方式。运输过程中可根据季节、运输距离的长短,采用充氧[2]、适当降低水温[3]和改变盐度[4]等方法达到保活目的并提高运输质量。低温保活运输是利用水产动物的生态冰温,使其处于镇静或休眠状态,从而降低新陈代谢、减少机械损伤,延长存活时间,具有运输量大、成本低、适于长距离运输等特点。低温保活运输方法已在多种水产品中进行了研究与应用,如:鲫鱼[5]、团头鲂[6]、大菱鲆[7]、对虾[8]、龙虾[9]等。
不同种类的鱼类对低温的耐受性不同,珍珠龙胆石斑鱼是一种暖水性鱼类,适宜水温为22~30 ℃,20 ℃以下食欲减退,15 ℃以下停止摄食,11 ℃以下较小的个体会出现死亡[1]。目前对珍珠龙胆石斑鱼的低温保活运输研究还没有相关报道。因此本论文通过对珍珠龙胆石斑鱼低温休眠温度的研究,比较了不同温度条件下保活前后生理生化特性与肌肉理化性质的变化,探讨其合适的保活运输温度,为珍珠龙胆石斑鱼的保活运输提供依据。
1 材料与方法
1.1 试验原料
珍珠龙胆石斑鱼(♀´s×♂),购自湛江市水产品批发市场,养殖地区来自湛江东海岛养殖场,1龄,体长31.3~34.6 cm,体质量450~600 g。
1.2 仪器与设备
HX204卤素水分测定仪瑞士梅特勒-公司,Vap450全自动凯氏定氮仪德国格哈特公司;Cary紫外可见分光光度计美国安捷伦公司。DDSJ-308A型电导率仪上海精密科学仪器有限公司;Varioskan 全自动酶标仪美国ThermoFisher公司。
乳酸脱氢酶(lactate dehydrogenase, LDH)、谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、肌酸激酶(creatine kinase, CK)、总蛋白(total protein, TP)、白蛋白(albumin, ALB)、尿素氮(usea nitrogen, BUN)、肌酐(creatinine, CREA)、尿酸(uric acid, UA)、总胆固醇(cholesterol, CHOL)、甘油三酯(triglyceride, TG)、乳酸、糖原试剂盒:南京建成生物科技有限公司;皮质醇:上海酶联生物科技有限公司。
1.3 试验设计
本试验在2016年7月进行。珍珠龙胆石斑鱼共30条,体质量为(503±31)g,自市场购买回来后,置于暂养池中,采用砂滤循环海水,盐度23‰~25‰,空气泵充氧,保证水体溶解氧为5~8 mg/L,鱼体暂养密度50 g/L,23~25 ℃暂养48 h后,以平均1~2℃/h的降温速度程序降温,降温程序为:当水温>20 ℃时,降温速率为2~3 ℃/h;水温15~20 ℃时,降温速率为1~2 ℃/h;水温<15 ℃时,降温速率为0.5~1 ℃/h。当温度降至鱼体呈半休眠状态(13~14℃,鱼体侧翻,刺激无反应状态)时,转移至不同温度的水体中进行保活试验。记录不同温度保活鱼体的存活率。试验每组共6条鱼,分放在2个50 L的塑料箱中,每箱3条鱼,塑料箱中水体采用过滤棉进行过滤、控温循环海水。以新鲜鱼作为对照,分别取15,20,25℃处理72 h后的鱼体作为样品。
1.4 生态冰温临界温度的测定
珍珠龙胆石斑鱼共6条,经过48 h暂养后,以1~2 ℃/h的速率缓慢降温, 观察并记录每条石斑鱼在不同温度下的呼吸频率与行为特征。以鱼体出现裂鳃、无呼吸时(鱼尚未死亡)的温度作为其临界温度。
1.5 血液生化指标的测定
将鱼体从保活箱中快速捞起,投入到浓度为200 mg/L的MS-222麻醉液中,麻醉后用10 mL的1次性无菌注射器(预先用质量分数1%肝素钠溶液浸润内壁和针头)尾动脉抽血,抽血后注入到肝素钠抗凝的采血管中,缓慢摇晃均匀,4℃下3 000 r/min离心20 min,取其血清,乳酸脱氢酶(LDH)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、磷酸肌酸激酶(CK)、总蛋白(TP)、白蛋白(ALB)、尿素氮(BUN)、肌酐(CREA)、尿酸(UA)、总胆固醇(CHOL)、甘油三酯(TG)均采用试剂盒测定;皮质醇含量用酶联免疫法测定;采用葡萄糖氧化酶–过氧化物酶法检测血清中葡萄糖(glucose,GLU)的含量。
1.6 水体指标的测定
保活过程水体pH值采用pH计监测;电导率仪测定水体电导率;采用纳氏试剂法(GB3097—1997中华人民头和国海水水质标准)测定海水中的总氨氮含量。非离子氨氮采用计算法[10]。
1.7 肌肉理化指标测定
鱼体取自背鳍以下、侧线以上的背肌,用高速组织匀浆机捣碎,用于基本成分分析。
水分含量采用水分测定仪测定,粗蛋白质含量采用全自动凯氏定氮仪测定(GB5009.5-2016),粗脂肪含量采用索氏抽提法(GB/T5009.6-2016),粗灰分含量采用高温灼烧法(GB/T5009.4-2016)。乳酸、糖原含量分别采用试剂盒进行测定;pH值测定方法:称取10 g混匀的样品于烧杯中,加入超纯水至100 mL,均匀搅拌,静置30 min后,测上层清液pH值。
1.8 数据处理
数据运用SPSS19.0进行处理,结果采用平均值±标准差(±SD)表示,组间差异采用单因素方差分析 (One-Way ANOVA),并结合Turkey检验进行多重比较,<0.05表示组间差异显著。
2 结果与分析
2.1 生态冰温临界温度的确定
随着水体温度的降低,珍珠龙胆石斑鱼的呼吸频率显著下降。珍珠龙胆石斑鱼在不同温度下的呼吸频率见图1。

注:图中不同小写字母表示组间差异显著(P < 0.05),下同。
当温度降至18 ℃时,鱼体运动减缓;15 ℃时鱼体开始出现静立水中,对外界刺激反应较弱;当温度降到14 ℃时,鱼体部分失去平衡,身体稍微倾斜,且对外界刺激无反应,呼吸频率达到14~16次/min;继续降到13 ℃时,呼吸频率无显著变化,但鱼体会出现强烈的应激反应,出现撞击、跃出水面、翻倒等应激行为,因此将14 ℃作为鱼体的休眠温度。水温达到12 ℃时,鱼体呼吸不规律,出现裂鳃现象,且平躺水底;如果此时继续降温,会导致鱼体的呼吸中断,出现死亡;如果此时将鱼体转移到常温海水下,鱼体在5 min内可以恢复至正常状态,因此将12 ℃作为珍珠龙胆石斑鱼生态冰温的极限温度。
鱼类的低温耐受性受到多种因素的影响,降温模式、环境温度、鱼体大小等都会影响其临届温度。邵彦翔等[11]通过1 ℃/d的降温模式探讨冬季珍珠龙胆石斑鱼幼鱼的低温耐受性,结果表明其半致死温度为11 ℃。本研究中采用的是1 ℃/h的急性降温,选取的是夏季(平均气温在30 ℃)成鱼对低温的耐受性,且由于鱼类一般不耐受水温的剧烈变化,当温度变化的总温差超过12~15 ℃时,鱼体容易出现呼吸活动长时间中断,从而导致死亡[12],因此测定珍珠龙胆石斑鱼的临界温度稍高于缓慢降温时鱼的临界温度。
2.2 温度对珍珠龙胆石斑鱼保活时间与存活率的影响
珍珠龙胆石斑鱼在不同温度下的保活时间与存活率见表1。在25 ℃时,石斑鱼保活72 h后的存活率为100%,之后开始出现死亡,96 h时的存活率为17%;在20 ℃时,保活96 h时的存活率为75%,保活120 h时存活率为67%;在15 ℃,保活96 h时存活率为100%,保活192 h以后开始出现死亡;在13 ℃,保活24 h以后出现死亡,且存活率仅为17%,温度过低,鱼体僵硬,不利于鱼的存活。因此,15~20 ℃是珍珠龙胆石斑鱼保活运输的适宜温度。过高或过低的水温均不利于鱼体保活贮运,其原因是水温较高时鱼体新陈代谢旺盛且易产生较多有害代谢产物,但水温过低也会导致鱼体的损伤和死亡, 从而导致其存活率下降。Yoshikawa等[13]对温水性鱼类鲤鱼进行低温休眠研究时发现,4 ℃下鱼体完全失去运动能力与平衡能力时10 min进入休眠状态,但仅能维持5 h,而在14 ℃条件下,鱼体的运动与平衡能力正常而呼吸较弱的镇静或半休眠状态下,能维持24 h,与本研究结果相似。
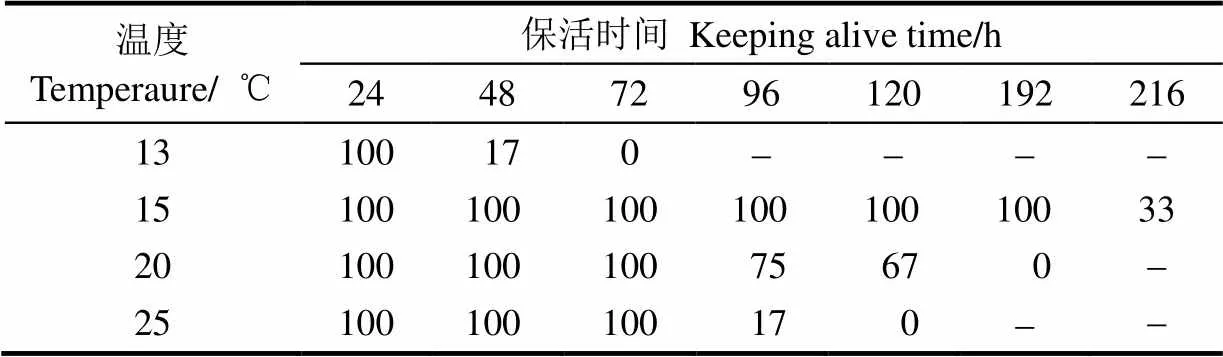
表1 珍珠龙胆石斑鱼在不同温度与保活时间时的存活率
2.3 温度对珍珠龙胆石斑鱼保活过程中水质指标的影响
在鱼类充氧保活运输方式中,能在一定时间内能维持水体的溶解氧,实现高密度保活运输。如图2所示,在保活过程中,pH值维持在7.5~8.0之间,且无显著变化。15~20 ℃水体中电导率变化较小。电导率反映水体中离子浓度,随着保活时间的延长,水体中离子浓度增加,25 ℃保活组增加最快,表明温度越高鱼体呼吸代谢越强,水体中的离子含量越高,水体电导率上升越快。

图2 温度对保活水体的pH值、电导率、总氨氮与非离子氨氮含量的影响
温度影响鱼体代谢率,直接对鱼体排泄产生影响,排泄率随温度升高而增大,保活流通中温度越高,代谢越强,代谢产物的排出越多,越会造成水质污染,影响保活时间与存活率。鱼类蛋白质代谢最主要的排泄产物是氨和尿素,氨在鱼体内以非离解氨和离解氨2种形式存在,通过扩散作用及NH4+/Na+交换由细胞膜排出体外,在水中富集[14]。试验结果表明,水体中总氨氮(total ammonia nitrogen,TAN)浓度与非离子氨氮(unionized ammonia nitrogen,UIA-N)浓度随温度升高和时间延长呈明显增加趋势,在15 ℃保活组非离子氨氮含量在0~48 h内上升较缓慢,而在48 h后上升显著。
与25 ℃保活组相比,20、15 ℃保活组TAN浓度在72 h时降低了11.21%和38.12%,96 h时分别降低了17.82%和57.76%。UIA-N浓度在72 h时降低了7.35%和61.76%,96 h时分别降低了27.66%和59.57%。研究表明运输水温适当降低10℃,多数水产品的耗氧量和氨类物质产量降低50%[15]。仇登高等研究表明珍珠龙胆石斑鱼在水温26.6 ℃时排泄率达到最大值[16]。在本研究中,15 ℃组与25 ℃组相比,珍珠龙胆石斑鱼在24~96 h内的总氨氮浓度降低量在38.12%~57.76%,与上述研究结果一致。表明低温能通过降低石斑鱼的代谢率而达到降低氨氮类代谢产物的排出,减少水质恶化达到延长保活流通时间目的。
氨氮具有神经毒性,会引起鱼类在运输过程中惊厥、昏迷甚至死亡[17]。本研究中,在25 ℃组72 h后鱼体出现死亡,此时水体中非离子氨氮浓度达到0.34 mg/L,远超出《海水水质标准》(GB 3097-1997)中的0.02 mg/L,表明珍珠龙胆石斑鱼在高密度保活过程中能够耐受的非离子氨氮浓度应不超过0.34 mg/L。
2.4 温度对保活过程中珍珠龙胆石斑鱼应激的影响
珍珠龙胆石斑鱼经低温休眠处理及不同温度保活72 h后的血糖与血清皮质醇浓度变化见图3。

注:Fresh为鲜鱼(对照组),Dormant为休眠组,15、20、25 ℃分别为15、20、25 ℃条件下保活处理组。
由图3可知,与新鲜鱼(对照组)相比,休眠处理后血清皮质醇与血糖均显著上升(<0.05);不同温度保活72 h后鱼体皮质醇含量均显著增加(<0.05),且高温组(20、25℃)显著高于低温组(15℃)(<0.05),15 ℃保活72 h后血清皮质醇含量恢复到保活前休眠时水平。随着保活时间的延长,血糖水平在保活72 h后均表现为显著上升(<0.05),15、20、25℃保活72 h后分别达到新鲜组血糖水平的3.24、2.21、1.54倍。结果表明保活过程中由于水质恶化、饥饿及拥挤应激导致导致鱼体能量代谢增强,且高温保活过程中由于鱼体的运动与呼吸较低温下强,糖原的分解与消耗使血糖水平在72 h后开始下降;而低温下,鱼体代谢降低、能量消耗较少,所以血糖仍维持高水平。这可能也是低温能延长保活时间的原因之一。
当鱼类受到应激后,下丘脑一垂体一肾间组织轴会迅速作用促进促肾上腺皮质激素的释放,从而导致头肾细胞皮质醇激素的合成与释放。皮质醇、血糖常被作为应激反应的敏感指标,可以反映鱼类应激反应的强弱[18]。珍珠龙胆石斑鱼经2 ℃/h的降温速度降至半休眠状态时,鱼体血清皮质醇与血糖均显著上升,表明鱼体受到低温应激,在大口鲈鱼、斑马鱼中均显示相似的结果[19-20];而鲫鱼的人工休眠处理中,皮质醇显著上升,而血糖出现显著下降[5,21],这可能与鱼的种类与代谢机制不同,对低温的适应性不同有关。
在有水保活运输过程中,水质恶化(主要是由于氨氮与CO2的增加,O2和pH值的下降所引起)与拥挤是主要的应激因素;而温度是引起鱼体呼吸代谢导致水质恶化的最主要的因素[20]。Zhao 等[19]在大口鲈鱼的运输研究中表明低温能显著降低水体的总氨氮含量与血清皮质醇含量,降低鱼体的应激反应。在本研究中,珍珠龙胆石斑鱼经过低温休眠处理后,15℃保活72 h后的血清皮质醇含量显著降低,表明低温能降低珍珠龙胆石斑鱼保活运输后的应激反应;但仍高于正常对照组,表明在保活运输72 h后,鱼体的应激反应不能立即恢复到正常水平。这与运输后水体总氨氮含量增加导致应激反应增强有关[3,19]。
鱼体在低温胁迫过程中可通过糖异生作用增加血糖以维持体内血糖的平衡[22]。石斑鱼在接近休眠温度的条件下(15℃)进行低温保活72 h后,出现典型的高血糖症,且血糖增加倍数显著高于高温保活组,这主要与低温下能量消耗降低,而糖异生作用生成葡萄糖,使得在饥饿、拥挤、水体总氨氮含量上升等多种胁迫因素的应激作用下石斑鱼仍维持较高的血糖水平。这也可能与低温刺激后皮质醇激素增高有关,皮质类固醇可使机体各组织对葡萄糖的利用率降低,同时使肝脏的糖元异生作用增强, 结果使血搪升高[22]。如:美洲鲥处于应激时, 肾上腺髓质释放肾上腺素的量也增加,可促使糖元分解成葡萄糖进入血液,引起血糖升高[23]。另外在大西洋鲑鱼[24]、大口鲈鱼[19]等运输中均表现出显著的高血糖症状。
2.5 温度对保活前后珍珠龙胆石斑鱼血清生化指标的影响
珍珠龙胆石斑鱼在不同温度下保活72 h后血清生化指标的变化见表2。
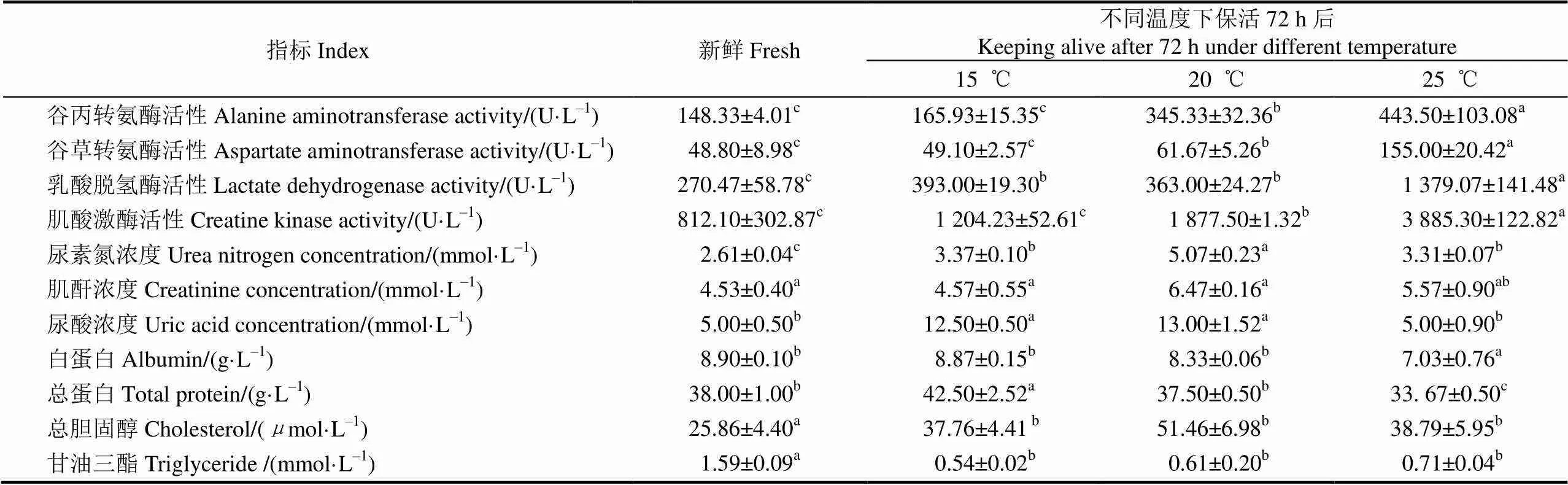
表2 珍珠龙胆石斑鱼不同温度保活前后血清生化指标的变化
由表2可知,珍珠龙胆石斑鱼经低温休眠后在25 ℃保活72 h后,与保活前相比,血清ALT、AST、LDH与CK酶活性均显著上升(<0.05);20 ℃保活72 h后,血清ALT,AST均显著上升(<0.05),CK恢复到正常水平,而LDH显著下降(<0.05);15 ℃保活72 h后ALT,AST,CK均无显著性变化,LDH显著上升。表明低温保活能降低鱼体内的代谢水平,而高温保活72 h鱼体内代谢与物质转化发生变化,导致组织受损,引起血清代谢酶活性的显著上升,这也是高温条件下保活一定时间后鱼体出现死亡的原因之一。在血清生化指标中,15 ℃保活72 h后BUN、UA、TP均显著增加(<0.05);20 ℃保活72 h后BUN和UA显著上升(<0.05);25 ℃保活72 h后BUN显著增加(<0.05),ALB和TP显著下降(<0.05);在保活72 h后血清中TG显著下降(<0.05),而CHOL显著增加(<0.05)。表明珍珠龙胆石斑鱼的有水保活运输过程中BUN、TP、TG、CHOL可作为指示性指标。
温度可直接影响鱼类呼吸和能量代谢。在低温应激下,鱼体一方面能量消耗增加,另一方面神经激素分泌减少,消化酶活性降低,能量代谢酶活性和代谢模式改变,导致鱼类代谢紊乱[18]。
血清转氨酶活性是反映机体代谢和物质转化的状况的重要指标,且反映机体组织结构的功能状态,是组织细胞膜完整性的一个重要标志。当肝脏、心脏和肌肉组织受损时,血液中ALT和AST的活性会显著升高。对吉富罗非鱼的低温应激12 h后ALT与AST均显著升高[25];而尤宏争等的研究发现对珍珠龙胆石斑鱼经30 min的运输胁迫后在6 h时ALT和AST显著上升,之后逐渐恢复至运输前水平[26];本试验中保活后与保活前相比,ALT、AST在低温(15℃)保活组变化不显著,在高温(20,25℃)保活后显著上升,表明低温保活条件下,鱼体代谢降低,运动减少,能量代谢达到新的平衡状态,应激反应对鱼体肝脏与心脏没有引起显著的影响。
乳酸脱氢酶(LDH)是糖代谢中催化丙酮酸无氧代谢生成乳酸的酶。理论认为,LDH活性主要取决于机体细胞内氧分压的高低,当细胞内氧分压降低时,LDH的合成加快,其活性增强;当细胞内供氧充足时,LDH的合成受到抑制,活性降低[27]。对云纹石斑鱼()幼鱼进行7 d的低温胁迫后LDH显著升高,在本试验中,保活72 h后各温度组的LDH酶活均显著上升[28],与尤宏争等[26]研究结果一致。表明运输后虽然水体中氧气充足,但鱼体细胞内氧气与血红蛋白的结合受到影响,鱼体以无氧代谢供能;同时低温下鱼体呼吸频率下降,体内代谢水平下降,但也以无氧呼吸代谢供能。
肌酸激酶(CK)是作用磷酸肌酸与二磷酸腺苷(ADP)之间可逆反应的一种氧化酶,与ATP的再生有关,在生理水平上维持细胞内ATP的浓度。当心肌受损时,CK酶活性上升,维持体内能量代谢。高温下(20 、25 ℃)保活72 h后CK酶活性显著上升,且温度越高上升越显著,表明高温条件下,鱼体呼吸代谢加快,ATP能量消耗加速,保活72 h后心肌受损,导致死亡。而低温下保活72 h后CK酶活性无显著性增加,表明珍珠龙胆石斑鱼经过低温休眠处理后鱼体内代谢达到新的平衡状态,保活72 h后不会引起心肌的损伤。
尿素氮(BUN)是蛋白质与氨基酸代谢的终产物,尿酸(UA)是嘌呤分解代谢产物,肌酐(CREA)主要是体内肌酸的代谢产物,这3种物质均由肾脏代谢排出,因此是反映肾功能代谢情况的重要指标,尿素也是维持血液渗透压的主要成分。由表2可看出在保活72 h后,尿素氮均显著上升。饥饿状态下不同动物尿素的排放规律不一致,呈现下降或上升趋势[29];在大菱鲆的保活过程中,低温使BUN、CR与UA均显著上升,本试验结果与其一致[7]。肾功能减退时尿酸会升高,表2显示在低温保活组(15,20 ℃)尿酸在保活后显著升高,而在高温保活组尿酸含量恢复到正常水平,说明低温下保活对肾功能有显著影响。肌酐是肾脏机能的一个重要指标,肾脏机能发生障碍,血液中肌酐含量会升高,由表2可见保活后肌酐含量上升但无显著性。在当外界环境温度降低时,养殖鱼体的肾脏和鳃等器官会出现损伤,对CREA 的滤过或者渗出发生障碍,进而造成血清中肌酐水平的升高[12,30]。
总胆固醇(CHOL)和甘油三酯(TG)是动物细胞贮脂的主要形式和细胞膜的重要组分,本试验中保活前后CHOL与TG含量均显著下降,可能是低温对肝脏的损伤阻碍了CHOL 和TG 通过肠肝循环途径进入肝脏被重吸收,同时饥饿条件下体内能量物质的消耗。
总蛋白(TP)和白蛋白(ALB)可反映肝功能的代谢情况,白蛋白是由肝脏合成的,在血液中起着载体的作用,与血液中大部分水分、胆红素、尿酸、钙等结合而进行运送,与代谢、营养关系密切,当长期处于不良状态时,白蛋白会显著下降[19]。保活72h后,低温TP显著上升而ALB无显著变化,表明低温能保护蛋白质的代谢,同时由于低温应激蛋白的合成导致总蛋白含量的增加;高温保活下石斑鱼处于饥饿与高温应激状态,TP和ALB均显著下降。
2.6 温度对保活过程中珍珠龙胆石斑鱼背肌营养成分的影响
不同温度保活前后珍珠龙胆石斑鱼肌肉营养组成见表3。由结果可以看出,15 ℃保活72 h后肌肉的水分、粗蛋白含量均无显著变化,脂肪含量显著下降(<0.05);20与25 ℃保活72 h后肌肉的水分含量无显著变化,粗蛋白与粗脂肪含量均显著下降(<0.05);肌肉中糖原含量在保活72 h后均显著下降(<0.05),与新鲜对照组相比,15、20、25 ℃保活72 h后糖原含量分别下降32.50%、43.30%和65.80%;脂肪含量分别下降36.32%、46.84%和48.42%。25 ℃保活72 h后肌肉乳酸含量显著下降,持水力显著下降(<0.05);保活72 h后肌肉pH值变化不显著。
表3 不同温度保活前后肌肉理化性质的变化
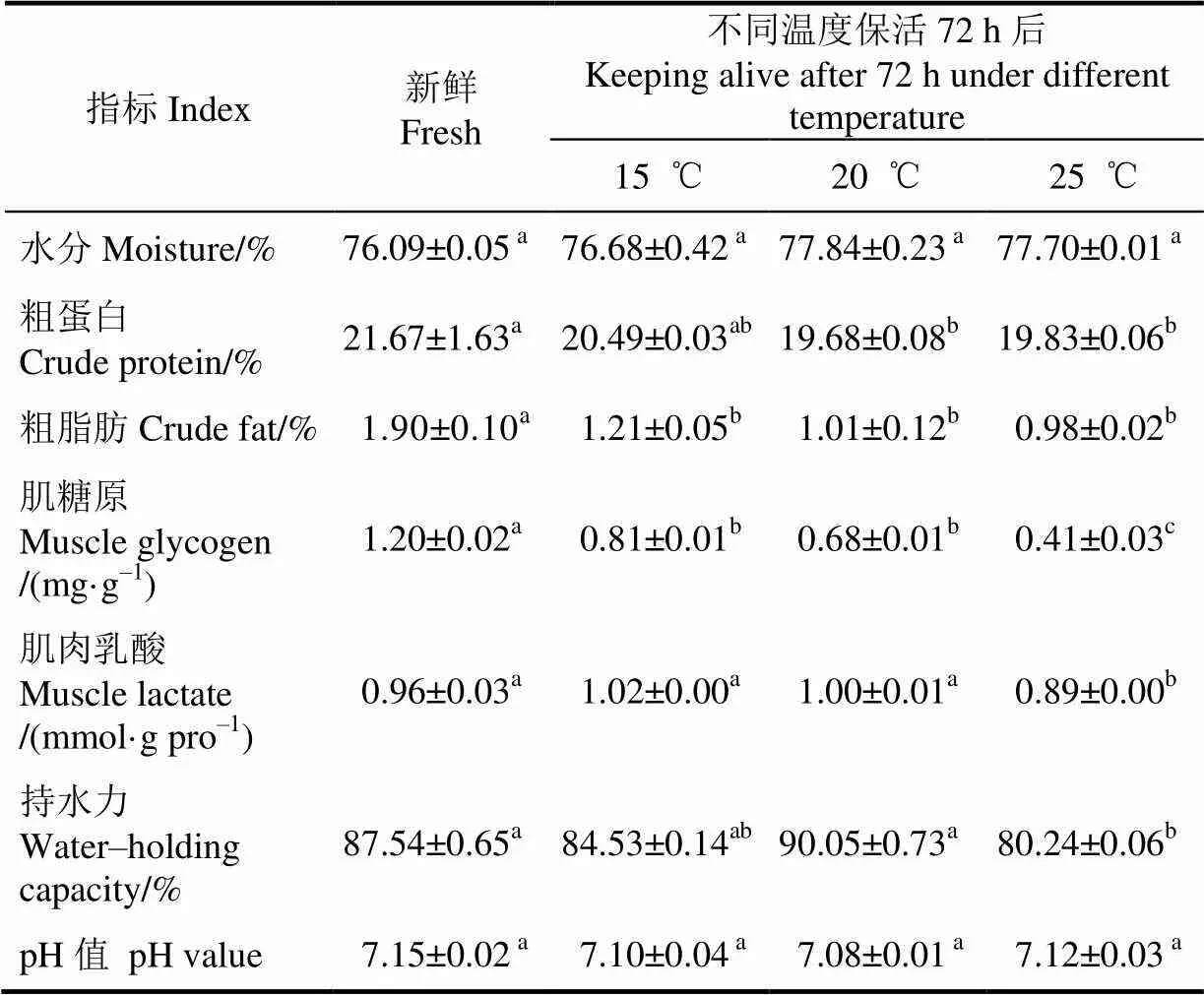
Tab.3 Changes of muscle physical and chemical characteristics of grouper during keeping alive under different temperatures
低温下保活对肌肉水分与蛋白含量影响较小,对脂肪与糖原含量影响显著,pH值在低温保活期间与肉质的变化无明显的相关关系。在15 ℃下,石斑鱼处于静止状态,呼吸频率降低,活动少,对能量的需求降低,但在低温与饥饿的应激作用下,通过能量物质脂肪与糖原的分解维持机体的能量需求。同时糖原分解成葡萄糖进入血液引起血糖的升高。保活温度越高,机体新陈代谢水平越强,糖原作为主要的能量物质消耗越大,导致高温比低温下保活后鱼体的糖原的保留量越少。大多数鱼类在饥饿时,主要通过消耗体内储存的脂肪和糖原获得能量,以维持机体在饥饿胁迫下的正常生理代谢。饥饿时鱼类对蛋白质的利用较少,而且一般是在脂肪被大量消耗以后;只有少部分的鱼在饥饿期间主要消耗蛋白质[31-32]。在本研究中,保活72 h后的鱼体肌肉中蛋白质、脂肪与糖原均有不同程度的下降,但低温组蛋白质下降不显著,表明珍珠龙胆石斑鱼在饥饿时主要消耗肌肉中的脂肪与糖原供能。这与低温运输鲫鱼研究结果一致[14]。
3 结 论
珍珠龙胆石斑鱼的生态冰温临界温度为12 ℃,经过2 ℃/h的降温速率使温度降到13~14 ℃时,鱼体处于镇静的半休眠状态,急性低温应激反应使鱼体出现皮质醇显著增加与典型的高血糖现象,但此时鱼体代谢达到新的平衡状态。
1)将休眠后的鱼体转移到25,20和15 ℃的水体中进行保活96 h后的存活率分别为17%,75%和100%,且水体内TAN和UIA-N随温度升高和保活时间延长而增加,15与25 ℃保活组相比,珍珠龙胆石斑鱼的总氨氮排泄量降低38.12%~57.76%,且保活72 h后15℃组血清皮质醇浓度显著低于25 ℃保活组。
2)与新鲜的珍珠龙胆石斑鱼相比,保活72 h后,25 ℃保活组血清ALT、AST、LDH和CK酶活性均显著上升,肌肉中粗蛋白、粗脂肪和糖原含量均显著下降;15 ℃保活组ALT、AST和CK酶活性均无显著性变化,LDH酶活性显著上升;且肌肉中仅糖原与粗脂肪含量有所下降,水分、粗蛋白、乳酸、持水力、pH均无显著变化。
3)25 ℃保活条件下珍珠龙胆石斑鱼通过增强机体代谢酶活性,增加能量物质代谢,而导致肌肉品质下降;而经过休眠后的鱼体在15 ℃能维持较低的代谢水平,生存能力提高,肌肉品质无显著变化。因此15 ℃适合珍珠龙胆石斑鱼的长途保活运输。
[1] Sun Y, Huang Y, Hu G J, et al. Comparative transcriptomic study of muscle provides new insights into the growth superiority of a novel grouper hybrid[J]. Plos One, 2016, 11(12): 1—16.
[2] King H R. Fish transport in the aquaculture sector: An overview of the road transport of Atlantic salmon in Tasmania[J]. Journal of Veterinary Behavior-Clinical Applications and Research, 2009, 4: 163—168.
[3] Golombieski J I. Transport of silver catfish () fingerlings at different times, load densities, and temperatures[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2003 , 216(1): 95—102 .
[4] Barrento S, Powell A. The effect of transportation and re-watering strategies on the survival, physiology and batch weight of the blue mussel, Mytilus edulis[J]. Aquaculture, 2016, 450: 194—198.
[5] Mi H B, Qian C L, Mao L C. Quality and biochemical properties of artificially hibernatedfor waterless preservation[J]. Fish Physiology and Biochemistry2012, 38: 1721—1728.
[6] 刘骁,谢晶,杨茜,等. 无水保活条件下团头鲂生理应激及鱼肉品质的变化[J]. 农业工程学报,2016,32(3): 295—300. Liu Xiao, Xie Jing, Yang Xi, et alChange of physiological stress and flesh quality ofduring suitable waterless keep alive conditions[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(3): 295-300. (in Chinese with English abstract)
[7] 刘伟东. 大菱鲆()保活的基础研究[D]. 青岛:中国海洋大学,2009. Liu Weidong. Basic Research on Keep-alive of Turbots ()[D]. Qingdao: Ocean University of China, 2009. (in Chinese with English abstract)
[8] Samet M, Nakamura K, Nagayama T. Tolerance and respiration of the prawn () under cold air conditions[J]. Aquaculture, 1996, 143: 205-214.
[9] Spanoghe P T, Bourne P K. Relative influence of environmental factors and processing techniques on Panulirus cygnus morbidity and mortality during simulated live shipments[J]. Marine & Freshwater Research, 1997, 48: 839-844.
[10] Emerson K, Russo R C, Lund R. E, et al. Aqueous ammonia equilibrium calculations: Effect of pH and temperature[J]. Journal of the Fisheries Research Board of Canada, 1975, 32: 2379-2383.
[11] 邵彦翔,陈超,李炎璐. 低温胁迫对云纹石斑鱼(♀)×鞍带石斑鱼(♂)杂交后代血清生化指标的影响[J]. 渔业科学进展,2017,38(2):70-76. ShaoYanxiang, Chen Chao, Li Yanlu, et al. Effects of low temperature stress on serum biochemical indices of the juvenile hybrid of♂[J]. Progress in Fishery Sciences, 2017, 38(2): 70-76. (in Chinese with English abstract)
[12] 韩利英,张慜. 鲫鱼保活条件对存活率的影响[J]. 食品与生物技术学报,2009,28(5):642-646. Han Liying, Zhang Min. Effect of surviving conditions on surviving rates of cultivation[J]. Journal of Food Science and Biotechnology, 2009, 28(5): 642-646. (in Chinese with English abstract)
[13] Yoshikawa H, Ishida Y, Ueno S, et al. Short-and long-term cold-anesthesia in Carp[J]. Nippon Suisan Gakkaishi, 1988, 94: 457-462.
[14] Ibarz A, Padros F, Gallardo M A, et al. Low-temperature challenges to gilthead sea bream culture: Review of cold-induced alterations and “winter syndrome”[J]. Review in Fish Biology& Fisheries , 2010, 20: 539–556.
[15] 张瑞霞,张娟,熊善柏,等. 低温处理对鲫生化特性及肉质的影响[J]. 华中农业大学学报,2008,27(4):532-535. Zhang Ruixia, Zhang Juan, Xiong Shanbo, et al. Effects of low-temperature treatment on biochemical chracteristic and meat quality of[J]. Journal of Huazhong Agricultural University, 2008, 27(4): 532-535. (in Chinese with English abstract)
[16] 仇登高,黄种持,郑乐云,等. 温度对不同规格珍珠龙胆石斑鱼(棕点石斑鱼♀×鞍带石斑鱼♂)呼吸和排泄的影响[J]. 中国水产科学,2017,24(2):295-305. Qiu Denggao, Huang Zhongchi, Zheng Leyun, et al. Effects of temperature on respiration and excretion by different sizes of hybrid grouper (♂)[J]. Journal of Fishery Sciences of China, 2017, 24(2): 295-305. (in Chinese with English abstract)
[17] Shabani F, Erikson U, Beli E, et al. Live transport of rainbow trout () and subsequent live storage in market: Water quality, stress and welfare considerations[J]. Aquaculture, 2016, 453: 110-115.
[18] Seibert H. Effects of temperature on glucose release and glycogen metabolism in isolated hepatocytes from rainbow trout ()[J]. Comparative Biochemistry and Physiology, 1985, 81(4): 877-883.
[19] Zhao J H, Zhu Y J, He Y F, et al. Effects of temperature reduction and MS-222 on water quality and blood biochemistry in simulated transport experiment of largemouth bronze gudgeon,[J]. Journal of the World Aquaculture Society, 2014, 45(5): 493-507.
[20] Sampaio F D F, Freire C A: An overview of stress physiology of fish transport: changes in water quality as a function of transport duration[J]. Fish and Fisheries2016, 17: 1055-1072
[21] Zeng P, Chen T J, Shen J. Effects of cold acclimation and storage temperature on crucian carp () in a waterless preservation[J]. Fish Physiology and Biochemistry, 2014, 40: 973-982.
[22] 许友卿,郑一民,丁兆坤. 冷应激对水生动物代谢的影响及调控研究进展[J]. 中国水产科学,2017,24(5):1149-1159.Xu Youqing, Zheng Yimin, Ding Zhaokun. Research progress on the effects, mechanisms, and control of coldstress in aquatic animals[J]. Journal of Fishery Sciences of China, 2017, 24(5): 1149-1159. (in Chinese with English abstract)
[23] 杜浩,危起伟,甘芳,等. 美洲鲥应激后皮质醇激素和血液生化指标的变化[J]. 动物学杂志,2006 ,41(3):80-84. Du Hao, Wei Qiwei, Gan Fang, et al. Changes in serum cortisol and blood biochemical parameters after stress in American shad[J]. Chinese Journal of Zoology, 2006, 41(3): 80-84 . (in Chinese with English abstract)
[24] Sandodden R, Finstad B, Iversen M. Transport stress in Atlantic salmon (L.): Anaesthesia and recovery[J]. Aquaculture Research , 2001 , 32(2): 87-90.
[25] 刘波,王美垚,谢骏,等. 低温应激对吉富罗非鱼血清生化指标及肝脏HSP70基因表达的影响[J]. 生态学报,2011,31(17):4866-4873. Liu Bo, Wang Meiyao, Xie Jun, et al. Effects of acute cold stress onserum biochemical and immune parameters and liver HSP70 gene expression in GIFT strain of Nile tilapia ()[J]. Acta Ecologica Sinica, 2011, 31(17): 4866-4873. (in Chinese with English abstract)
[26] 尤宏争,石洪玥,贾磊,等. 短途运输胁迫对珍珠龙胆石斑鱼血清酶活力及葡萄糖含量的影响[J]. 经济动物学报, DOI: 10.133261j.jea.2017.1222.You Hongzheng, Shi Hongyue, Jia Lei, et al. Effect of short-distance transportation stress on serum enzyme activity and glucose content of Pearl Gentian Grouper (♂ )[J]. Journal of Economic Animal, DOI: 10.133261j.jea.2017.1222. (in Chinese with English abstract)
[27] Hoseini S M, Nodeh A J. Changes in blood biochemistry of commoncarp(Linnaeus), following exposure to different concentrations of clove solution[J]. Comparative Clinical Pathology, 2013 , 22 (1): 9-13.
[28] 施兆鸿,张艳亮,高权新,等. 云纹石斑鱼幼鱼血清生化指标对低温胁迫的响应[J]. 生态学杂志,2015,34(8):2222-2228. Shi Zhaohong, Zhang Yanliang, Gao Quanxin, et al. Effects of low-temperature stress on serum biochemical parameters and metabolic enzyme activity in juvenile[J]. Chinese Journal of Ecology, 2015, 34(8): 2222-2228. (in Chinese with English abstract)
[29] Rios F S A, Moraes G, Oba E T, et al. Mobilization and recovery of energy stores in traira,() during long-term starvation and after refeeding[J]. Journal of Comparative Physiology, 2006, 176(7): 721-728.
[30] Sano T. Haematological studies of the culture fishes in Japan[J]. Journal of Tokyo University of Fisheries, 1962(48): 105-109
[31] Hsieh S L, Chen Y N, Kuo C M. Physiological responses, desaturase activity and fatty acid composition in milkfish () under cold acclimation[J]. Aquaculture, 2003, 220( 1-4): 903-918.
[32] 龙章强,彭士明,陈立侨,等. 饥饿与再投喂对黑鲷幼鱼体质量变化、生化组成及肝脏消化酶活性的影响[J]. 中国水产科学,2008(4):606-614. Long Zhangqiang, Peng Shiming, Chen Liqiao, et al. Effects of starvation and re-feeding on body weight, tissue biochemical composition and hepatic digestive enzyme activity in juvenile black seabream,[J]. Journal of Fishery Sciences of China, 2008(4): 606-614. (in Chinese with English abstract)
Effects of temperature on metabolism function and muscle quality of grouper during process of keeping alive with water
Fan Xiuping1, Qin Xiaoming1※, Zhang Chaohua1,2, Chen Jianping1,Zhu Qianfeng1, Chen Pengwen1
(1.524088,; 2.510275,)
The aim of this paper was to investigate the effect of temperature treatment on the metabolism function and muscle quality of grouper (♀♂) before and after keeping alive with water for 72 h. Groupers with body weight of 503±31 g were cultured in laboratory without feeding for 48 h, then treated by temperature reduction to 13-14 ℃ at the rate of 2 ℃/h, and then kept alive at 15, 20, 25 ℃. According to the survival rate at different temperatures, the changes of water quality, blood biochemistry, metabolic enzyme activity and muscle quality were compared before and after keeping alive for 72 h. The results indicated that the survival rates of the groups at 15, 20, 25 ℃ after preservation for 96 h were 100%, 75% and 17%, respectively. The respiration rate was decreased as the temperature dropped, low temperature preservation (15 ℃) significantly reduced the contents of metabolites in the water, and the total ammonia nitrogen (TAN) yield in the 15 ℃group decreased by 38.12%-57.76% compared with the 25 ℃group. The results showed that low temperature could slow the deterioration of water quality by reducing the respiratory metabolism of fish and reducing the content of TAN and non-ionic ammonia nitrogen in water. The serum cortisol and blood glucose content were increased significantly in the hibernation group (<0.05). After keeping alive for 72 h, the serum cortisol concentration in the 15 ℃ group decreased significantly, while the blood glucose concentration was higher than that in the 25 ℃ group (<0.05). The results showed that hypothermia could decrease the stress response and induce the “hyperglycemia symptom” of fish during the keeping alive progress. After 72 h preservation, the serum glutamic-pyruvic transaminase, glutamic-oxalacetic transaminase, and creatine kinase activities in the 15 ℃ group showed no significant change (>0.05); lactate dehydrogenase activity, the level of serum usea nitrogen, uric acid, and total protein increased, while triglyceride concentration decreased significantly (<0.05). The contents of glycogen and crude fat in muscle decreased by 32.50% and 36.32% respectively, while the content of moisture, crude protein, lactic acid, and water holding capacity, and pH value had no significant change in the 15 ℃ group (>0.05). The muscle quality in the 15 ℃ group was better than that in the 25 ℃ group. The results suggested that after the keeping alive at 25 ℃, the metabolism function of the grouper was increased by enhancing the activity of metabolic enzymes, which led to the deterioration of muscle quality. The dormant fish could maintain low metabolic level at 15 ℃ and improve survival ability. Therefore the most appropriate temperature for keeping alive of grouper is about 15 ℃ during the long-distance transport. The results provide a reference for the transport of grouper.
fish; enzyme acitivity; physiochemical properties; grouper (♀); low temperature keeping alive; biochemical of blood serum
范秀萍,秦小明,章超桦,陈建平,朱乾峰,陈鹏文.温度对有水保活石斑鱼代谢与鱼肉品质的影响[J]. 农业工程学报,2018,34(14):241-248.doi:10.11975/j.issn.1002-6819.2018.14.031 http://www.tcsae.org
Fan Xiuping, Qin Xiaoming, Zhang Chaohua, Chen Jianping, Zhu Qianfeng, Chen Pengwen.Effects of temperature on metabolism function and muscle quality of grouper during process of keeping alive with water[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(14): 241-248. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2018.14.031 http://www.tcsae.org
2018-01-31
2018-04-25
广东省科技计划项目(NO:2015B020205003);广东普通高等学校水产品高值化加工与利用创新团队建设项目(GDOU2016030503);广东省大学生创新创业训练计划项目(CXXL2017035)
范秀萍,讲师,研究方向:水产品保活流通。Email:fanxp08@163.com
秦小明,博士,教授,博士生导师,研究方向:水产品加工与保活流通。Email:758983196@qq.com
10.11975/j.issn.1002-6819.2018.14.031
TS254.1
A
1002-6819(2018)-14-0241-08
