孤立性前降支或回旋支开口病变介入治疗疗效观察
2018-08-09戚晨良尤威叶飞吴志明贾海波陈绍良张俊杰刘玲玲林玲徐海梅
戚晨良 尤威 叶飞 吴志明 贾海波 陈绍良 张俊杰 刘玲玲 林玲 徐海梅
冠状动脉开口病变是指冠状动脉开口部位3 mm以内的严重动脉粥样硬化病变[1]。此类病变特殊的角度使行介入治疗时支架准确定位困难,其成分多以纤维钙化斑块为主以及开口处血管平滑肌弹性回缩更明显使得支架膨胀不良发生率高等特点,致使无论是裸金属支架时代还是药物洗脱支架时代早期,此类病变行介入治疗均有较高的远期支架内再狭窄(ISR)发生率[2]。2005年 Szabo等[3]在美国经导管心血管治疗学术会议(TCT)上首次报道了在实验动物以及3例患者使用Szabo技术治疗冠状动脉开口病变均获了良好的效果。此后国内外多个研究报道了使用Szabo技术治疗包括主动脉-冠状动脉开口病变及非主动脉-冠状动脉开口病变均取得了良好临床效果[4-8]。但对于孤立性前降支(LAD)或回旋支(LCX)开口病变,亦即左主干(LM)末端 Medina分型为0,1,0或 0,0,1的分叉病变,介入治疗难度及风险又较主动脉-冠状动脉开口病变及其他非主动脉-冠状动脉开口病变更高,这与LAD及LCX多变的分叉角度及一旦处理不慎影响LM将产生灾难后果有关。为此,本研究收集了孤立性LAD或LCX开口病变患者的介入治疗资料,旨在总结处理此类病变的经验。
1 对象与方法
1. 1 研究对象
回顾性研究2012年1月至2015年11月南京市第一医院和常州市中医医院共完成的孤立性LAD或LCX开口病变行介入治疗并收集完整随访资料的患者89例,平均年龄(62.62±10.63)岁。根据介入治疗方法不同分为使用直接精确定位支架技术组20例(D组)、使用跨越支架技术组44例(C组)以及使用Szabo技术组25例(S组)。
1. 2 术前、术中及术后用药
所有患者术前均给予阿司匹林100 mg、每日1次,氯吡格雷75 mg、每日1次,至少3 d,术前12~24 h再次给予负荷剂量阿司匹林300 mg及氯吡格雷300~600 mg。术中肝素化方法按100~120 U/kg[临床上未常规测量全血活化凝血时间(ACT),如测量则维持术中ACT>300 s]的剂量鞘管内注入,如操作时间超过1 h,则按照2000 U/h的剂量额外补充。所有患者介入治疗经桡动脉入径,在桡动脉穿刺成功后常规鞘管内注入肝素2500 U+硝酸甘油200 µg+维拉帕米1.25 mg以防止桡动脉痉挛。至于术中是否需使用血小板糖蛋白Ⅱb/Ⅲa受体拮抗剂,则由术者根据临床具体情况决定。根据《中国经皮冠状动脉介入治疗指南2012(简本)》[9]及《抗血小板治疗中国专家共识》[10],术后给予阿司匹林100 mg、每日1次,氯吡格雷75 mg、每日1次,维持至少1年;术后长期服用他汀类药物,按冠心病二级预防给予其余药物治疗。
1. 3 介入治疗
(1)直接精确定位支架技术:将一根导引钢丝送入目标血管,充分预扩张后沿导引钢丝输送支架到位,在多个造影投照体位下精确定位支架仅覆盖病变段后释放。(2)跨越支架技术:支架覆盖病变全程并拖至LM内3 mm以上。(3)Szabo技术[3]:送两根导引钢丝分别进入LAD及LCX,送入球囊充分预扩张病变,将拟置入的支架轻轻拔出支架保护套管以使最远端(支架释放后靠近LM一侧)一节的支架钢梁暴露,连接上压力泵后以2~4 atm(1 atm=101.325 kPa)压力膨胀支架以使最后一节支架钢梁轻度膨胀开,将分支导引钢丝的尾端穿过支架的最后一个网孔,轻捏最远端已膨胀的支架钢梁使支架尽可能地回抱以减小支架的外径,将主支的导引钢丝穿过支架球囊的中心腔,接着固定两根导引钢丝的尾端后推送支架至目标血管病变部位,因有对侧分支导引钢丝的牵绊,支架难以突入LM过多或进入目标血管过多,至支架难以进一步推送后以8~10 atm膨胀支架,接着退出对侧分支的导引钢丝,再以12~14 atm 释放支架(图1~4)。
1. 4 手术成功标准
支架定位准确(即支架完全覆盖整个开口病变而并未突入主干太多)并无支架脱载、对另一支血管的开口无显著影响、术前既定介入治疗技术方案无变更、目标血管残余狭窄<20%,靶血管远端前向血流达心肌梗死溶栓治疗(thrombolysis in myocardial infarction,TIMI)血流Ⅲ级,无严重的介入相关并发症如急性心肌梗死、急诊冠状动脉旁路移植术(coronary artery bypass graft,CABG)、死亡等。

图1 支架保护套后退一节,以2~4 atm压力膨胀,边支导丝穿入已膨胀的支架钢梁(1 atm=101.325 kPa)

图2 再次捏紧支架的膨胀部位

图3 固定两根导丝并推送入支架至目标位置

图4 释放支架
1. 5 主要不良心血管事件(MACE)
MACE包括非致死性心肌梗死[定义为有临床缺血症状且术后心肌标志物肌钙蛋白I(TnI)、肌酸激酶同工酶(CK-MB)升高超过正常上限两倍,伴或不伴ST段抬高及Q波形成]、靶血管血运重建(TVR)[定义为支架内或支架近端、远端5 mm范围内的病变需再次介入治疗]和死亡(定义为各种原因的死亡)。
1. 6 冠状动脉造影定量分析
患者术前、术后以及1年后随访的冠状动脉造影均采用CAAS系统(Pie Medical Imaging公司,荷兰)。按照标准方法定量分析测量参考血管直径、最小管腔直径、管腔直径狭窄百分比和病变长度。冠状动脉造影定量分析采用单盲法,由南京医科大学附属南京医院影像学研究室有经验的技师完成。由南京医科大学附属南京医院心脏中心的冠状动脉随访小组完成门诊或电话随访,1年后冠状动脉造影复查随访。
1. 7 统计学分析
所有数据采用SPSS16.0软件进行处理。计量资料以均数±标准差表示,组间比较采用t检验。计数资料以率或构成比表示,组间比较采用χ2检验。以P<0.05为差异统计学有意义。
2 结果
2. 1 三组患者一般临床资料比较
三组患者性别、年龄、各种冠心病危险因素、术前肾功能不全和心功能不全发生情况比较,差异均无统计学意义(均P>0.05),故三组患者基线资料具有可比性(表1)。
2. 2 三组患者冠状动脉造影特征及介入治疗资料比较
三组患者冠状动脉造影均经桡动脉入径,冠状动脉造影资料显示开口病变(LAD、LCX)、LM开口成角、LM长度>15 mm、LAD与LCX夹角<70 、病变段中至重度钙化比较,差异均无统计学意义(均P>0.05)。三组患者介入治疗均使用6 F指引导管,但S组EBU指引导管使用率高于D组(56.0%比10.0%,P=0.001)和C组(56.0%比 11.4%,P<0.001),S组 J L指 引 导 管使用率低于D组(44.0%比90.0%,P=0.001)和C组(44.0%比88.6%,P<0.001),差异有统计学意义。三组患者均使用药物洗脱支架,在置入支架平均直径、分支置入支架、术中使用血管内超声(IVUS)、手术时间、对比剂用量以及对比剂肾病发生情况方面比较,差异均无统计学意义(均P>0.05)。但C组置入支架平均长度高于D组[(22.64±6.35)mm 比(16.05±4.21)mm,P < 0.001]和 S 组[(22.64±6.35)mm 比(17.32±5.01)mm,P<0.001],差异均有统计学意义。S组手术成功率明显低于D组(72.0%比100.0%,P=0.010)和C组(72.0%比100.0%,P<0.001),主要表现在S组需更改介入治疗技术方案发生率高于D组(24.0%比0.0,P=0.019)和C组(24.0%比0.0,P=0.001),且S组支架脱载发生率高于D组(12.0%比 0.0,P=0.010)和 C 组(12.0%比 0.0,P=0.019)。但是术中需使用球囊对吻扩张(kissing balloon inflation,KBI)发生率C组明显高于S组(22.7%比 0.0,P=0.010,表 2)。

表1 三组患者一般临床资料比较
2. 3 三组患者介入治疗术后住院期间及随访结果比较
三组患者住院期间累计的MACE发生率比较,差异无统计学意义(P>0.05)。但术后1年随访累计MACE发生率D组明显高于C组(25.0%比2.3%,P=0.002)和S组(25.0%比0.0,P=0.023),主要表现在术后1年随访TVR发生率D组高于C组(20.0%比2.3%,P=0.008)和S组(20.0%比0.0,P=0.045),另外C组术后1年随访对侧分支开口狭窄>50%发生率高于S组(22.7%比0.0,P=0.042,表3)。
3 讨论
冠状动脉开口病变特别是孤立性LAD或LCX开口病变一直是介入治疗的难点:单纯的球囊扩张即使使用了切割球囊,其远期疗效也不满意;而支架置入可以解决开口病变易弹性回缩特点,但早期常用的直接精确定位技术在裸金属支架时代的研究却显示了随访期内极高的ISR发生率[11-12];药物洗脱支架在多项研究中显示出了较裸金属支架更低的ISR发生率,但对于开口病变使用传统的直接精确定位技术仍未能明显降低MACE发生率[13-14],究其主要原因就是使用这种方法时不断跳动的心脏导致支架定位时前后移动幅度很大,不是支架进入目标血管过多难以完全覆盖开口病变,就是支架突入主干太多,远期支架内血栓形成及IRS发生率明显升高。Kang等[15]通过IVUS发现使用传统直接精确定位技术将会有28%的支架难以完全覆盖病变,超过50%的支架突入主干过多,特别是如果支架突入主干过多而主干直径又远远超过分支支架,突入主干的支架势必贴壁不良,发生支架内血栓形成风险明显升高。而使用跨越支架技术处理这样的病变所遇到问题恰恰如此,由于过多的支架钢梁突入至主支,势必需要使用更大号的非顺应性球囊高压后扩张以使突入至主干的支架充分贴壁,至于出现分叉处脊移位或斑块移位,往往需要使用KBI治疗,故已有研究报道显示随访期内出现分支开口严重受累而需要TUR治疗的比例很高[16]。而这点也与本研究结果相似,使用跨越支架技术治疗的患者随访期内有较高的分支开口狭窄发生率。在此基础上Katoh等[17]早在1997年即提出了边支导丝锚定技术来优化开口病变的介入治疗。Szabo等[3]将其进一步优化,2005年在TCT上详细报道了此项技术在实验动物和3例患者中的应用情况。此后的研究均报道了使用这项技术治疗冠状动脉开口病变(包括主动脉-冠状动脉开口病变及非主动脉-冠状动脉开口病变)显示了令人鼓舞的术后即刻及中期随访结果[18],更有心脏中心将此项技术作为治疗冠状动脉开口病变的常规方法。同样本研究结果也提示使用Szabo技术处理孤立性LAD或LCX开口病变近期及远期疗效均较直接精确定位技术或跨越支架技术满意(P<0.05,图5~7)。但同时本研究也发现使用Szabo技术仍存在很多问题,25例患者中,3例患者发生支架脱载(12.0%)而更改手术方式为直接精确定位技术,1例患者出现LM近端夹层(4%),3例患者因术中支架输送困难难以到位而更改手术方式为直接精确定位技术(12%),这失败的7例患者均存在以下1种或多种原因:(1)LM较长且开口成角,致使指引导管同轴性较差。(2)病变段极度扭曲,虽经过充分预扩张,支架通过该处仍然较困难,这种情况在使用Szabo技术时由于支架在进入血管前已经过重新整形,支架自身的通过外径(profile)较前明显增加,从而更加导致支架通过不成功。(3)目标血管与LM成角明显,导致整形后的支架无法通过。(4)使用的指引导管支撑力不够。(5)由于病变为LAD或LCX开口病变,所选支架较长、直径较大。这与Ferrer-Gracia等[19]研究报道的结果相似。鉴于此,使用Szabo技术时笔者认为应该使用7 F强支撑指引导管如EBU等,以使支架输送相对容易,且支架输送不畅时回收亦容易些,如支架实在难以到位需及时撤出用于锚定的分支导引钢丝,更改术式为直接精确定位技术,以避免发生支架脱载等严重并发症。另外,本研究还通过IVUS发现使用Szabo技术治疗孤立性LAD开口病变时较孤立性LCX开口病变的支架往往突入LM更多,可能与绝大多数LM与LCX成角更大些有关。正因为如此,使用Szabo技术治疗LAD开口病变时应避免LM与LAD成角过大或直径相差太大后突入LM的钢梁贴壁不良。本研究推荐常规使用IVUS指导术后的高压球囊后扩张。Vaquerizo等[20]研究也恰恰证实了这点,研究者通过IVUS发现使用Szabo技术治疗开口病变时有相当一部分患者支架突入至主支内且贴壁不良,分析其原因可能与特殊的成角致支架远端停留在主支内,锚定的分支导引导丝也有潜在的过度迁移破坏支架远端金属钢梁的结果,所以支架术后IVUS指导下高压球囊整形支架是必要的。
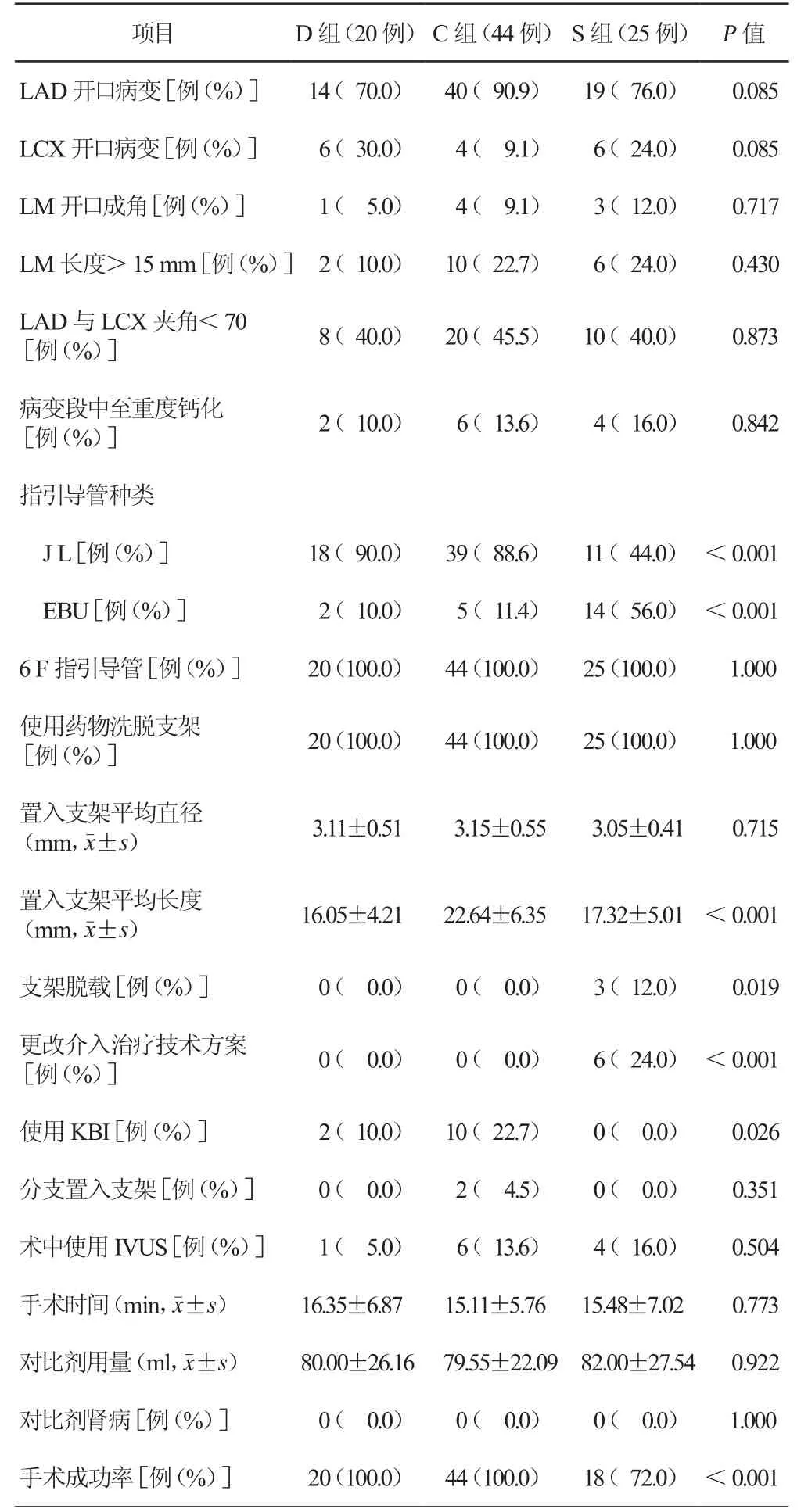
表2 三组患者冠状动脉造影特征及冠状动脉介入治疗资料比较
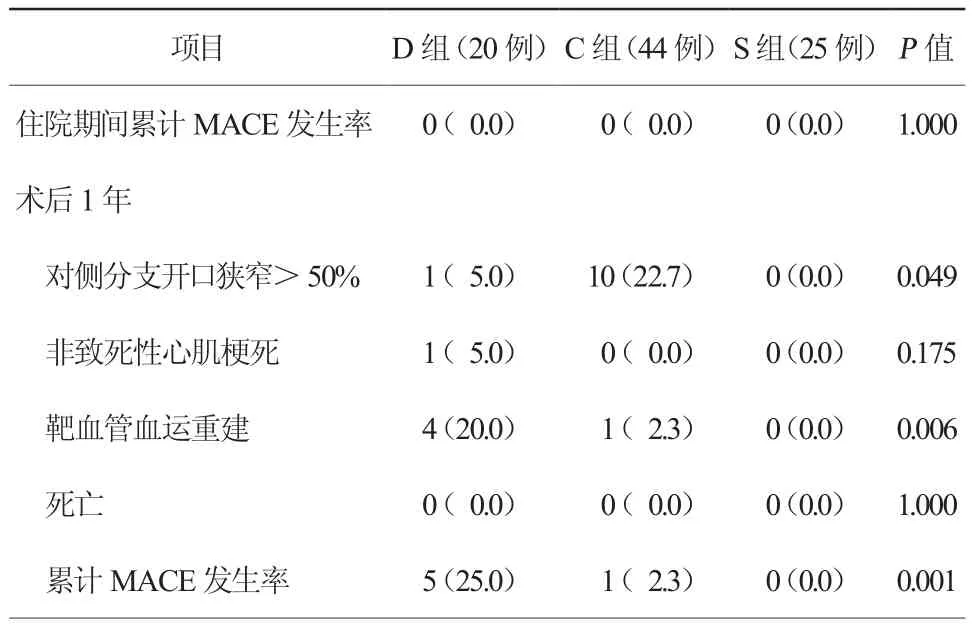
表3 三组患者介入治疗术后住院期间及随访结果比较[例(%)]

图5 以6 F EBU3.5指引导管配合两根Runthrough钢丝分别到达前降支及回旋支远端,精确定位前降支开口病变处支架

图6 支架置入术后即刻造影显示前降支开口充分被支架覆盖,远端TIMI血流Ⅲ级,未累及回旋支开口
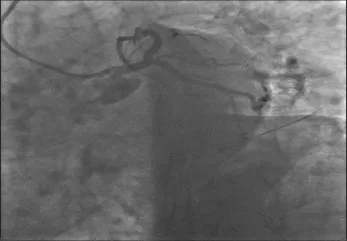
图7 术后1年冠状动脉造影复查显示前降支开口支架内通畅,无再狭窄,远端TIMI血流Ⅲ级,未累及回旋支开口
本研究结果证实了对于孤立性LAD或LCX开口病变介入治疗术式的选择需谨慎。跨越支架技术适用于目标血管病变弥漫需要长支架覆盖且血管直径与LM直径相差<1 mm,尤其是合并LM末端有病变时。而当目标血管直径与LM直径相差较大(>1 mm)时,在支架定位时如果发现支架随着心跳移位的幅度较小且有良好的投照体位可以显著暴露LM末端分叉部位的解剖特征,则可以选择精确定位支架技术处理。但当支架定位时发现支架随心跳移位幅度较大且没有很好的投照体位可以清楚暴露LM末端分叉部位的解剖特征时,建议使用Szabo技术,但需注意的是最好选择大口径及强支撑的指引导管支撑且在支架输送前需充分预扩张病变处狭窄,同时需做好支架输送失败后及时更改术式的准备,使用这项技术时还需常规结合IVUS指导支架置入后的高压球囊后扩张。
本研究的不足之处首先在于研究为回顾性的,其次所入选的病例数偏少。为此我们也大量查阅了近年来的相关国内外文献,发现报道的样本量也都在几十例左右,其中样本量大的要算Kwan等[5]发表于2012年的研究报道,该研究从2009年4月至2011年12月共入选了40例冠状动脉开口病变患者,但其中孤立性LAD开口病变患者仅有19例,孤立性LCX开口病变仅2例。故要得到更严谨的结论,今后仍需大样本量的随机对照研究来进一步证实。
