AM真菌对蓝莓根际微生态的影响*
2018-08-08韩薛婧娉陈侨月朱友银郭卫东陈文荣
潘 霞, 韩薛婧娉, 陈侨月, 杨 莉, 朱友银, 郭卫东, 陈文荣
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
0 前 言
蓝莓(Vacciniumspp.)为杜鹃花科越桔属浆果类经济植物,其果实内富含花青素等物质,具有提高视力、延缓衰老及防癌等功效,被国际粮农组织列为人类五大健康食品之一,近几年引起广泛关注[1].蓝莓虽然有近百年的商业种植历史,但我国蓝莓种植起步较晚,近年来,浙江等南方省份蓝莓产业发展迅猛,但栽培相关配套技术研究却严重滞后,目前仅有少量有关于蓝莓品种筛选及果实品质特性的研究报道[2].蓝莓根系浅,仅具大量细根而无根毛;同时,蓝莓为喜酸性植物,在碱性环境下容易出现叶片缺铁性失绿,引起蓝莓生长不良甚至死亡[3].这些特殊的生物学特性均与蓝莓根与根际土壤互作关系密切,在这一相互作用中,AM真菌可能发挥了重要的作用.
研究表明,接种AM真菌能够改善植株营养状况、促进植株生长[4]、增强植物抗病及抗逆性[5-6];同时,AM真菌通过生态位竞争等方式对土壤微生态进行有益调节[5-6].目前,国内外对大豆[6]、玉米[7]等作物的相关研究较多,对果树等木本植物的有限报道表明,AM真菌对果树具有促进养分吸收的作用,从而促进植株生长[8].已有研究表明,接种AM真菌后增强了‘奥尼尔’蓝莓对干旱胁迫的适应能力[9],接种不同AM真菌能不同程度提高蓝莓的抗寒性[10],但AM接种后对蓝莓的生物量生长及根际微生物的影响仍未见报道,AM菌侵染规律等相关机理仍缺乏研究.
AM真菌的接种效果取决于菌株、宿主植物、菌株与宿主植物的协调性及土壤生态条件等[11].基于气候、立地条件等因素的菌种选择是AM真菌在蓝莓生产上应用的关键,浙江等南方省份蓝莓产业发展较晚[2],目前未见相关研究报道.本研究以浙江省主栽蓝莓品种‘布里吉塔’为材料,接种4种AM真菌,从生物量生长、根系解剖结构等方面研究AM真菌与蓝莓根系的互作;从土壤酶活及微生物多样性调查等角度分析AM真菌对蓝莓根际微生物的生态结构组成的影响;深入分析AM真菌对蓝莓生长的作用机理,以期明确促进蓝莓生长的AM真菌种类,同时建立相关技术体系,促进蓝莓产业的健康发展.
1 材料与方法
1.1 植物材料及AM真菌处理
供试的4种AM真菌购自中国农业微生物菌种保藏管理中心.以通过组培苗扦插生长的一年生北高丛蓝莓‘布里吉塔’(Brigitta)作为供试蓝莓材料(取自浙江师范大学特色经济植物生物技术研究重点实验室),随机分成6组,每组10株,按盆栽培养的方法[12]将组培苗移植到灭菌土壤中,分别在植株根部1 cm处接种厚约1 cm的蜜色无梗囊霉、聚丛球囊霉、幼套球囊霉和摩西球囊霉(分别标记为A,B,C,D),另外2组分别用干热法进行灭菌处理(为M组)及空白对照(为K组).
所有蓝莓苗均置于同一室外条件下,使其在光照充足的26 ℃通风环境下生长,每2 d浇水1次,每5 d观察蓝莓长势.处理72 d后收获样品,称重,取样进行切片观察;同时用抖土法收集根际土进行酶活测定及微生态的分析(易于从根系上抖落的土壤为土体土壤,和根系紧密结合不易抖落的土壤为根际土壤).
1.2 AM真菌侵染情况观察
将72 d收获后的新鲜蓝莓幼苗洗净晾干,分别选取各组别粗细长短一致的初生根段进行切割,置FAA固定液(V(70%乙醇)∶V(冰醋酸)∶V(38%甲醛)=18∶1∶1)中充分浸透,固定3 h.将固定好的材料在70%乙醇中放置12 h后,依次经过70%,85%,95%直至100%乙醇的脱水处理,每次时间为2 h.经脱水、透明、浸蜡、包埋、切片、脱蜡等步骤制成蓝莓根系石蜡切片[13],在光学显微镜下观察AM真菌对蓝莓根系的侵染情况[14],并对其侵染情况进行分析.
1.3 土壤微生物种类多样性分析
采集的土壤样品根据Omega Soil Kit试剂盒说明书进行总DNA的提取,总DNA适当稀释后进行2轮PCR扩增.PCR反应体系为50 μL,其中包括10×PCR反应缓冲液(MgCl2) 5 μL,10 mmol/L的dNTP溶液4 μL,上下游引物各2 μL,Taq DNA聚合酶1 μL,DNA模板为2 μL,蒸馏水34 μL.扩增程序设定:94 ℃下预变性5 min,94 ℃变性40 s,55 ℃退火40 s,72 ℃延伸1 min,经过35个循环后,72 ℃延伸10 min,最后在4 ℃条件下保存.扩增结束后,用1%琼脂糖凝胶电泳检测PCR扩增产物.
第1次PCR:引物为真菌ITS通用引物58Sf-GC 和28S1-r扩增,细菌通用引物534和341-GC扩增.以上述PCR产物为模板进行再次PCR 扩增(Reconditioning-PCR).
第2轮PCR产物浓缩后取15 μL,采用Bio-Rad公司Dcode TM的基因突变检测系统进行DGGE分析.制备DGGE梯度凝胶[15].真菌采用8%的聚丙烯酰胺凝胶,变性梯度为45%~80%(40%的去离子甲酰胺与7 mol/L的尿素的混合物为100%变性剂);细菌则采用6%的聚丙烯酰胺凝胶,变性梯度为40%~60%.65 ℃,50 V电泳13 h.电泳完成后,采用银染法[16]进行DGGE胶染色.将观察到的结果用Bio-Rad Gel Doc 2000凝胶成像系统进行拍照,并使用Bio-Rad Quantity One软件对DGGE条带进行系统分析.
1.4 土壤微生物丰度测定
采用稀释涂平板[17]的方法,分别配制牛肉膏蛋白胨培养基、高氏培养基和PDA培养基以适合细菌、放线菌和真菌生长,制备不同稀释度的根际土壤悬液.在各培养基中选取稀释度为10-3,10-4和10-5的土壤菌悬液进行接种,分别在适宜温度下培养至菌落数稳定后,计算菌落数.同一平板计数时,至少对其进行重复3次计数,然后记录其平均值.土壤微生物数量(CFU/g)为每克土壤中的菌落平均数乘以稀释倍数.
1.5 土壤酶活性的测定
采集的土壤样品风干后进行酶活性测定.脲酶活性采用苯酚钠-次氯酸钠比色法,其活性以24 h后1 g土壤中NH3-N的mg数表示[18];蔗糖酶与纤维素酶活性采用3,5-二硝基水杨酸比色法,活性分别以24 h后1 g干土生成的葡萄糖mg数,以及72 h后1 g干土生成的葡萄糖mg数表示[19];过氧化氢酶活性采用高锰酸钾滴定法,活性以每g干土1 h内消耗的0.1 mol/L KMnO4体积数表示[19].
所有实验结果的测定,至少重复3次,数据采用平均数±标准误差表示,并进行方差分析.主要应用方差分析、最小差异显著性(邓肯氏新复极差法)检验(P<0.05)、T检验这3种方法对数据进行分析,均采用SPSS 10.0统计软件进行分析.
2 结果与分析
2.1 AM真菌处理对蓝莓植株生长的影响
与灭菌处理组(M组)相比,4种AM真菌处理后的蓝莓生长量普遍提高,这种对生物量的促进作用在地下部尤为显著;而在地上部,仅B,C组显著高于对照组(K组),分别为对照组的169%及170%.4种候选AM真菌中,聚丛球囊霉(G.agregatum,即B组)的接种对蓝莓植株生长的促进作用最明显,地下部分及地上部分别为对照组的1.12和1.29倍,而接种蜜色无梗囊霉对蓝莓植株生长的效果与对照组无显著差异.
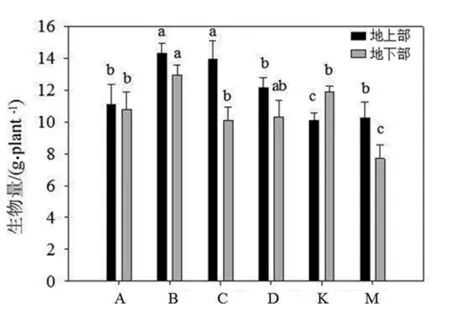
不同小写字母表示同一品种不同处理在P<0.05水平上呈显著差异
2.2 蓝莓根系AM真菌侵染影响
接种AM菌72 d后,从石蜡切片的显微结构观察到,AM真菌在蓝莓根中形成泡囊、丛枝及菌丝,表明丛枝真菌与蓝莓根系建立了明显的的共生关系(见图2).而对照组及灭菌处理组内的菌丝与泡囊均很少见,呈现正常的根纵切图.菌丝可存在于根外及细胞间隙中,也可存在于细胞内;菌根形成泡囊结构,其结构为球形和椭圆形,分布在根的皮层.根系的泡囊丰度代表了泡囊在整个根系中的丰富程度,图2中c为B菌接种的蓝莓根内典型细胞图,泡囊密度显著高于其他菌株处理及空白对照.各处理组样品侵染程度有所差别,B组显著高于其他组别.蓝莓菌根侵染率分级标准与侵染强度标准参考文献[20].侵染后供试植株的孢子数量也存在显著差异,接种聚丛球囊霉(B组)的孢子数量最高,平均为38个,而A组、C组和D组的平均孢子数分别为17个、26个和21个(见表1).
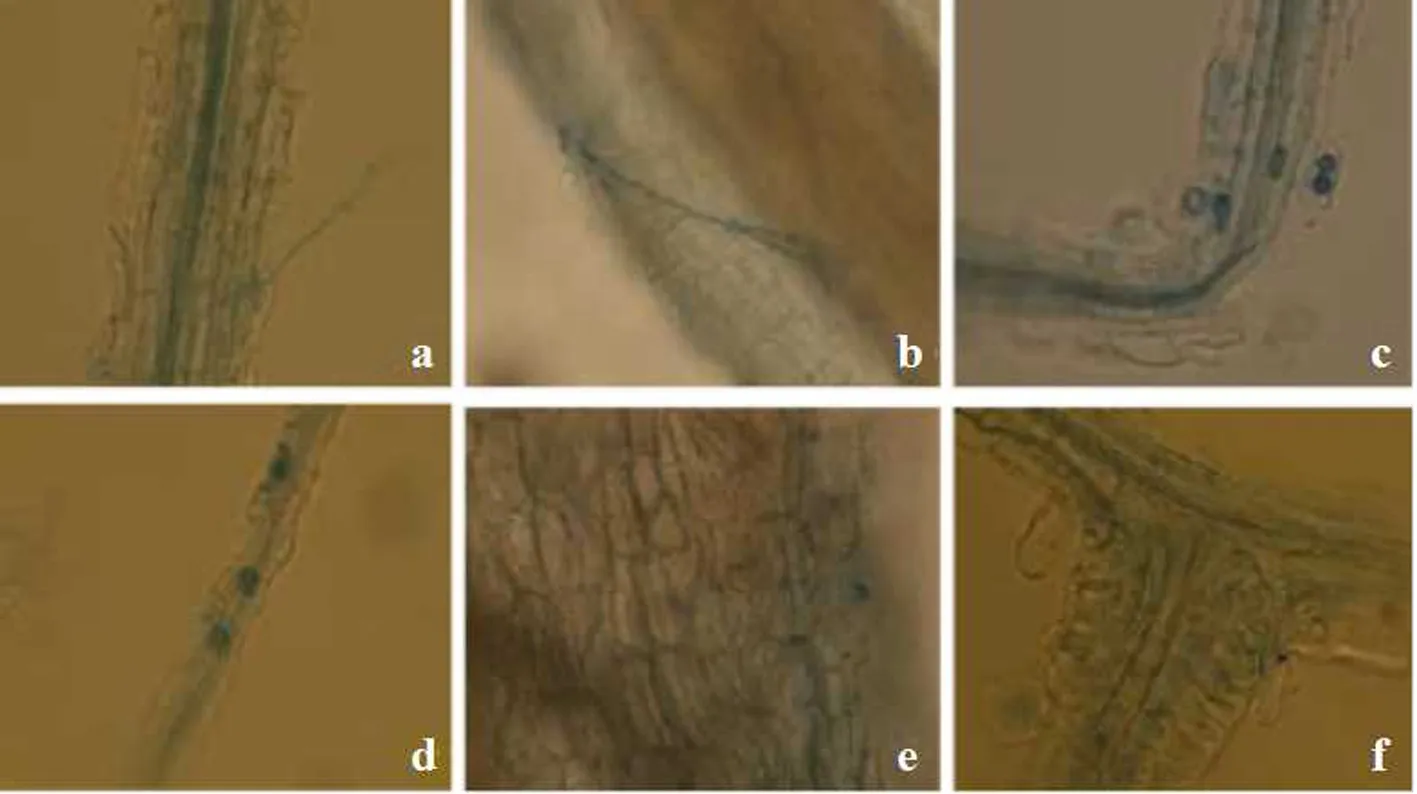
a~f分别为:根外菌丝、根内菌丝及丛枝、泡囊、侵入点、M组根系切片和K组根系切片
表1 接种不同AM真菌后蓝莓根际菌根侵染率
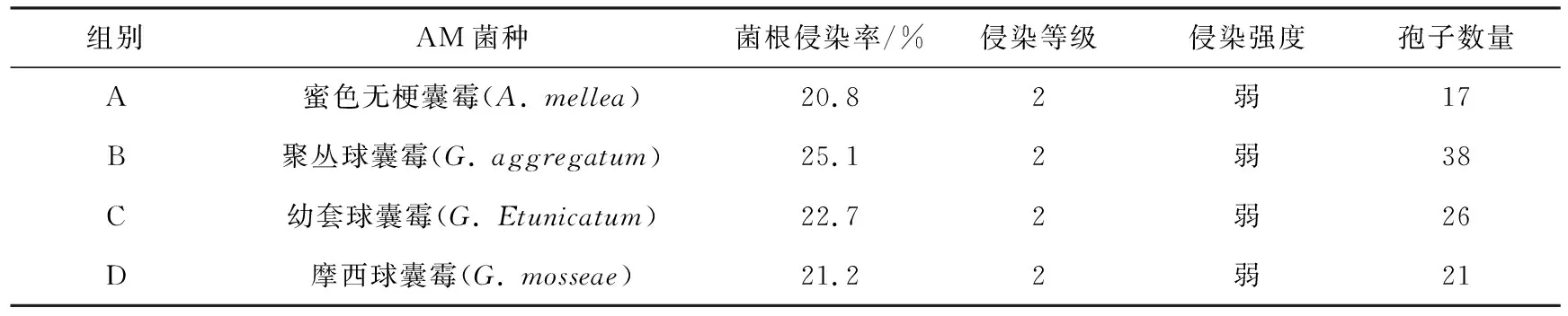
组别AM菌种菌根侵染率/%侵染等级侵染强度孢子数量A蜜色无梗囊霉(A. mellea)20.82弱17B聚丛球囊霉(G. aggregatum)25.12弱38C幼套球囊霉(G. Etunicatum)22.72弱26D摩西球囊霉(G. mosseae)21.22弱21
2.3 AM真菌处理对蓝莓根际土壤微生物量的影响
经AM真菌处理后的蓝莓根际微生物的分布发生大幅度的改变,其中细菌的分布显著减少,而放线菌与真菌的分布大幅度增加(见图3).与未处理的蓝莓组相比,接种蜜色无梗囊霉(A组)的处理放线菌、真菌、细菌分别为对照的197.1%,157.4%及61.5%;接种聚丛球囊霉(B组)相应变化率为275.5%,189.3%及8.3%;另2个菌接种后微生物多样性变化率介于以上二者之间.由此可见,AM真菌接种促使根际微生态向“真菌型”发展.
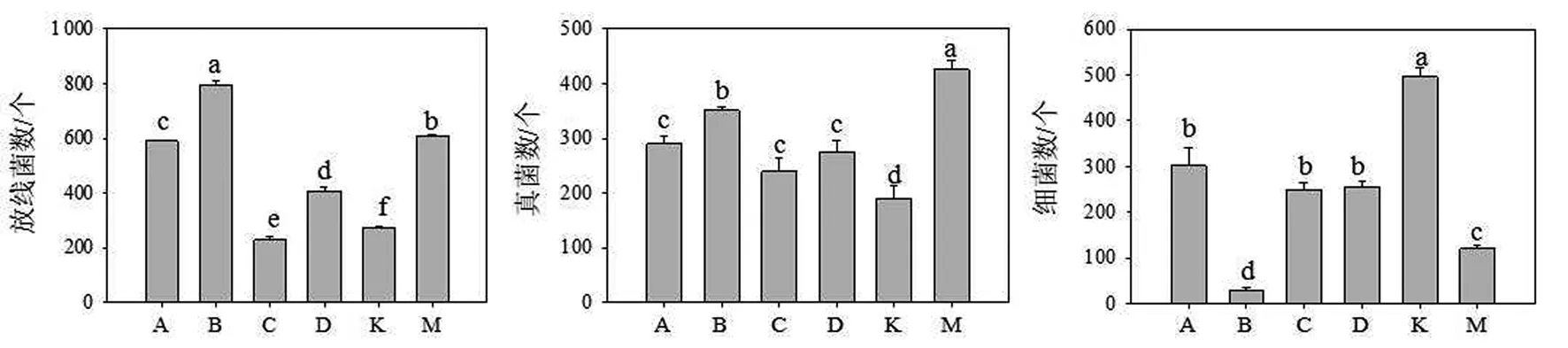
不同小写字母表示同一品种不同处理在P<0.05水平上呈显著差异
2.4 PCR-DGGE 法探究根际微生物多样性
变性梯度凝胶电泳(DGGE)能够分离PCR产物中不同碱基序列的片段,由此得到数目及位置各不相同的电泳条带,从而用来分析菌群结构在不同处理下的差异性及多样性.DGGE中的每一个条带都和菌群中的某一优势群落或操作分类单元(operational taxonomic unit,OUT)相对应,条带数目与微生物多样性的丰富程度相对应,而染色后DGGE条带的亮度越亮,则说明了该种群数量越多,从而能够反映土壤中微生物的种类和数量.

图4 16S rRNA V3扩增片段的DGGE图谱 图5 ITS rRNA扩增片段的DGGE图谱
由DGGE结果可知,各处理PCR产物通过变性梯度凝胶电泳得到了有效地分离,每一条泳道上都出现了大量条带.对所得到的DGGE图谱进行Quantity one软件分析,结果显示,在不同处理条件下土壤DGGE图谱上条带的数目不等,位置也存在一定差异,细菌群落结构处理组有许多公共条带,且这些条带在亮度上变化不大(见图4),这表明细菌群落结构单一,与对照组相比,4个处理组的细菌丰富度变化不明显;真菌群落结构处理组A,B,C,D与对照组M,K相比,有明显差异.对DGGE数据分析可知(见图5),不同处理组之间存在某些特有条带,这表明不同处理下,土壤中真菌种群的构成发生了改变,真菌类型出现了不同程度的增加或减少.对比各处理间的公共条带,发现有些条带的亮度产生了明显的差异,这说明这些共有的真菌种群在数量上发生了变化.从总体上看,真菌群落变化较大,4个处理组均比对照组丰富度高且处理组之间差异较明显,真菌类型发生了改变,说明不同的真菌对蓝莓土壤中的真菌群落结构的影响不同,从而改变了土壤中的真菌群落结构.
2.5 AM真菌对土壤酶活的影响
4种AM菌株均显著提高蓝莓根际土壤的纤维素酶、蔗糖酶及过氧化氢酶活性,其中蜜色无梗囊霉(A组)处理下的蓝莓根际土壤中纤维素酶活达到最大值为5 U;4种AM菌种相较而言,蜜色无梗囊霉(A组)和幼套球囊霉(C组)对纤维素酶活的促进要高于另外2个菌种(见图6).4种AM菌种处理之间对蓝莓根际蔗糖酶及过氧化氢酶均有促进作用,但4种菌株间无显著差异.接种4种AM真菌中,仅聚丛球囊霉对脲酶酶活性产生显著影响.
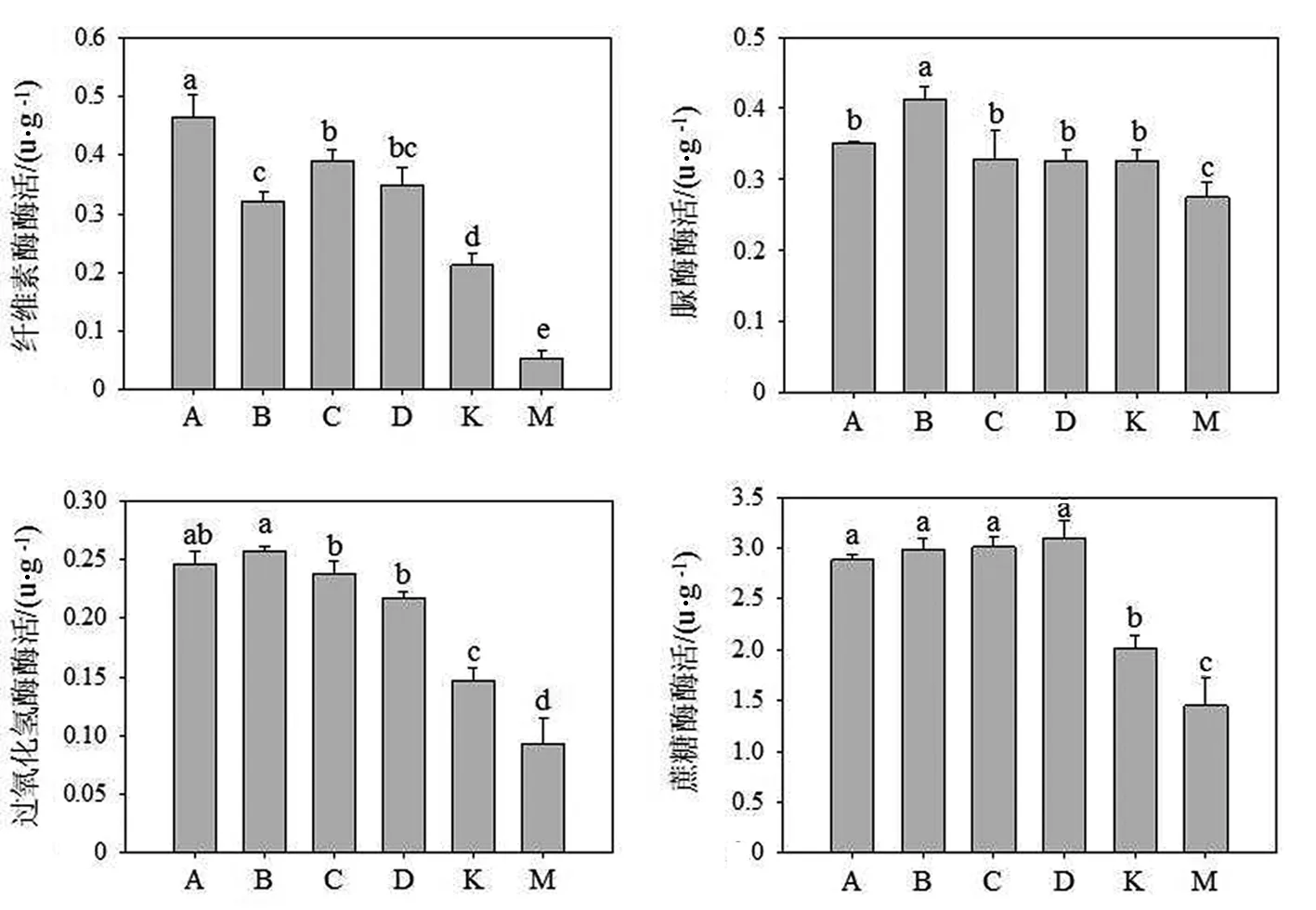
不同小写字母表示同一品种不同处理在P<0.05水平上呈显著差异
3 讨 论
蓝莓作为浅根系植物,根系结构独特,仅具细根而无根毛,目前普遍认为根部共生的AM真菌对其养分吸收发挥了重要作用[21].但也有研究表明,AM真菌与兔眼及高丛蓝莓的互作对其生物量的生长均无明显作用[22-23].本研究中,4种AM真菌处理后的蓝莓生长量普遍提高,对生物量的促进作用在地下部尤为显著,表明AM真菌对蓝莓生产普遍具有积极的意义.4种候选AM真菌菌种中,聚丛球囊霉(即B组)的接种对蓝莓生长促进作用最大,这与高丽霞等[24]的研究结果相一致.AM接种效果受菌株及土壤生态条件等多重因素影响[9],球囊霉属的适应范围最广、能力最强,pH 5.0~9.0的土壤中均有分布[25],本研究中的聚丛球囊霉很可能更加适应蓝莓根际微环境.
AM真菌侵染宿主植物根系形成菌根后,显微切片能够较好地显示侵染结果.本研究中,虽然4种AM真菌对蓝莓根系的侵染率较弱,但根系在光学显微镜下均能观察到明显的丛枝菌根真菌的菌丝、泡囊,其可存在于细胞中,也可存在于细胞间隙[26];同时在根部皮层结构内可观察到典型的泡囊结构,呈球形和椭圆形.聚丛球囊霉(即B组)接种后的蓝莓细根中泡囊密度及频度均最高,侵染率达25.1%,表明其在根内的丰富度最大[27],这可能是该处理组生物量生长最大的重要原因.
植物与AM真菌的共生关系还可能通过调节根际微生物多样性间接影响宿主植物的生长[28].本研究中,AM真菌对蓝莓土壤中的真菌群落生长起到促进作用,同时,细菌群落结构出现“真菌化”现象,即形成真菌菌群结构多样性增加、细菌菌群丰度减少的趋势.龚娜等[32]研究发现,接种真菌促生菌液使根际细菌数量显著减少,真菌数量有所增加,这与笔者的研究结果相一致.一般而言,以真菌为主的根际微生物结构更加有利于植物生长[11],据此推测AM真菌接种蓝莓后通过生态位竞争方式将有害菌生长势弱化,从而使有益菌成为优势菌种[29].
土壤酶主要来自微生物及植物根系分泌等途径,蔗糖酶和纤维素酶参与蔗糖及纤维素等糖类的降解,其活性可表征土壤生物学活性强度及评价土壤熟化程度和土壤肥力[30].本研究中,4种AM菌株均显著提高蓝莓根际土壤的纤维素酶、蔗糖酶,表明AM真菌可通过增加有益菌群而促进土壤酶活的改变,达到增加土壤可溶性营养的目的.许庆龙[9]研究发现接种AM真菌后提高了蓝莓植株根围土壤酸性磷酸酶、脲酶和过氧化氢酶活性,尤以聚丛球囊霉处理明显.过氧化氢酶能将H2O2分解成H2O和O2,对动植物的生长发育和代谢活动具有保护作用[31],AM真菌对其活性的提高作用有利于根部的抗氧化保护.本研究采用的4种AM菌株中仅聚丛球囊霉(即B组)接种后脲酶活性显著高于空白对照,从侧面反映了聚丛球囊霉可对根际土壤进行有益调节.
由此可见,蓝莓根系接种AM真菌后能形成共生体系,此种共生关系能够显著改善根际微生态环境,使根际微生物向“真菌型”转变,有益微生物的增加还可使蔗糖酶等土壤有益酶酶活提高,增强了根际可溶性营养,并最终促进蓝莓的生物量生长.
